| |
| Med Sci (Paris). 2011 February; 27(2): 135–137. Published online 2011 March 8. doi: 10.1051/medsci/2011272135.Syndrome de Kallmann Une séquence fœtopathologique Fabien Guimiot,1 Luis Teixeira,2 Catherine Dodé,2 Anne-Lise Delezoide,1 and Jean-Pierre Hardelin3* 1Service de fœtopathologie, Hôpital Robert Debré, 48, boulevard Sérurier, 75019Paris, France 2Institut Cochin, Département de génétique et développement, 24, rue du Faubourg Saint-Jacques, 75014Paris, France 3Institut Pasteur, Département de neuroscience, 25, rue du Docteur Roux, 75015Paris, France MeSH keywords: Humains, Syndrome de Kallmann, embryologie, génétique, physiopathologie |
Sexe et nez : un lien embryologique… La gonadolibérine ou gonadotropin-releasing hormone (GnRH) contrôle l’axe hormonal de la reproduction. Des études embryologiques effectuées depuis une vingtaine d’années chez les mammifères, les oiseaux et les poissons ont montré que les cellules neuroendocrines qui synthétisent cette hormone proviennent de l’épithélium nasal et migrent vers le télencéphale en empruntant le trajet des nerfs olfactifs. Chez les mammifères, elles migrent en fait le long des fibres du nerf voméro-nasal (impliqué dans la perception des phéromones) et du nervus terminalis (dont le rôle dans la reproduction reste mal connu) [
1]. Parvenues à la base du télencéphale, elles y pénètrent, avec les fibres du nervus terminalis, juste en arrière de l’ébauche des bulbes olfactifs, et cheminent ensuite dans la partie interne des futurs hémisphères cérébraux jusqu’aux régions préoptique et hypothalamique, où elles établiront la neurosécrétion endocrine. Dans l’espèce humaine, la migration de ces cellules débute au cours de la 6e semaine de vie embryonnaire. C’est aussi la période où les fibres des nerfs olfactifs et celles des nervus terminalis établissent leur premier contact avec le cerveau, peu de temps avant l’émergence des bulbes olfactifs. |
Le syndrome de Kallmann associe un hypogonadisme hypogonadotrope, dû à un déficit en gonadolibérine, et une anosmie (ou hyposmie) accompagnée d’une aplasie des bulbes olfactifs [
2]. Le plus souvent, le diagnostic est fait à l’âge de la puberté, devant l’absence d’apparition des caractères sexuels secondaires. L’examen histopathologique d’un fœtus de sexe masculin âgé de 19 semaines et porteur, dans la région Xp22.3, d’une grande délétion chromosomique incluant le gène KAL1 responsable de la forme récessive liée au chromosome X de ce syndrome, avait permis, dès 1989, de formuler l’hypothèse d’un défaut de la migration des cellules neuroendocrines à l’origine de l’hypogonadisme du syndrome de Kallmann. Chez ce fœtus, qui n’avait pas de bulbes olfactifs, les cellules neuroendocrines étaient en effet absentes du cerveau : elles s’étaient accumulées dans la région naso-frontale avec les terminaisons des nerfs olfactif et terminalis, dont les fibres interrompues n’établissaient pas de contact avec le télencéphale [
3] (Figure 1B).  | Figure 1
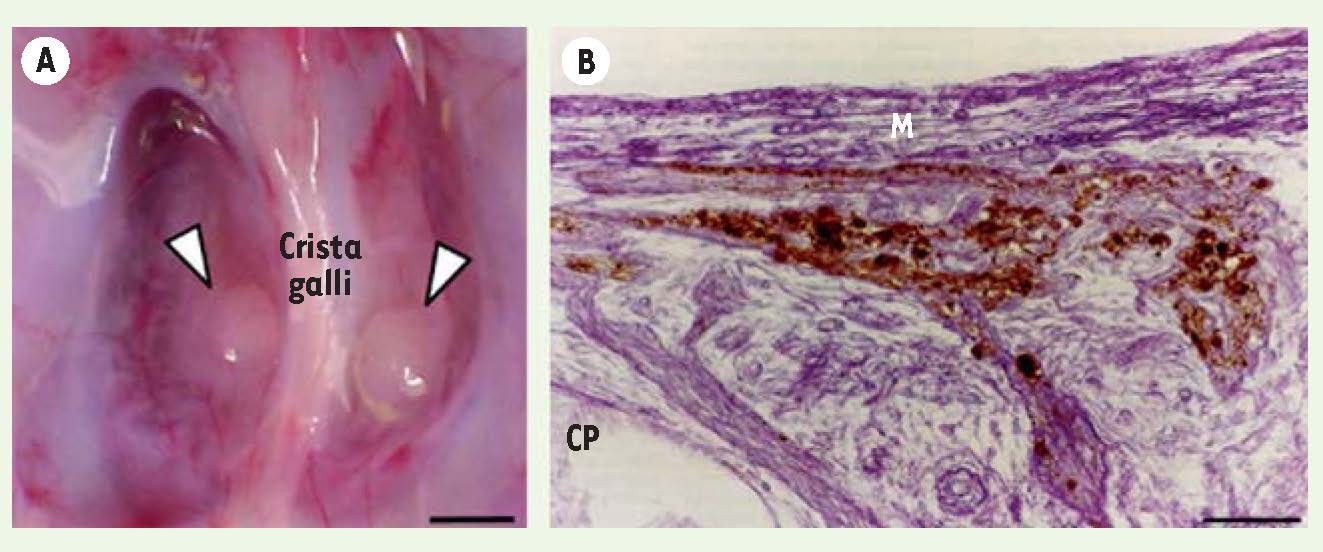
Pathogenèse du syndrome de Kallmann : la séquence fœtopathologique olfacto-génitale. A. Vue endocrânienne de la région de la lame criblée de l’ethmoïde chez un fœtus de 23 semaines atteint du syndrome CHARGE, maladie pléiotrope du développement incluant un syndrome de Kallmann. Les têtes de flèche indiquent, de part et d’autre de l’apophyse crista galli, des névromes d’environ 1 mm de diamètre, formés par l’enchevêtrement des fibres interrompues des nerfs olfactif et terminalis. Barre d’échelle : 1 mm. B. Coupe parasagittale de la région naso-frontale chez un fœtus KAL1 de 19 semaines atteint de la forme liée au chromosome X du syndrome de Kallmann. Contre-coloration au violet de crésyl. Des amas de cellules synthétisant la GnRH (colorées en brun par une réaction immunochimique grâce à un anticorps spécifique de ce décapeptide), dont la migration vers le télencéphale est interrompue, sont visibles entre la face dorsale de la lame criblée de l’ethmoïde (l’abréviation CP se réfère au nom anglais, cribriform plate) et la dure-mère (M, méninge) (barre d’échelle : 100 μm). |
L’arhinencéphalie, c’est-à-dire l’absence des bulbes olfactifs, qui est l’une des anomalies du syndrome de Kallmann, est également observée dans différentes maladies pléiotropes du développement, notamment dans le syndrome CHARGE (l’appellation « maladie CHARGE » serait d’ailleurs plus appropriée), dont l’incidence est estimée à 1 sur 8 500 à 12 500 naissances. L’acronyme anglais CHARGE désigne l’association atrésie des choanes, cardiopathie congénitale, retard de croissance, hypoplasie des organes génitaux et anomalies de l’oreille externe et interne [
4]. Cependant, de nombreux individus atteints de cette maladie n’ont pas toutes les anomalies phénotypiques qui composent l’acronyme et en ont par ailleurs souvent d’autres [
5]. Une étude assez récente a conclu en particulier à la coexistence, chez la plupart des patients, d’un hypogonadisme hypogonadotrope et d’une anosmie avec arhinencéphalie, c’est-à-dire des deux anomalies qui définissent le syndrome de Kallmann [
6]. Le syndrome CHARGE est dû, dans environ deux tiers des cas, à une mutation dans le gène CHD7 qui code une protéine de liaison à l’ADN impliquée dans la transcription de certains gènes. Des mutations de ce gène ont également été identifiées chez quelques individus pour lesquels le diagnostic initialement porté était celui d’un syndrome de Kallmann, renforçant ainsi l’idée d’une parenté nosologique entre ces deux entités [
7,
8]. Il était donc logique de se demander si l’hypogonadisme du syndrome CHARGE résultait lui aussi d’un défaut de la migration embryonnaire des cellules synthétisant la GnRH. L’arhinencéphalie se rencontre aussi dans la trisomie 13 ou la trisomie 18 [
9]. Ces trisomies s’accompagnent d’ailleurs souvent, chez le garçon, d’une cryptorchidie et d’un micropénis, signes évocateurs d’un hypogonadisme hypogonadotrope. Nous avons donc étudié, par immunomarquage sur des coupes du cerveau antérieur et des coupes de la région naso-frontale, la localisation des cellules synthétisant la GnRH chez des fœtus humains arhinencéphales atteints du syndrome CHARGE, de trisomie 13, ou de trisomie 18, pour lesquels la gravité des malformations associées avait conduit à interrompre la grossesse au-delà de 18 semaines de développement. Dans tous les cas, nous n’avons détecté que peu ou pas de cellules neuroendocrines dans les régions préoptique et hypothalamique où elles auraient dû se trouver à ce stade du développement. En revanche, de nombreuses cellules synthétisant la GnRH étaient présentes dans la région naso-frontale de ces fœtus, reproduisant ainsi la situation déjà décrite chez le fœtus atteint du syndrome de Kallmann dans sa forme liée au chromosome X. Chez certains de ces fœtus, les fibres interrompues des nerfs olfactif et terminalis formaient même, par leur enchevêtrement, des névromes d’environ 1 mm de diamètre, visibles à la face endocrânienne de la lame criblée de l’ethmoïde et recouverts par la dure-mère [
10] (Figure 1A). |
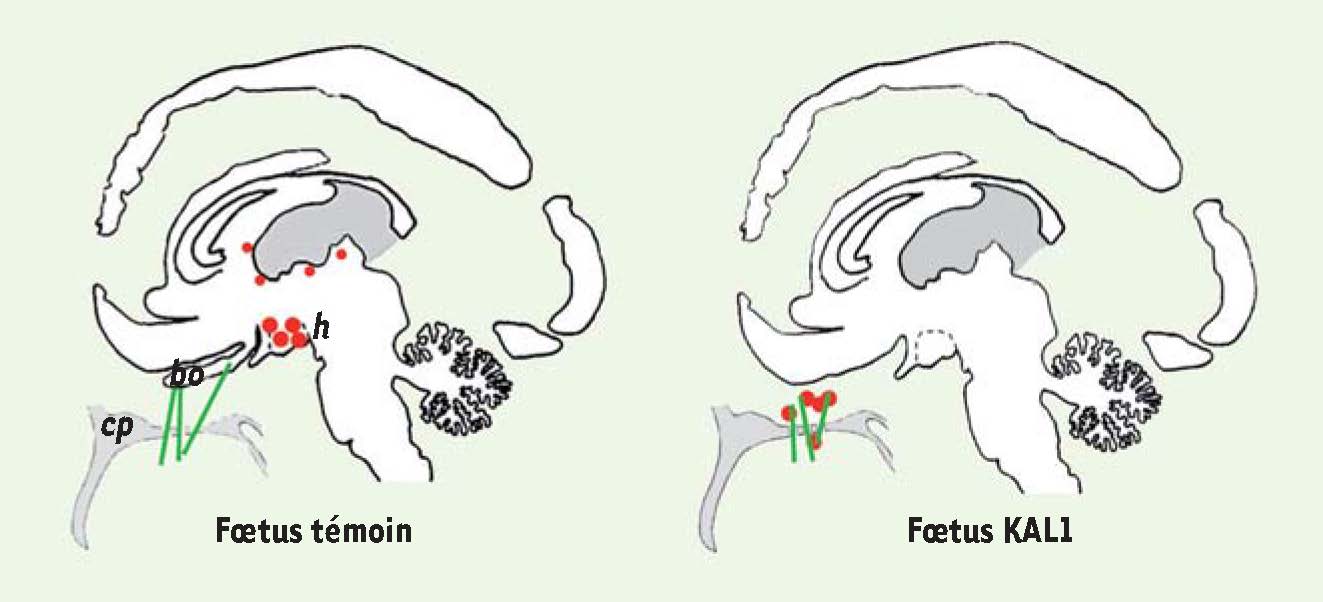
Une séquence pathologique commune, des causes génétiques diverses Ces observations, effectuées sur des fœtus atteints d’arhinencéphalie d’origines génétiques différentes, permettent de conclure à l’existence d’une nouvelle séquence fœtopathologique, que nous proposons de nommer séquence olfacto-génitale, par laquelle une anomalie précoce de développement du système olfactif périphérique entraîne un hypogonadisme par déficit hypothalamique en cellules neuroendocrines, du fait d’un arrêt de leur migration dans la région naso-frontale (Figure 2). Le syndrome de Kallmann (anosmie + hypogonadisme hypogonadotrope) en est la conséquence clinique. Ce syndrome, hétérogène au plan génétique, peut résulter de la mutation d’un gène unique (KAL1, FGFR1, FGF8, PROKR2, PROK2, CHD7, etc.), de plusieurs mutations synergiques dans le cadre d’une maladie digénique ou oligogénique comme cela a déjà été montré dans quelques cas, ou encore, plus rarement, s’intégrer dans un syndrome de gènes contigus en rapport avec la délétion de gènes voisins sur un chromosome (région Xp22.3 où se situe KAL1, région 8p11-p12 où se situe FGFR1) [2]. Il peut aussi être associé à la duplication d’un chromosome entier comme nous venons de le montrer par l’analyse des fœtus atteints de trisomie 13 ou 18 [10]. Bien que les gènes dont la surexpression est à l’origine de la séquence olfacto-génitale ne soient pas encore identifiés sur les chromosomes 13 et 18, et en supposant que ces gènes soient uniques, il est tentant de penser que certains individus atteints du syndrome de Kallmann pourraient être porteurs, dans ces gènes, d’une mutation entraînant un « gain de fonction ».  | Figure 2
Distribution des cellules synthétisant la GnRH. Représentation schématique de la distribution des cellules synthétisant la GnRH chez un fœtus témoin de 24 semaines et chez un fœtus arhinencéphale KAL1 du même âge, porteur d’une mutation dans le gène responsable de la forme liée au chromosome X du syndrome de Kallmann. Les traits verts indiquent le trajet des fibres des nerfs olfactif et terminalis. Les points rouges représentent l’emplacement des cellules synthétisant la GnRH. Chez le fœtus témoin, la plupart de ces cellules sont localisées dans l’aire préoptique et la région hypothalamique (h). Quelques cellules éparses, vraisemblablement égarées au cours de leur migration, sont détectées à proximité du ventricule latéral (coloré en gris). Chez le fœtus KAL1, la migration des cellules synthétisant la GnRH s’est arrêtée avant leur pénétration dans le télencéphale. Elles se sont accumulées dans la région naso-frontale, avec les fibres interrompues des nerfs olfactif et terminalis qui n’ont pas non plus établi de contact avec le cerveau. Noter l’absence des bulbes olfactifs (bo) chez ce fœtus. Cp : lame criblée de l’ethmoïde (cribriform plate). |
Au plan clinique, le syndrome de Kallmann peut être isolé, ou associé à un ou plusieurs autres signes résultant d’anomalies du développement en dehors des systèmes olfactif ou reproducteur. La présence et la nature de ces signes additionnels dépendent du ou des gènes mutés [2]. Ces signes peuvent donc, lorsqu’ils sont présents, orienter la recherche de mutations chez un individu atteint du syndrome de Kallmann dans le cadre d’un conseil génétique. Ainsi, l’existence de syncinésies controlatérales d’imitation (mouvements en miroir) ou d’une agénésie rénale conduit-elle à rechercher d’abord une mutation de KAL1, tandis que la présence d’une fente labiale et/ou palatine fait rechercher d’abord une mutation de FGFR1 ou FGF8. Certaines anomalies comme l’hypodontie (absence d’une ou plusieurs dents) ou l’hypoacousie (baisse de l’acuité auditive) peuvent, quant à elles, résulter de la mutation de différents gènes. Quant au syndrome CHARGE, véritable maladie pléiotrope du développement, sa variabilité phénotypique a été envisagée précédemment, mais l’agénésie des canaux semi-circulaires de l’oreille interne (à rechercher par l’imagerie tomodensitométrique des rochers) semble y être quasi constante [5]. Moins d’un tiers des individus atteints du syndrome de Kallmann (en dehors du syndrome CHARGE) sont porteurs d’une mutation dans un des gènes déjà identifiés, ce qui indique que d’autres gènes impliqués dans ce syndrome restent à découvrir. Leur identification permettra notamment de déterminer, à côté des cas de transmission authentiquement monogénique du syndrome, la proportion des cas de transmission digénique ou oligogénique qui demeure inconnue à ce jour. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Schwanzel-Fukuda
M
,
Pfaff
DW
. Origin of luteinizing hormone-releasing hormone neurons . Nature.
1989; ; 338 : :161.-164. 2.
Dodé
C
,
Hardelin
JP
. Kallmann syndrome . Eur J Hum Genet.
2009; ; 17 : :139.-146. 3.
Schwanzel-Fukuda
M
,
Bick
D
,
Pfaff
DW
. Luteinizing hormone-releasing hormone (LHRH)-expressing cells do not migrate normally in an inherited hypogonadal (Kallmann) syndrome . Mol Brain Res.
1989; ; 6 : :311.-326. 4.
Pagon
RA
,
Graham
JM
Jr
,
Zonana
J
,
Yong
SL
. Coloboma, congenital heart disease, and choanal atresia with multiple anomalies: CHARGE association . J Pediatr.
1981; ; 99 : :223.-227. 5.
Sanlaville
D
,
Verloes
A
. CHARGE syndrome: an update . Eur J Hum Genet.
2007; ; 15 : :389.-399. 6.
Pinto
G
,
Abadie
V
,
Mesnage
R
, et al.
CHARGE syndrome includes hypogonadotropic hypogonadism and abnormal olfactory bulb development . J Clin Endocrinol Metab.
2005; ; 90 : :5621.-5626. 7.
Kim
HG
,
Kurth
I
,
Lan
F
, et al.
Mutations in CHD7, encoding a chromatin-remodeling protein, cause idiopathic hypogonadotropic hypogonadism and Kallmann syndrome . Am J Hum Genet.
2008; ; 83 : :511.-519. 8.
Jongmans
MC
,
van Ravenswaaij-Arts
CM
,
Pitteloud
N
, et al.
CHD7 mutations in patients initially diagnosed with Kallmann syndrome: the clinical overlap with CHARGE syndrome . Clin Genet.
2009; ; 75 : :65.-71. 9.
Delezoide
AL
,
Narcy
F
,
Larroche
JC
. Cerebral midline developmental anomalies: spectrum and associated features . Genet Couns.
1991; ; 1 : :197.-210. 10.
Teixeira
L
,
Guimiot
F
,
Dodé
C
, et al.
Defective migration of neuroendocrine GnRH cells in human arrhinencephalic conditions . J Clin Invest.
2010; ; 120 : :3668.-3672. |