| |
| Med Sci (Paris). 2011 January; 27(1): 77–81. Published online 2011 February 10. doi: 10.1051/medsci/201127177.Imagerie et cognition (1) - La neuro-imagerie : un outil diagnostique des états de conscience altérée Marie Thonnard,1 Mélanie Boly,1 Marie-Aurélie Bruno,1 Camille Chatelle,1 Olivia Gosseries,1 Steven Laureys,2* and Audrey Vanhaudenhuyse1** 1Coma science group, Centre de recherches du cyclotron, Université et centre hospitalier universitaire de Liège, Sart-Tilman, B30, 4000 Liège, Belgique 2Coma science group, Centre de recherches du cyclotron, département de neurologie, Centre hospitalier universitaire de Liège, Sart-Tilman, 4000 Liège, Belgique |
L’état végétatif (EV), l’état de conscience minimale (ECM) et le locked-in syndrome (LIS) sont autant d’états qui peuvent succéder à un coma. Ces états se distinguent par le niveau de conscience et d’éveil qui leur est associé. L’éveil correspond au niveau de vigilance sous-tendu par les systèmes sous-corticaux du tronc cérébral, le mésencéphale et le thalamus. Alors que la conscience, ou le contenu conscient, est associée au cortex cérébral et à ses connexions sous corticales [
1,
2]. Le coma est un état limité dans le temps dont la durée n’excède généralement pas deux à quatre semaines. Un patient dans le coma peut évoluer soit vers la mort cérébrale, soit vers un EV [
3], soit vers une récupération de conscience rapide (
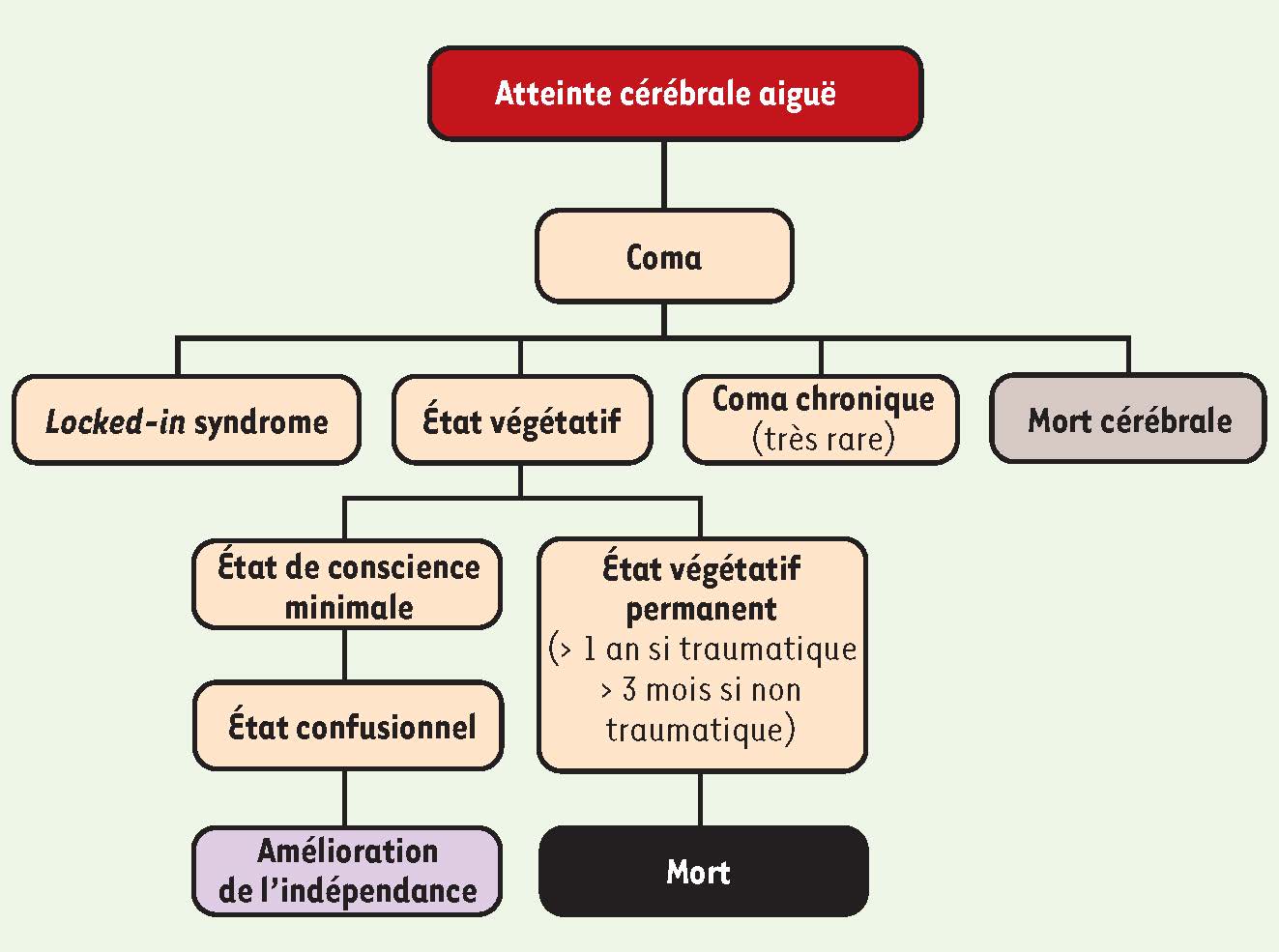
Figure 1
). Le coma est caractérisé par une absence totale d’éveil, même lors de stimulations intenses, et résulte d’une atteinte globale du cortex ou de la matière blanche, ou d’une lésion thalamique bilatérale avec préservation de la substance réticulée [
4]. Les patients EV sont éveillés mais ne présentent aucun signe comportemental de conscience de soi ou de l’environnement [
5]. Chez ces patients, les manifestations des fonctions motrices, auditives et visuelles sont restreintes à des réponses réflexes, et les réponses émotionnelles ne sont pas adaptées au contexte. Ces patients peuvent être éveillés par une stimulation intense, ou présenter des périodes d’ouverture spontanée des yeux [4]. Si cet état persiste dans le temps, l’EV est dit persistant (> 1 mois) ou permanent (> 3 mois pour une étiologie non traumatique, > 1 an pour une étiologie traumatique) [4]. L’ECM, quant à lui, se caractérise par un éveil préservé et des signes de conscience clairs mais fluctuants. Les patients ECM sont incapables de communiquer, mais montrent des preuves reproductibles de conscience [
6]. En effet, l’ECM se définit par la présence d’au moins un des comportements suivants [
7] : des comportements volontaires contingents à des stimulus de l’environnement (par exemple, une poursuite visuelle ou une localisation de stimulations nociceptives), une réponse à la commande reproductible, des réponses verbales ou gestuelles non exactes de type oui/non (communication intentionnelle mais non fonctionnelle), ou des verbalisations intelligibles. Un patient peut rester en ECM de façon prolongée ou en émerger et retrouver un niveau de conscience plus élevé. L’émergence de l’ECM se manifeste par une capacité à communiquer de façon fonctionnelle et exacte et/ou à utiliser des objets de façon fonctionnelle [7]. Enfin, les patients qui sortent du coma peuvent également être totalement éveillés et conscients mais incapables de communiquer verbalement ou gestuellement. Plum et Posner [
8] ont introduit le terme locked-in syndrome (LIS) afin de décrire ces patients prisonniers de leur corps. Cliniquement, le patient LIS ouvre les yeux de façon spontanée et continue (excepté en cas de ptosis bilatéral1), démontre des fonctions supérieures relativement préservées [
9], une atteinte sévère de la parole (aphonie ou hypophonie), une quadriplégie ou quadriparésie et un mode de communication principalement basé sur les mouvements oculo-palpébraux [6].  | Figure 1
Étapes d’évolution du coma. Le coma est généralement suivi de l’état végétatif, lequel est typiquement suivi de l’état de conscience minimale. Si l’état végétatif perdure après trois mois dans le cas d’une atteinte cérébrale non traumatique ou après un an dans le cas d’une lésion traumatique, l’expression « état végétatif permanent » est utilisée. |
La conscience se manifeste généralement par différents comportements tels qu’une poursuite visuelle, une réponse à des ordres simples, une reconnaissance d’objets [7]. Cependant, les comportements observés varient fortement d’un patient à l’autre et peuvent être très discrets. Dès lors, la détection clinique de signes comportementaux de conscience est difficile [
10,
11] et ce pour plusieurs raisons : la présence de déficits moteurs et/ou langagiers, la fluctuation du niveau de vigilance des patients [
12], le manque d’expertise des cliniciens, le manque de consensus dans la littérature ou encore l’utilisation de critères ou d’échelles diagnostiques d’une sensibilité insuffisante [10, 11,
13]. Une étude récente révèle que le diagnostic d’EV est erroné dans 40 % des cas [10], ce qui peut avoir de graves conséquences sur les décisions thérapeutiques ou de fin de vie. Ainsi, bien que l’évaluation comportementale soit nécessaire et utile, son utilisation doit être combinée à d’autres méthodes. Il est aujourd’hui possible de recourir à des techniques de neuro-imagerie afin d’établir un diagnostic plus fidèle et fiable. Nous proposons ici une revue des différents critères de recherche en neuro-imagerie qui ont été développés dans le but d’améliorer le diagnostic des patients ayant un état de conscience altérée. |
Métabolisme cérébral global et régional Une des premières pistes pour distinguer les patients inconscients (EV ou coma) des patients conscients est la mesure du métabolisme cérébral. Des études par tomographie par émission de positons (TEP) ont pu mettre en évidence une atteinte massive (valeurs inférieures de 40 % à 50 % aux valeurs normales) du métabolisme cérébral global des patients EV d’étiologies diverses [
14-
16]. Néanmoins, le niveau de conscience serait davantage lié au métabolisme de régions spécifiques qu’au métabolisme cérébral global [
17]. En effet, une récupération de l’EV ne s’accompagne pas nécessairement d’une augmentation du métabolisme cérébral global [
18]. Par ailleurs, une des différences entre les patients EV et ECM est le déficit structurel, plus important chez les premiers, des régions associatives du circuit fronto-pariétal, incluant les régions frontales latérales et médianes bilatérales, les aires pariéto-temporales et pariétales bilatérales, le cortex cingulaire postérieur et le précunéus [
19]. Plus spécifiquement, l’activité du cortex cingulaire postérieur et du précunéus permet de discriminer les patients ECM des patients EV [
20]. Des études TEP ont montré que les patients EV présentaient un syndrome de déconnexion entre les différentes régions du circuit fronto-pariétal et entre ces régions et les thalamus [
15,
21] (
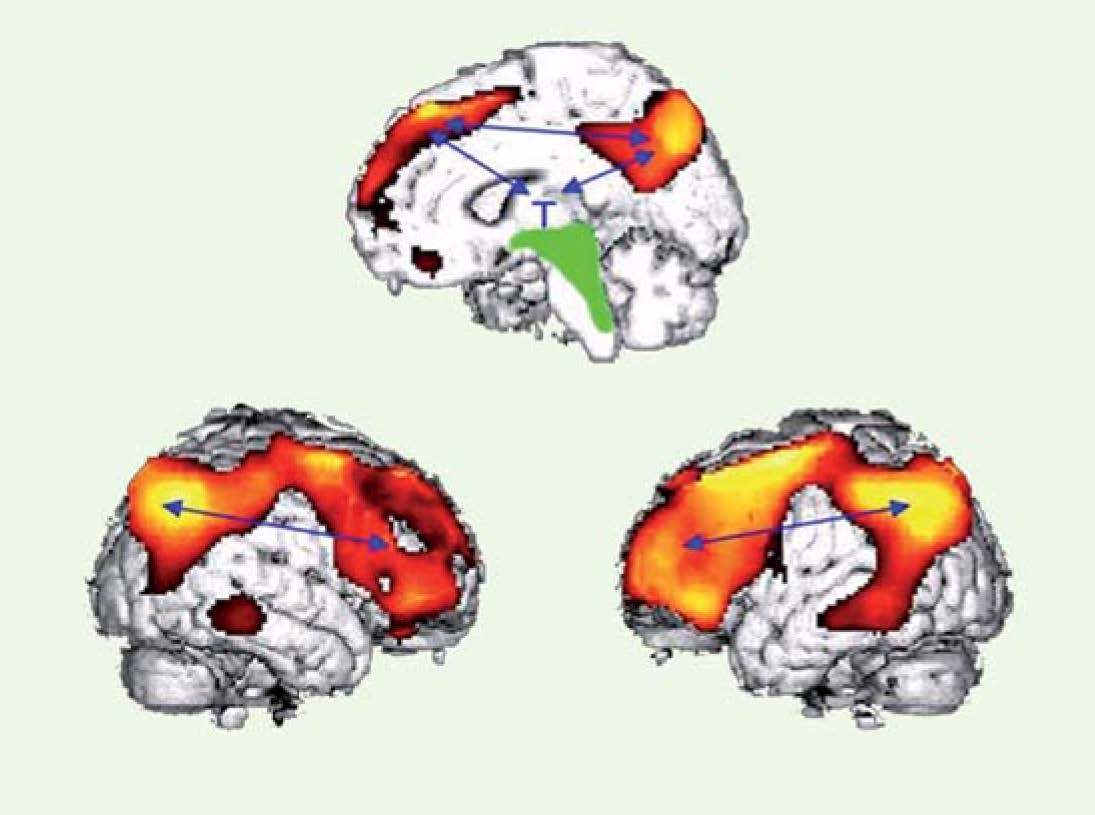
Figure 2
). 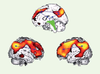 | Figure 2
Dysfonctionnement métabolique. Le dysfonctionnement (dû à une atteinte corticale directe ou à une déconnexion cortico-corticale ou thalamo-corticale) du circuit fronto-pariétal concerne les aires médianes et préfrontales associatives multimodales chez les patients EV (flèches bleues). Les 3 images correspondent au dysfonctionnement cérébral systématique observé chez des patients en état végétatif (adapté de [ 1]). |
|
Paradigmes passifs et stimulations sensorielles Des études TEP avec stimulations ont confirmé l’importance des structures associatives et des connexions cortico-corticales et thalamo-corticales dans la perception consciente des stimulus. Boly et al. [
22] ont montré que, chez les patients ECM, les aires primaires et associatives étaient activées lors de stimulations auditives, tandis que seules les aires primaires étaient activées chez les patients EV. En outre, chez les patients ECM, l’activité était plus étendue lorsque les stimulus présentés avaient une valeur émotionnelle (cris de bébé, prénom du patient) que lorsque la présentation de sons était sans signification [
23]. De façon similaire, lors de stimulations nociceptives, contrairement aux patients EV, les patients ECM présentaient une activation de l’ensemble du réseau dit de douleur, incluant le thalamus, le cortex somato-sensoriel primaire et les aires associatives, comme pour les sujets contrôles, suggérant ainsi que la perception de la douleur était préservée chez les patients ECM [
24] (→). L’ensemble de ces résultats traduit le fait que, chez les patients EV, le stimulus est détecté mais que l’information ne peut faire l’objet d’une intégration de plus haut niveau via les aires associatives (pour cause d’atteinte et de déconnexion de ces aires), contrairement aux patients ECM chez qui le traitement et l’intégration de l’information semblent être préservés.
(→) Voir l’article de Roland Peyron et Isabelle Faillenot, page 82 de ce numéro
|
L’imagerie par résonance magnétique fonctionnelle : un outil d’investigation d’un état de conscience et un nouvel outil de communication Dans la pratique clinique, l’évaluation au chevet du patient peut être biaisée par les troubles moteurs du patient. L’imagerie par résonance magnétique fonctionnelle (IRMf) offre de nouvelles possibilités pour détecter une réponse consciente et volontaire, sans intervention des fonctions motrices ou verbales. Boly et al. [
25] ont développé un paradigme dit actif dans lequel les activations cérébrales de volontaires sains lors de différentes tâches d’imagerie mentale étaient étudiées. Ces résultats ont démontré que des tâches simples telles que s’imaginer jouer au tennis et s’imaginer visiter sa maison provoquaient exactement le même type d’activité cérébrale chez tous les sujets sains (aire motrice supplémentaire versus régions pariétales et para-hippocampiques, respectivement). Owen et al. [
26] ont ensuite proposé ces deux mêmes tâches à une patiente initialement diagnostiquée comme étant en état végétatif. Ils ont pu observer que l’activité cérébrale chez cette patiente était similaire à celle qui est observée chez les volontaires sains [25]. Ils en ont donc conclu que la patiente était capable de comprendre, retenir et réaliser une consigne et que dès lors sa conscience ne pouvait plus être exclue. Plus récemment, cet outil d’imagerie mentale a été appliqué à une plus grande population de patients [
27]. Sur 54 patients étudiés, 5 (2 EV, 3 ECM) sont parvenus à réaliser correctement ces tâches motrices. De plus, un de ces patients a pu communiquer en modulant son activité cérébrale pour répondre oui (imaginer jouer au tennis) ou non (imaginer visiter votre maison) à des questions simples. Soulignons que ces études ne signifient pas que tous les patients EV sont capables de réaliser de telles tâches et qu’ils sont donc conscients. En effet, prenons l’exemple de la patiente de l’étude d’Owen et al. [26] : quelques mois après l’expérimentation, cette patiente est sortie de son EV et a montré des signes comportementaux d’ECM. Ces études illustrent le pouvoir pronostique potentiel de ces paradigmes actifs en IRMf. Toujours grâce à l’IRMf, Sorger et al. [
28] ont mis au point un autre exemple de communication à choix multiples : deux tâches d’imagerie mentale (imagerie motrice et calcul mental) sont utilisées comme réponses aux questions posées aux participants. Chacune des quatre réponses correspond à une tâche d’imagerie mentale et à une fenêtre de temps spécifique. Tout comme dans le paradigme proposé par Monti et al. [27], le sujet réalise la tâche d’imagerie mentale qui correspond à la réponse de son choix (
Figure 3
). Ainsi, l’IRMf constitue un outil d’investigation utile à l’établissement d’un diagnostic de conscience, mais permettrait également à des patients souffrant de déficits graves de communiquer via un canal autre que moteur ou langagier.  | Figure 3
Paradigme de B. Sorger et al. Le sujet doit répondre à la question posée en effectuant la tâche qui y correspond et au moment qui y correspond (les cases A, B, C, D s’illuminent l’une après l’autre) (adapté de [ 28]). |
|
Mesurer l’activité cérébrale spontanée Un autre critère prometteur tendant à distinguer les divers états de conscience altérée consiste à mesurer l’activation cérébrale spontanée au repos. En effet, des études en IRMf ont pu mettre en évidence que certaines régions du cerveau étaient activées au repos et désactivées lors de tâches cognitives attentionnelles [
29,
30]. Ces régions comprennent le cortex cingulaire postérieur et le précunéus, le cortex mésiofrontal et les jonctions temporo-pariétales et sont communément appelées réseau du mode par défaut [
31]. L’intérêt clinique de ce paramètre est qu’il ne requiert aucune participation active du patient. La fonction du réseau du mode par défaut n’est pas encore clairement définie, mais celui-ci pourrait sous-tendre les fonctions de base liées à la conscience. Dans une étude en IRMf, Boly et al. [
32] ont montré que le réseau du mode par défaut était toujours présent chez un patient EV mais absent chez un patient en état de mort cérébrale. S’ensuivit une étude sur une plus grande population de patients post-coma qui démontra que si ce réseau était toujours présent chez des patients inconscients (coma, EV), la connectivité au sein de ce réseau était linéairement corrélée au degré de conscience des patients en coma, EV, ECM et LIS [
33] (
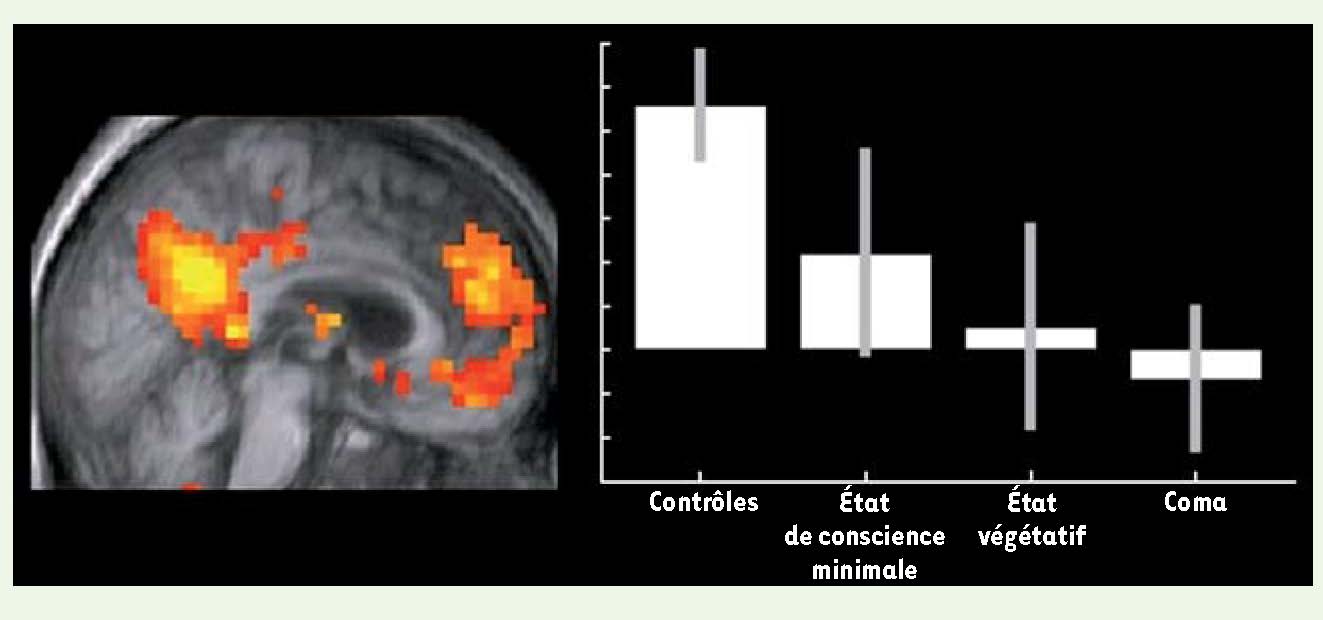
Figure 4
). En outre, la connectivité du précunéus, nœud central du réseau du mode par défaut [
34,
35], permettrait de distinguer les patients inconscients (coma, EV) des patients ECM. 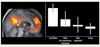 | Figure 4
Connectivité au sein du réseau du mode par défaut. À gauche, réseau du mode par défaut chez des sujets contrôles, comprenant le cortex cingulaire postérieur/précunéus, le cortex préfrontal et les jonctions temporo-pariétales. À droite, exemple de corrélation linéaire entre le degré de conscience et l’activité d’une région du réseau du mode par défaut, le cortex préfrontal médian (adapté de [ 33]). |
|
La détection de signes de conscience non ambigus au chevet des patients ayant un état de conscience altérée reste délicate car elle dépend des difficultés motrices ou verbales des patients, mais également des critères diagnostiques utilisés, des échelles ou de l’expertise du clinicien [10-12]. Le nombre de patients diagnostiqués par erreur comme étant inconscients est particulièrement important (40 %) [10]. Il est donc nécessaire d’utiliser en parallèle des techniques paracliniques objectives et de développer des modèles permettant un diagnostic plus fiable tels que la neuro-imagerie (IRMf et TEP-scan). Bien que ces techniques tendent à faire partie de la routine clinique, ce n’est pas encore le cas. La validation, ainsi que la systématisation de certaines de ces approches pourraient offrir aux cliniciens des outils objectifs aidant à l’amélioration de la prise en charge des patients ayant une lésion cérébrale sévère. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Cette recherche a été financée par les Fonds de la recherche scientifique (FRS-FNRS), le Centre hospitalier universitaire Sart-Tilman de Liège, la Commission européenne (DISCOS, Mindbridge et CATIA), l’Action de recherche concertée de la Communauté française de Belgique (ARC-06/11-340), la McDonnell Foundation et la Mind Science Foundation.
|
Footnotes |
1.
Laureys
S
. The neural correlate of (un)awareness: lessons from the vegetative state . Trends Cogn Sci.
2005; ; 9 : :556.-559. 2.
Bernat
JL
. Chronic consciousness disorders . Annu Rev Med.
2009; ; 60 : :381.-392. 3.
Demertzi, A,
Laureys
S
,
Boly
M
. Coma, persistent vegetative states, and diminished consciousness . In :
Banks
WP
, ed.
Encyclopedia of consciousness . Oxford: : Elsevier; , 2009 : :147.-156. 4.
Medical aspects of the persistent vegetative state (1). The multi-society task force on PVS . N Engl J Med.
1994; ; 330 : :1499.-1508. 5.
Jennett
B
,
Plum
F
. Persistent vegetative state after brain damage. A syndrome in search of a name . Lancet.
1972; ; 1 : :734.-737. 6.
American congress of rehabilitation medicine . Recommendations for use of uniform nomenclature pertinent to patients with severe alterations in consciousness . Arch Phys Med Rehabil.
1995; ; 76 : :205.-209. 7.
Giacino
JT
,
Ashwal
S
,
Childs
N
, et al. The minimally conscious state: definition and diagnostic criteria . Neurology.
2002; ; 58 : :349.-353. 8.
Plum
F
,
Posner
JB
. The diagnosis of stupor and coma . Philadelphie: : Davis FA; , 1966. 9.
Schnakers
C
,
Majerus
S
,
Goldman
S
, et al. Cognitive function in the locked-in syndrome . J Neurol.
2008; ; 255 : :323.-330. 10.
Schnakers
C
,
Vanhaudenhuyse
A
,
Giacino
J
, et al. Diagnostic accuracy of the vegetative and minimally conscious state: clinical consensus versus standardized neurobehavioral assessment . BMC Neurol.
2009; ; 9 : :35.. 11.
Bruno
MA
,
Schnakers
C
,
Damas
F
, et al. Locked-in syndrome in children: report of five cases and review of the literature . Pediatr Neurol.
2009; ; 41 : :237.-246. 12.
Gill-Thwaites
H
. Lotteries, loopholes and luck: misdiagnosis in the vegetative state patient . Brain Inj.
2006; ; 20 : :1321.-1328. 13.
Vanhaudenhuyse
A
,
Schnakers
C
,
Bredart
S
,
Laureys
S
. Assessment of visual pursuit in post-comatose states: use a mirror . J Neurol Neurosurg Psychiatry.
2008; ; 79 : :223.. 14.
DeVolder
AG
,
Goffinet
AM
,
Bol
A
, et al. Brain glucose metabolism in postanoxic syndrome. Positron emission tomographic study . Arch Neurol.
1990; ; 47 : :197.-204. 15.
Laureys
S
,
Goldman
S
,
Phillips
C
, et al. Impaired effective cortical connectivity in vegetative state: preliminary investigation using PET . Neuroimage.
1999; ; 9 : :377.-382. 16.
Levy
DE
,
Sidtis
JJ
,
Rottenberg
DA
, et al. Differences in cerebral blood flow and glucose utilization in vegetative versus locked-in patients . Ann Neurol.
1987; ; 22 : :673.-682. 17.
Laureys
S
,
Faymonville
ME
,
Moonen
G
, et al. PET scanning and neuronal loss in acute vegetative state . Lancet.
2000; ; 355 : :1825.-1827. 18.
Laureys
S
,
Lemaire
C
,
Maquet
P
, et al. Cerebral metabolism during vegetative state, after recovery to consciousness . J Neurol Neurosurg Psychiatry.
1999; ; 67 : :121.. 19.
Laureys
S
,
Boly
M
,
Moonen
G
,
Maquet
P
. Coma. In:
Squire
L
, ed.
Encyclopedia of neuroscience . Amsterdam, NY: : Elsevier; , 2000 : :1133.-1142. 20.
Laureys
S
,
Owen
AM
,
Schiff
ND
. Brain function in coma, vegetative state, and related disorders . Lancet Neurol.
2004; ; 3 : :537.-546. 21.
Laureys
S
,
Faymonville
ME
,
Luxen
A
, et al. Restoration of thalamocortical connectivity after recovery from persistent vegetative state . Lancet.
2000; ; 355 : :1790.-1791. 22.
Boly
M
,
Faymonville
ME
,
Peigneux
P
, et al. Auditory processing in severely brain injured patients: differences between the minimally conscious state and the persistent vegetative state . Arch Neurol.
2004; ; 61 : :233.-238. 23.
Laureys
S
,
Perrin
F
,
Faymonville
ME
, et al. Cerebral processing in the minimally conscious state . Neurology.
2004; ; 63 : :916.-918. 24.
Boly
M
,
Faymonville
ME
,
Schnakers
C
, et al. Perception of pain in the minimally conscious state with PET activation: an observational study . Lancet Neurol.
2008; ; 7 : :1013.-1020. 25.
Boly
M
,
Coleman
MR
,
Davis
MH
, et al. When thoughts become action: an fMRI paradigm to study volitional brain activity in non-communicative brain injured patients . Neuroimage.
2007; ; 36 : :979.-992. 26.
Owen
AM
,
Coleman
MR
,
Boly
M
, et al. Detecting awareness in the vegetative state . Science.
2006; ; 313 : :1402.. 27.
Monti
M
,
Vanhaudenhuyse
A
,
Coleman
M
, et al. Willful modulation of brain activity in disorders of consciousness . N Engl J Med.
2010; ; 362 : :579.-589. 28.
Sorger
B
,
Dahmen
B
,
Reithler
J
, et al. Another kind of BOLD response: answering multiple-choice questions via online decoded single-trial brain signals . Prog Brain Res.
2009; ; 177 : :275.-292. 29.
Mazoyer
B
,
Zago
L
,
Mellet
E
, et al. Cortical networks for working memory and executive functions sustain the conscious resting state in man . Brain Res Bull.
2001; ; 54 : :287.-298. 30.
Raichle
ME
,
MacLeod
AM
,
Snyder
AZ
, et al. A default mode of brain function . Proc Natl Acad Sci USA.
2001; ; 98 : :676.-682. 31.
Raichle
ME
. Cognitive neuroscience. Bold insights . Nature.
2001; ; 412 : :128.-130. 32.
Boly
M
,
Tshibanda
L
,
Vanhaudenhuyse
A
, et al. Functional connectivity in the default network during resting state is preserved in a vegetative but not in a brain dead patient . Hum Brain Map.
2009; ; 30 : :2393.-2400. 33.
Vanhaudenhuyse
A
,
Noirhomme
Q
,
Tshibanda
LJ
, et al. Default network connectivity reflects the level of consciousness in non-communicative brain-damaged patients . Brain.
2010; ; 133 : :161.-171. 34.
Fransson
P
,
Marrelec
G
. The precuneus/posterior cingulate cortex plays a pivotal role in the default mode network: Evidence from a partial correlation network analysis . Neuroimage.
2008; ; 42 : :1178.-1184. 35.
Hagmann
P
,
Cammoun
L
,
Gigandet
X
, et al. Mapping the structural core of human cerebral cortex . PLoS Biol.
2008; ; 6 : :e159.. |