| |
| Med Sci (Paris). 2011 January; 27(1): 9–11. Published online 2011 February 10. doi: 10.1051/medsci/20112719.Le « bon cholestérol » et ses récepteurs ABCA1 et ABCG1 régulent l’immunité innée et la prolifération des cellules souches hématopoïétiques Emmanuel L. Gautier1 and Laurent Yvan-Charvet2* 1Department of gene and cell medicine, Mount Sinai School of Medicine, New York, NY 10029, États-Unis 2Division of molecular medicine, Department of medicine, Columbia University, 630 West 168th Street, New York, NY 10032, États-Unis MeSH keywords: Transporteur-1 à cassette liant l'ATP, Membre-1 de la sous-famille G des transporteurs à cassette liant l'ATP, Transporteurs ABC, physiologie, Apolipoprotéine A-I, métabolisme, Athérosclérose, anatomopathologie, Division cellulaire, Lignage cellulaire, Cytokines, Cellules spumeuses, Cellules souches hématopoïétiques, cytologie, Humains, Immunité innée, Lipoprotéines HDL, Monocytes |
L’athérosclérose est la cause majeure des maladies cardiovasculaires et est à l’origine d’environ 50 % des décès dans les pays industrialisés. De nombreuses études épidémiologiques ont révélé une corrélation positive entre le taux plasmatique de lipoprotéines de haute densité (HDL, communément appelées « bon cholestérol ») et la diminution du risque cardiovasculaire. Le rôle protecteur des HDL est attribué à leur capacité à favoriser l’efflux du cholestérol des tissus périphériques vers le foie, et donc son excrétion via la voie dite de transport inverse du cholestérol. Le rôle athéroprotecteur des HDL et de ses transporteurs de type ABC (ATP binding cassette), ABCA1 et ABCG1, a également été mis en évidence dans des modèles murins de la maladie. Nous avons précédemment discuté dans médecine/sciences le rôle des transporteurs ABCA1 et ABCG1 dans l’efflux de cholestérol induit par les HDL [
1]. Aujourd’hui, nous discutons nos résultats récents qui révèlent de nouveaux mécanismes athéroprotecteurs des HDL et de ses transporteurs ABCA1 et ABCG1. |
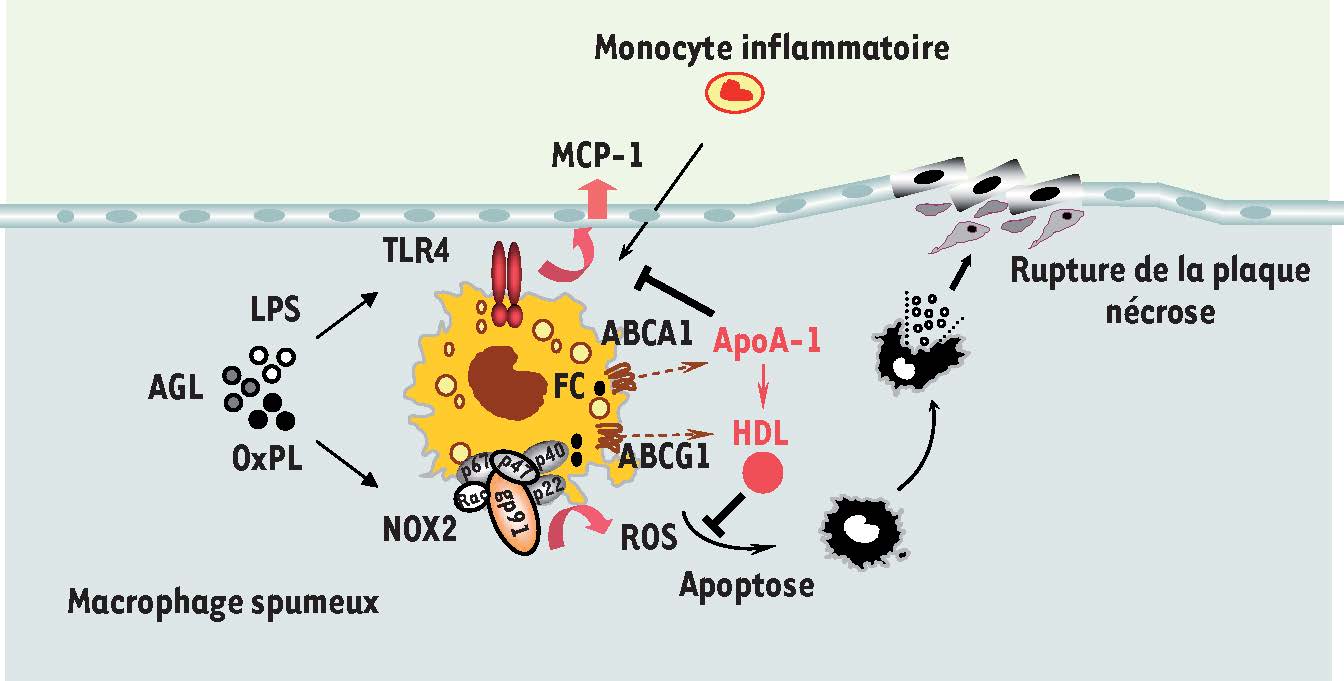
ABCA1, ABCG 1 et HDL régulent l’immunité innée dans le macrophage L’athérosclérose est caractérisée par la formation d’une plaque d’athérome en réponse au dépôt de lipides, en particulier de cholestérol, dans la paroi artérielle. La modification enzymatique et biochimique de ces lipides induit une réaction inflammatoire qui favorise le développement d’une plaque d’athérome composée essentiellement de macrophages inflammatoires gorgés de lipides [
2]. La mort de ces macrophages, que provoque la mauvaise élimination de ces lipides, conduit à la formation de débris cellulaires et entretient l’inflammation au sein de la plaque, favorisant ainsi sa progression [
3,
4]. La présence des macrophages dans la plaque athéromateuse est consécutive au recrutement de monocytes circulants [
5] et la persistance de ces macrophages dans la plaque pourrait être favorisée dans un contexte d’hyperlipémie [
6] (
Figure 1
). Les HDL, en favorisant l’efflux du cholestérol des macrophages spumeux via ses transporteurs ABCA1 et ABCG1, diminuent le statut inflammatoire des macrophages et augmentent leur survie [
7,
8]. D’un point de vue mécanistique, nos travaux montrent que les HDL, en réduisant la quantité de cholestérol de la membrane plasmique, limitent l’activation des récepteurs de type Toll (TLR), en particulier le récepteur TLR4 présent dans les radeaux lipidiques (microdomaines), et réduisent l’assemblage membranaire de l’enzyme pro-oxidante NADPH oxydase NOX2 [7, 8]. Ces régulations permettraient aux HDL d’une part de limiter l’inflammation induite par les ligands naturels de TLR4 comme les lipopolysaccharides des parois bactériennes et éventuellement certaines espèces de lipides (par exemple les acides gras libres), d’autre part de diminuer la production de dérivés réactifs de l’oxygène - qui ont un rôle pro-apoptotique - en réponse à des lipides oxydés [7, 8] (
Figure 1
). Il est maintenant admis que la présence de macrophages spumeux dans la plaque d’athérome n’explique qu’en partie de la réponse immunitaire associée à la formation de la plaque athéromateuse [2]. Alors que le rôle des HDL sur la réponse immunitaire innée (dont les macrophages sont des effecteurs) commence à être bien établi, leur rôle dans la réponse immunitaire spécifique (qui met en jeu les lymphocytes) reste à ce jour peu connu et pourrait s’ajouter aux propriétés anti-athérogènes des HDL.  | Figure 1
HDL et immunité innée des macrophages. L’apolipoprotéine A-1 (apoA-1) interagit avec le transporteur ABCA1 présent à la membrane des macrophages dans la plaque d’athérome et induit l’efflux de cholestérol, entraînant ainsi la formation des HDL qui deviendront alors les accepteurs de l’efflux de cholestérol induit par ABCG1. En épurant le cholestérol contenu dans les macrophages spumeux de la plaque par l’intermédiaire de ses transporteurs, les HDL réduiraient l’inflammation induite par les récepteurs de type Toll en particulier TLR4 ainsi que la génération de dérivés réactifs de l’oxygène produits par l’enzyme NADPH oxydase NOX2. Ainsi, les HDL protégeraient de l’inflammation induite par le lipopolysaccharide (LPS) et potentiellement certaines espèces de lipides (AGL, acides gras libres), ainsi que de l’apoptose induite des lipides oxydés (OxPL) présents dans la plaque athéromateuse. |
|
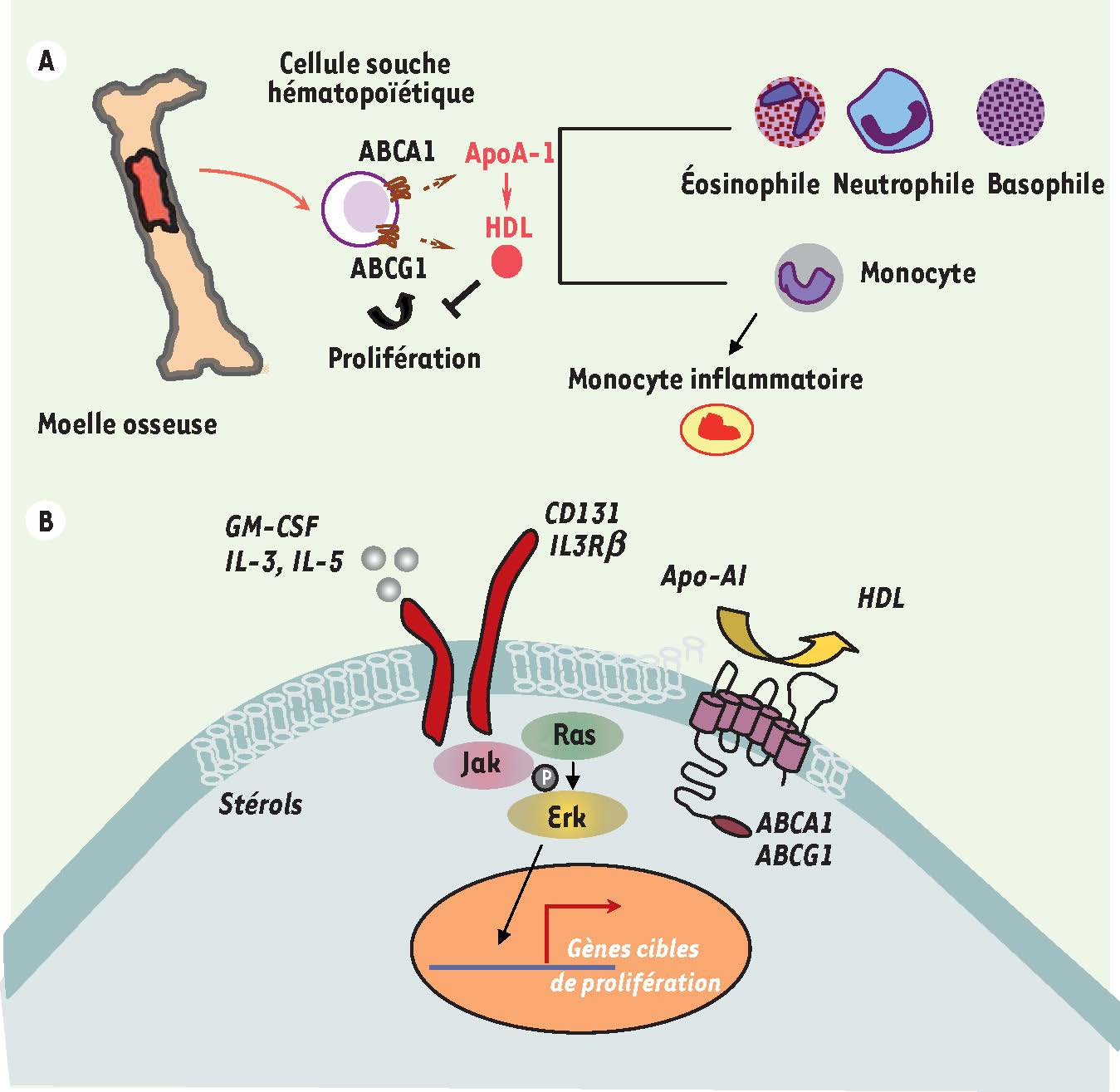
ABCA1, ABCG1 et HDL interviennent dans le contrôle de la prolifération des cellules souches hématopoïétiques de la moelle osseuse L’athérosclérose est étroitement associée à des événements inflammatoires, et les monocytes circulants jouent un rôle essentiel dans la naissance puis la progression de la plaque d’athérome [5]. Notamment, de récents travaux suggèrent une forte association entre les maladies cardiovasculaires et des nombres élevés de leucocytes (hyperleucocytose) et de monocytes (monocytose) [
9]. Cependant les mécanismes à l’origine de ces hyperleucocytoses et monocytoses sont peu connus. C’est dans ce contexte que nous avons récemment mis en évidence que des modulations du niveau de HDL affecteraient la prolifération des cellules souches hématopoïétiques présentes dans la moelle osseuse et qui donnent naissance aux leucocytes et monocytes (
Figure 2A
) [
10]. Ces effets sont indépendants du rôle des HDL dans le contrôle du statut inflammatoire des macrophages (voir ci-dessus). En effet, les HDL et leurs transporteurs ABCA1 et ABCG1 agissent directement au niveau des membranes des monocytes et des cellules souches hématopoïétiques en réduisant leur contenu en cholestérol, entraînant ainsi une diminution de leur pouvoir de prolifération. Nous avons identifié que l’un des signaux majeurs régulé par les HDL serait la sous-unité β du récepteur commun aux cytokines GM-CSF (granulocyte macrophage colony-stimulating factor), IL(interleukine)-3 et IL-5 (
Figure 2B
). Ainsi, les HDL, en réduisant le contenu en cholestérol des membranes plasmatiques des cellules souches hématopoïétiques, permettraient de réduire l’expression membranaire de cette sous-unité β et de limiter la sensibilité des cellules souches aux facteurs de croissance nécessaires à leur prolifération [10]. De tels mécanismes pourraient également intervenir au sein même de la plaque athéromateuse puisqu’il a été montré que le GM-CSF régule la prolifération des monocytes recrutés au sein de la plaque dans un contexte d’hyperlipémie [
11].  | Figure 2
HDL et prolifération des cellules souches hématopoïétiques. A. L’expression des transporteurs ABCA1 ou ABCG1 par les cellules souches hématopoïétiques de la moelle osseuse, précurseurs des cellules hématopoïétiques et en particulier des monocytes, limiterait leur prolifération. Ainsi, une diminution du nombre de monocytes circulants pourrait contribuer aux propriétés anti-athérogènes des HDL. B. L’efflux de cholestérol induit par l’interaction de l’apolipoprotéine A-1 (apoA-1) avec son transporteur ABCA1 et celle des HDL avec ABCG1 permet de modifier le contenu des membranes plasmiques en cholestérol entraînant leur fluidification. Ainsi, la réponse cellulaire associée à la sous-unité β du récepteur commun aux cytokines GM-CSF, IL-3 et IL-5 (IL3Rβ ou CD131) serait diminuée, limitant la sensibilité de ces cellules aux facteurs de croissance permettant leur prolifération. |
|
Le développement d’inhibiteurs CETP (cholesterol ester transfer protein), actuellement en cours d’essai clinique de phase III [11] dont l’objectif est d’augmenter les niveaux plasmatiques de HDL (bon cholestérol), pourrait révolutionner le traitement de l’athérosclérose, parallèlement à l’effet des statines qui, elles, diminuent le « mauvais cholestérol » (lipoprotéine de basse densité, LDL). Il est possible d’envisager qu’une telle classe de molécules ciblant les HDL puisse avoir des effets bénéfiques non seulement en termes de protection de la plaque athéromateuse mais également en termes d’immunité et de préservation des cellules souches. On peut également se demander si d’autres désordres à caractère immunitaire et/ou hyperprolifératif (septicémie, syndrome myéloprolifératif, cancer, etc.) ne pourraient pas bénéficier du rôle protecteur des HDL. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1.
Masson
D
,
Yvan-Charvet
L.
. L’augmentation du HDL-cholestérol : un traitement d’avenir dans le domaine de l’athérosclérose ? . Med Sci (Paris).
2008; ; 24 : :341.-343. 2.
Varthaman
A
,
Khallou-LAschet
J
,
Taunat
O
, et al. L’athérogenèse : une maladie dysimmunitaire . Med Sci (Paris).
2008; ; 24 : :169.-175. 3.
Ross
R.
. Atherosclerosis an inflammatory disease . N Engl J Med.
1999; ; 340 : :115.-126. 4.
Mallat
Z
,
Tedgui
A.
. Apoptose et syndromes coronariens aigus . Med Sci (Paris).
2004; ; 20 : :298.-303. 5.
Gautier
EL
,
Jakubzick
C
,
Randolph
GJ.
. Regulation of the migration and survival of monocyte subsets by chemokine receptors and its relevance to atherosclerosis . Arterioscler Thromb Vasc Biol.
2009; ; 29 : :1412.-1418. 6.
Tabas
I
,
Williams
KJ
,
Boren
J.
. Subendothelial lipoprotein retention as the initiating process in atherosclerosis : update and therapeutic implications . Circulation.
2007; ; 116 : :1832.-1844. 7.
Yvan-Charvet
L
,
Wang
N
,
Tall
AR.
. Role of HDL, ABCA1 and ABCG1 transporters in cholesterol efflux and immune responses . Arterioscler Thromb Vasc Biol.
2010; ; 30 : :139.-143. 8.
Yvan-Charvet
L
,
Pagler
TA
,
Seimon
TA
, et al. ABCA1 and ABCG1 protect against oxidative stress-induced macrophage apoptosis during efferocytosis . Circ Res.
2010; ; 106 : :1861.-1869. 9.
Coller
BS.
. Leukocytosis and ischemic vascular disease morbidity and mortality: is it time to intervene? . Arterioscler Thromb Vasc Biol.
2009; ; 25 : :1412.-1418. 10.
Yvan-Charvet
L
,
Pagler
TP
,
Gautier
EL
, et al. ATP-binding cassette transporters and HDL suppress hematopoietic stem cell proliferation . Science.
2010; ; 328 : :1689.-1693. 11.
Zhu
SN
,
Chen
M
,
Jongstra-Bilen
, et al. GM-CSF regulates intimal cell proliferation in nascent atherosclerotic lesions . J Exp Med.
2009; ; 206 : :2141.-2149. |