| |
| Med Sci (Paris). 2010 December; 26(12): 1040–1042. Published online 2010 December 15. doi: 10.1051/medsci/201026121040.Une forme « ariditaire » du cancer de l’ovaire David J. Birnbaum,* Renaud Sabatier, Émilie Mamessier, Daniel Birnbaum, and François Bertucci Centre de recherche en cancérologie de Marseille, UMR891 Inserm, Institut Paoli-Calmettes, 27, boulevard Leï Roure, 13009 Marseille, France Département d’oncologie moléculaire, Institut Paoli-Calmettes, 232, boulevard Sainte-Marguerite, 13273 Marseille, Cedex 09, France MeSH keywords: Adénocarcinome à cellules claires, génétique, anatomopathologie, Allèles, Carcinome endométrioïde, Lignée cellulaire tumorale, Transformation cellulaire néoplasique, Codon stop, Analyse de mutations d'ADN, Femelle, Régulation de l'expression des gènes tumoraux, Humains, Mutation, Protéines tumorales, physiologie, Syndromes néoplasiques héréditaires, Protéines nucléaires, Tumeurs de l'ovaire, États précancéreux, ARN tumoral, Récepteurs aux glucocorticoïdes, Facteurs de transcription |
Les cancers épithéliaux de l’ovaire sont hétérogènes sur les plans histocliniques et moléculaires. Malgré les progrès thérapeutiques récents et une prise en charge pluridisciplinaire, la survie à 5 ans reste inférieure à 40 % [
1]. Le cystadénocarcinome séreux (CAS) est la forme histologique la plus fréquente (70 %). Le carcinome à cellules claires (CCC) représente 10 à 12 % des cas et correspond à l’une des formes les plus agressives en raison de sa faible chimiosensibilité [
2,
3]. Peu étudié au niveau moléculaire, il présente moins d’instabilité chromosomique que le CAS de haut grade. Le carcinome endométroïde (CE), retrouvé dans environ 15 % des cas, a un pronostic plus favorable que les précédents. Les CCC et CE se développent souvent sur une lésion bénigne, l’endométriose, dont les mécanismes moléculaires de transformation sont peu connus [
4]. |
Mutations du gène ARID1A associées à des cancers de l’ovaire Jusqu’à présent, les altérations les plus fréquemment rapportées dans le CCC concernaient des mutations de gènes impliqués dans l’oncogenèse en général (CTNNB1 qui code la β-caténine, KRAS, PIK3CA [phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit α] et TP53) et l’amplification de la région chromosomique 20q13.2 [
5,
6]. Deux études récentes basées sur le séquençage du génome tumoral décrivent des mutations somatiques du gène ARID1A (AT-rich interactive domaincontaining protein 1A), qui jouerait ainsi un rôle de gène suppresseur de tumeurs (GST) [
7,
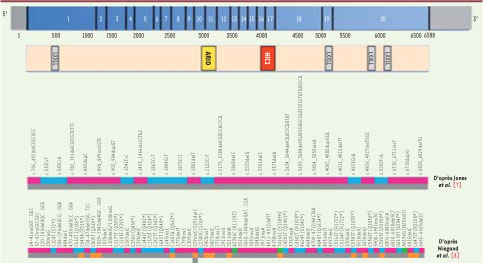
8]. Le gène ARID1A code BAF250a (BRG1-associated factor), un composant crucial du complexe SWI/SNF de remodelage de la chromatine. La première équipe [7] a étudié l’ensemble des séquences codantes de huit CCC de l’ovaire, et trouvé 268 mutations somatiques réparties sur 253 gènes, dont 4 étaient mutés dans plus d’une tumeur : deux oncogènes (KRAS, PIK3CA), un oncogène potentiel (PPP2R1A, serine/ threonine-protein phosphatase 2A 65 kDa regulatory subunit Aα), et le gène ARID1A. Ces mutations ont été confirmées par séquençage direct de 34 autres CCC et 7 lignées cellulaires. Au total, ARID1A était muté dans 57 % des tumeurs et 71 % des lignées. Parmi les 32 mutations différentes d’ARID1A réparties sur l’ensemble du gène (Figure 1), 9 créaient des codons stop et 23 étaient des insertions/délétions conduisant à une rupture du cadre de lecture et, a priori, à la synthèse d’une protéine tronquée. Dans 42 % des tumeurs porteuses de mutations, l’inactivation d’ARID1A était bi-allélique, soit par mutation sur les deux allèles, soit par mutation de l’un et perte de l’autre.  | Figure 1
Mutations du gène ARID1A détectées dans les carcinomes à cellules claires de l’ovaire et les carcinomes endométrioïdes. Schéma de la protéine BAF250a (sont indiquées les régions correspondantes aux 20 exons du gène ARID1A) avec ses différents domaines : un domaine ARID liant spécifiquement des séquences d’ADN riches en AT (en jaune), un domaine HIC1 (en orange) et des motifs LXXLL riches en leucine permettant l’interaction avec des récepteurs nucléaires (en gris). En bleu sont représentées les mutations non-sens, en rose les mutations de type frame-shift (insertion/délétion), et en vert les mutations faux-sens. En gris, les carcinomes à cellules claires et en orange les carcinomes endométrioïdes. |
La deuxième équipe [8] a séquencé l’ARN complet de 19 CCC (18 tumeurs et une lignée cellulaire constituant le jeu d’identification), et trouvé 6 mutations somatiques d’ARID1A. La fréquence des mutations a ensuite été définie par séquençage dans les 18 tumeurs précédentes et dans 210 cancers ovariens incluant 101 CCC, 33 CE et 76 CAS (jeu de validation) et une autre lignée de CCC. ARID1A était muté dans 46 % des CCC, 30 % des CE et dans la lignée, mais dans aucun des cas de CAS, suggérant une forte association de ces mutations avec les cancers associés à l’endométriose. La perte d’expression de la protéine correspondante, ARID1A/BAF250a, évaluée en immunohistochimie sur 182 tumeurs (jeux d’identification et de validation) était corrélée à la présence d’une mutation : elle caractérisait 73 % des CCC et 50 % des CE mutés, mais seulement 10 % des cas non mutés. Cette perte d’expression était associée aux cancers développés sur une endométriose préexistante, car elle était retrouvée dans 42 % des CCC et 21 % des CE, mais seulement 1 % des CAS. Cette corrélation a été confirmée sur une série de 455 cancers de l’ovaire incluant les 3 types histologiques. Pour deux CCC mutés, des échantillons d’endométriose juxta-tumorale et à distance de la tumeur étaient disponibles. Dans les deux cas, la mutation d’ARID1A et la perte d’expression de la protéine étaient présentes dans l’endométriose atypique juxta-tumorale, mais pas dans l’endométriose typique à distance, suggérant que la mutation est un événement précoce de l’oncogenèse. |
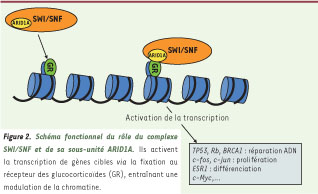
Une fonction encore à préciser Des délétions dans la région 1p35-36 qui porte le gène ARID1A ont été décrites dans divers cancers, suggérant la présence d’un ou plusieurs gènes suppresseurs de tumeurs. Aucune mutation d’ARID1A n’avait jusqu’alors été décrite en dehors de réarrangements chromosomiques l’impliquant dans le cancer du sein et des lignées cellulaires de cancer du poumon [
9]. La perte d’expression de BAF250a avait été observée dans les lignées de cancers du col de l’utérus et du sein. ARID1A code pour une sous-unité du complexe de remodelage de la chromatine SWI/SNF (Figure 2). Ce complexe, présent chez tous les eucaryotes, intervient dans le développement, la différenciation, la prolifération, la réparation d’ADN et joue un rôle suppresseur de tumeurs. L’activité hélicase et ATPase d’ARID1A/BAF250a permet la régulation de la transcription de certains gènes par altération de leur structure chromatinienne. La protéine possède des domaines conservés. Le premier lui permet de lier spécifiquement des séquences d’ADN riches en AT reconnues par le complexe SWI/SNF. Un deuxième, carboxy-terminal, permet l’activation transcriptionnelle de cibles du récepteur des glucocorticoïdes. La protéine confèrerait ainsi au complexe SWI/SNF une spécificité pour le recrutement des gènes cibles. ARID1A/BAF250a possède aussi une boîte BC et intervient dans un complexe ubiquitine ligase E3 [
10]. Ses fonctions dans l’oncogenèse restent à préciser.  | Figure 2
Schéma fonctionnel du rôle du complexe SWI/SNF et de sa sous-unité ARID1A.. Ils activent la transcription de gènes cibles via la fixation au récepteur des glucocorticoïdes (GR), entraînant une modulation de la chromatine. |
|
ARID1A et progression tumorale Les mutations et la perte d’expression de la protéine dans les lésions précancéreuses endométriosiques atypiques [8] suggèrent que l’inactivation d’ARID1A interviendrait précocement dans la transformation de l’épithélium ovarien. La nature des mutations observées et leur profil suggèrent qu’ARID1A fonctionne comme un gène suppresseur de tumeur dans le CCC. La forte proportion de mutations bi-alléliques indique une inactivation en deux temps selon le modèle de Knudson1. Pour faire un bon mot, on pourrait dire que ces formes sur endométriose sont des formes « ariditaires » de la maladie, bien distinctes des formes sans lésion précancéreuse identifiée. Deux types de cancer ovarien semblent se distinguer : le CAS de haut grade, avec instabilité génétique et mutations de TP53 et BRCA, et les carcinomes à cellules claires et endométrioïdes, sans instabilité génétique, mais avec mutation d’ARID1A et de la voie PI3 kinase. D’une manière plus générale, il est frappant de constater que de nombreux gènes récemment impliqués dans l’oncogenèse, comme ASXL1 (additional sex combs-like protein 1), EZH2 (enhancer of zeste homolog 2, qui code une histone-méthyltransférase), JARID1C (Jumonji/ARID domain-containing protein 1C), TET2 (ten-eleven-translocation, muté dans des hémopathies myéloïdes humaines [
11]) ou UTX (ubiquitously transcribed X chromosome tetratricopeptide repeat protein), sont des régulateurs épigénétiques [
12]. De nombreuses autres mutations vont certainement être trouvées parmi les membres de cette vaste famille. Une grande partie des dérégulations épigénétiques si fréquemment observées dans les cancers, voire peut-être toutes, seraient ainsi d’origine génétique. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Cannistra SA. Cancer of the ovary. N Engl J Med 2004 ; 351 : 2519-29. 2. Sugiyama T, Kamura T, Kigawa J, et al. Clinical characteristics of clear cell carcinoma of the ovary: a distinct histologic type with poor prognosis and résistance to platinium-based chemotherapy. Cancer 2000 ; 88 : 2584-9. 3. Crotzer DR, Sun CC, Coleman RL, et al. Lack of effective systemic therapy for recurrent clear cell carcinoma of the ovary. Gynecol Oncol 2007 ; 105 : 404-8. 4. Viganò P, Somigliana E, Chiodo I, et al. Molecular mechanisms and biological plausibility underlying the malignant transformation of endometriosis: a critical analysis. Hum Reprod Update 2006 ; 12 : 77-89. 5. Kuo KT, Mao TL, Chen X, et al. DNA copy numbers profiles in affinity-purified ovarian clear cell carcinoma. Clin Cancer Res 2010 ; 16 : 1997-2008. 6. Kuo KT, Mao TL, Jones S, et al. Frequent activating mutations of PIK3CA in ovarian clear cell carcinoma. Am J Pathol 2009 ; 174 : 1597-601. 7. Jones S, Wang TL, Shih I-M, et al. Fréquent mutations of chromatin remodeling gene ARID1A in ovarian clear cell carcinoma. Science 2010 ; 330 : 228-31. 8. Wiegand KC, Shah SP, Al-Agha OM, et al. ARID1A mutations in endometriosis-associated ovarian carcinomas. N Engl J Med 2010 ; 363 : 1532-43 9. Huang J, Zhao YL, Li Y, et al. Genomic and functional evidence for an ARID1A tumor suppressor role. Genes Chromosomes Cancer 2007 ; 46 : 745-50. 10. Li XS, Trojer P, Matsumura T, et al. Mammalian SWI/ SNF-a subunit BAF250/ARID1A is an E3 ubiquitin ligase that targets histone H2B. Mol Cell Biol 2010 ; 30 : 1673-88. 11. Bernard OA, Delhommeau F, Fontenay M, Vainchenker W. Mutations du gène TET2 dans les hémopathies myéloïdes humaines. Med Sci (Paris) 2009 ; 25 : 785-8. 12. Deltour S, Chopin V, Leprince D. Modifications épigénétiques et cancer. Med Sci (Paris) 2005 ; 21 : 405-11. |