| |
| Med Sci (Paris). 2010 December; 26(12): 1027–1030. Published online 2010 December 15. doi: 10.1051/medsci/201026121027.Fuseau mitotique et division asymétrique des cellules souches De l’importance de bien s’orienter Frédéric Hollande1* and Dominique Joubert1 1CNRS UMR5203/Inserm U661, Institut de génomique fonctionnelle, 141, rue de la Cardonille, 34094 Montpellier Cedex 05, France MeSH keywords: Adénocarcinome, génétique, anatomopathologie, Animaux, Caenorhabditis elegans, cytologie, Différenciation cellulaire, Division cellulaire, Lignage cellulaire, Tumeurs colorectales, Drosophila melanogaster, Cellules épithéliales, Gènes APC, Homéostasie, Humains, Muqueuse intestinale, Souris, Appareil du fuseau, physiologie, Cellules souches, Protéines de type Wingless |
Le fuseau mitotique, assemblage de microtubules formé à partir des centrosomes, participe à la séparation des chromatides durant la division cellulaire. L’orientation du fuseau mitotique est un des mécanismes permettant aux cellules souches de se diviser de façon asymétrique, en modifiant le positionnement d’une des cellules filles par rapport à l’environnement cellulaire, ou niche [
1]. Ce type de division asymétrique permet de générer des cellules différenciées tout en maintenant le nombre de cellules souches, assurant ainsi le renouvellement et l’homéostasie tissulaires. Le contrôle de la division asymétrique des cellules souches fait donc partie des événements primordiaux dont la perturbation participe à l’initiation et à la progression tumorales [
2], comme cela a été démontré chez la drosophile ou dans l’épiderme humain. Les résultats récents de l’équipe de Inke Näthke montrent maintenant que le contrôle de l’orientation du fuseau mitotique est également essentiel pour la division asymétrique des cellules souches intestinales [
3], siège des mutations initiatrices de la tumorigenèse colorectale [
4]. |
Contrôle de l’orientation du fuseau mitotique dans les cryptes intestinales : rôle du gène APC
Le côlon humain est constitué de plusieurs millions de cryptes, chacune contenant environ 2 000 cellules. L’épithélium intestinal est entièrement renouvelé tous les 2 à 7 jours chez la souris et l’homme, et environ 1010 nouvelles cellules sont ainsi produites tous les jours dans l’intestin. Deux types cellulaires présentent des caractéristiques de cellules souches intestinales chez la souris : les cellules portant le marqueur Lgr5 (crypt base columnar cells, ou CBC), et les cellules localisées en position +41 dans la crypte, qui expriment le marqueur Bmi1 et seraient quiescentes [
5]. Dans le travail de Quyn et al., l’orientation du fuseau mitotique a été examinée sur des cryptes intestinales entières grâce à la microscopie multiphoton et celle des cellules situées dans les positions 1 à 7 (incluant ainsi les cellules Lgr5+ et Bmi1+) a été comparée à celle des cellules en phase mitotique localisées plus haut dans la crypte, qui correspondent principalement aux cellules progénitrices. Alors que dans ces dernières, le fuseau mitotique est orienté de façon parallèle à la membrane basale, il est orienté perpendiculairement à la lumière dans les cellules souches. La même étude suggère également que ce mécanisme est corrélé à la ségrégation asymétrique des chromatides dont il a déjà été question dans Médecine/Sciences [
14] : le brin « parental » d’ADN resterait dans la cellule souche alors que le brin néosynthétisé serait systématiquement dirigé vers la cellule fille [3]. Une telle ségrégation, aussi identifiée récemment par Falconer et al. [
6], corrobore la théorie du brin immortel d’ADN émise par Cairns [
7]. Les auteurs montrent par ailleurs que cette orientation spécifique du fuseau dans les cellules souches est majoritairement perdue dans le tissu intestinal précancéreux des souris APCMin/+ et des patients atteints de polypose adénomateuse familale (PAF) qui portent des mutations hétérozygotes du gène codant pour l’adenomatous polyposis coli (APC). L’étude de Quyn et al. suggère donc que le contrôle de l’orientation préférentielle du fuseau mitotique participe au rôle répresseur de tumeur du produit du gène APC, dont les mutations sont impliquées dans l’initiation tumorale d’une majorité de cancers colorectaux. Au-delà du mécanisme de ségrégation asymétrique des chromatides, ce travail soulève également plusieurs questions complémentaires, notamment en ce qui concerne les mécanismes moléculaires impliqués, la relation entre division asymétrique et destin cellulaire et l’impact physiopathologique de la mutation du gène APC chez l’homme. Sur le plan mécanistique, l’identification du rôle d’APC sur l’orientation du fuseau mitotique et sur le contrôle de la division asymétrique n’est pas nouvelle à proprement parler. Une démonstration élégante en avait déjà été apportée par y. Yamashita dans les cellules germinales de Drosophila melanogaster [
8]. Plus récemment, la relation entre la voie Wnt et le contrôle de l’orientation du fuseau a également été mise en évidence chez C. elegans [
9]. Cependant, en démontrant l’existence d’un tel phénomène dans les cellules souches intestinales, siège de l’initiation tumorale [4], Quyn et al. identifient une arme supplémentaire dans l’arsenal déjà bien fourni des mécanismes participant au rôle oncogénique des mutations du gène APC dans l’intestin. En effet, l’impact de ces mutations est très important, car il affecte l’activité transcriptionnelle de β-caténine/Tcf-4, la stabilité chromosomique, la vitesse de division cellulaire [
10], l’adhésion cellulaire, et maintenant la division asymétrique. S’il est probable que, dans la plupart des cas, les cellules affectées entrent en apoptose car elles sont incapables de gérer de telles modifications, une extension de la théorie du just right [
11] suggère qu’un nouvel équilibre doit cependant intervenir entre les différents effets associés aux mutations du gène APC dans un petit nombre de cellules, leur permettant de dériver vers un état néoplasique. |
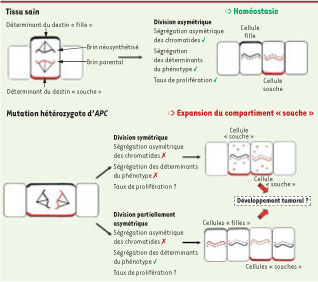
Orientation asymétrique du fuseau mitotique et destin cellulaire Par ailleurs, un point important reste également en suspens en ce qui concerne l’impact de cette orientation particulière du fuseau mitotique sur la régulation du destin cellulaire. Ainsi, le travail de Quyn et al. ne démontre pas de façon formelle que la perte de ségrégation asymétrique des chromatides s’accompagne nécessairement d’une perte de la répartition asymétrique des protéines, déterminants plus immédiats du phénotype cellulaire. En d’autres termes, les cellules filles issues de la division altérée des cellules souches dans le modèle hétérozygote Apc
+/−
sont-elles différentes l’une de l’autre, ou bien cette division est-elle devenue complètement symétrique ? Le fait que la proportion des différents lignages différenciés n’est pas fondamentalement altérée dans l’épithélium intestinal de ces souris semble arguer en faveur de la première alternative. Cette hypothèse impliquerait que l’une des deux cellules continue à présenter des caractéristiques de cellule souche (peut-être en partie à cause de son positionnement), mais ne conserverait plus nécessairement son ADN parental. Lors des divisions ultérieures, un tel mécanisme permettrait à une ou plusieurs mutations supplémentaires d’affecter cette cellule « souche » au lieu de cibler de façon mécanique la cellule destinée à se différencier, augmentant ainsi l’impact potentiel de ces mutations sur le développement tumoral (Figure 1).  | Figure 1
Représentation schématique de l’orientation du fuseau mitotique et de la ségrégation des chromatides et des déterminants protéiques du destin cellulaire dans les cellules souches intestinales du tissu sain et du tissu précancéreux. Dans le tissu sain, la ségrégation asymétrique de toutes les composantes permet de maintenir l’homéostasie. À la suite de mutations hétérozygotes du gène Apc, la ségrégation asymétrique des chromatides est perdue dans la majorité des cellules souches. Cependant, plusieurs possibilités existent (et coexistent peutêtre) concernant la ségrégation des déterminants plus immédiats du phénotype. Au moins deux de ces possibilités (division symétrique en deux cellules à caractère « souche » ou division asymétrique lors de laquelle la cellule souche est altérée et ne contient plus forcément le brin d’ADN parental) pourraient participer à l’initiation du développement tumoral. Le symbole vert (ⅳ) indique la survenue du processus, le symbole rouge (╳) son absence. |
L’alternative d’une division réellement symétrique induite par la mutation hétérozygote de Apc dans la majorité des cellules souches donnerait quant à elle naissance soit à deux cellules souches, soit à deux cellules ayant vocation à devenir post-mitotiques et différenciées. Ces deux types de division symétrique ont déjà été identifiés dans les cellules souches intestinales : la première hypothèse entraînerait l’expansion du compartiment souche (et pourrait ainsi jouer un rôle dans le développement tumoral, Figure 1), alors que la deuxième conduirait à l’extinction des clones affectés et à un phénomène de conversion clonale des cryptes [
12]. Cependant, aucun de ces deux mécanismes n’est détecté de façon globale dans toutes les cryptes de ces souris, en partie parce que la perte de division asymétrique n’affecte pas toutes les cellules souches, mais peut-être également parce que ses conséquences ne sont pas identiques dans toutes les cellules souches de l’épithélium ; s’établirait alors un nouveau niveau d’équilibre entre les divisions d’expansion et celles d’extinction. Bien que les pertes d’orientation du fuseau et de la division asymétrique identifiées par Quyn et al. concernent les positions 1 à 7 de la crypte, l’identification formelle des cellules concernées n’est pas toujours facile, en particulier pour les cellules Bmi1+, et l’existence d’un mécanisme de régulation différent pour les cellules Lgr5+ et Bmi1+ ne peut pas être exclue à ce stade. |
Quelles perspectives en physiopathologie humaine ? Sur le plan physiopathologique, cette problématique est particulièrement relevante dans le cas des patients atteints du syndrome héréditaire de polypose adénomateuse familiale (PAF), puisque toutes les cellules portent une mutation du gène APC similaire à celle qui caractérise le modèle de souris utilisé par Quyn et al. Bien que de nombreux adénomes se développent dans l’épithélium intestinal de ces patients, chaque cellule souche ne génère pas un adénome, suggérant bien que la perte d’orientation du fuseau initie un processus de transformation uniquement dans certaines cellules. De plus, les données récentes de la littérature suggèrent que le nombre de cellules souches est significativement élevé dans les adénomes intestinaux des patients PAF [
13]. On peut donc postuler que les divisions des cellules souches intestinales gardent un degré d’asymétrie sur le plan phénotypique (y compris du fait de la ségrégation au hasard des chromatides parentales et néosynthétisées) générant de façon non homogène certaines cellules à caractère souche présentant un avantage sélectif (par ex. un taux de renouvellement accru) et à partir desquelles vont émerger les adénomes. Enfin, ces patients ont un risque accru de développer d’autres pathologies cancéreuses (hépatoblastomes, tumeurs thyroïdiennes, desmoïdes, cérébrales, etc.). Le mécanisme d’initiation tumorale engendré par l’orientation anormale du fuseau mitotique et par la perte de division asymétrique ne serait donc pas restreint à l’intestin chez ces patients, et pourrait également jouer un rôle dans ces autres organes dans les rares cas où ils sont le siège d’une mutation de APC. |
Les auteurs déclarent n’avoir aucun confit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Kaltschmidt JA, Davidson CM, Brown NH, Brand AH. Rotation and asymmetry of the mitotic spindle direct asymmetric cell division in the developing central nervous system. Nat Cell Biol 2000 ; 2 : 7-12. 2. Morrison SJ, Kimble J. Asymmetric and symmetric stem-cell divisions in development and cancer. Nature 2006 ; 441 : 1068-74. 3. Quyn AJ, Appleton PL, Carey FA, et al. Spindle orientation bias in gut epithelial stem cell compartments is lost in precancerous tissue. Cell Stem Cell 2010 ; 6 : 175-81. 4. Barker N, Ridgway RA, van Es JH, et al. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 2009 ; 457 : 608-11. 5. Li L, Clevers H. Coexistence of quiescent and active adult stem cells in mammals. Science 2010 ; 327 : 542-5. 6. Falconer E, Chavez EA, Henderson A, et al. Identification of sister chromatids by DNA template strand sequences. Nature 2010 ; 463 : 93-7. 7. Cairns J. Mutation selection and the natural history of cancer. Nature 1975 ; 255 : 197-200. 8. Yamashita YM, Jones DL, Fuller MT. Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science 2003 ; 301 : 1547-50. 9. Cabello J, Neukomm LJ, Gunesdogan U, et al. The Wnt pathway controls cell death engulfment, spindle orientation, and migration through CED-10/Rac. PLoS Biol 2010 ; 8 : e1000297. 10. Tighe A, Johnson VL, Taylor SS. Truncating APC mutations have dominant effects on proliferation, spindle checkpoint control, survival and chromosome stability. J Cell Sci 2004 ; 117 : 6339-53. 11. Albuquerque C, Breukel C, van der Luijt R, et al. The just-right signaling model: APC somatic mutations are selected based on a specific level of activation of the beta-catenin signaling cascade. Hum Mol Genet 2002 ; 11 : 1549-60. 12. Shibata D. Inferring human stem cell behaviour from epigenetic drift. J Pathol 2009 ; 217 : 199-205. 13. Kim KM, Calabrese P, Tavare S, Shibata D. Enhanced stem cell survival in familial adenomatous polyposis. Am J Pathol 2004 ; 164 : 1369-77. 14. Rocheteau P, Tajbakhsh S. ADN immortel ou signature épigénétique ? Med Sci (Paris) 2008 ; 24 : 847-52. |