| |
| Med Sci (Paris). 2010 December; 26(12): 1020–1022. Published online 2010 December 15. doi: 10.1051/medsci/201026121020.Identification des cellules à l’origine du carcinome basocellulaire Khalil Kass Youssef,1 Gaëlle Lapouge,1 Alexandra Van Keymeulen,1 and Cédric Blanpain1* 1Université libre de Bruxelles (ULB), IRIBHM, 808, route de Lennik, Bruxelles B-1070, Belgique MeSH keywords: Animaux, Carcinome basocellulaire, embryologie, génétique, anatomopathologie, Transformation cellulaire néoplasique, Épiderme, cytologie, Régulation de l'expression des gènes tumoraux, Follicule pileux, Protéines Hedgehog, physiologie, Humains, Souris, Souris transgéniques, Cellules souches tumorales, Oncogènes, Récepteurs couplés aux protéines G, Tumeurs cutanées, Récepteur Smoothened |
Les carcinomes basocellulaires (BCC) sont des tumeurs épithéliales de l’épiderme généralement localisées au niveau des zones de la peau exposées au soleil et dont on pense qu’ils ont pour origine le follicule pileux étant donné leur ressemblance histologique et biochimique avec celui-ci [
1]. Le BCC est le cancer le plus fréquent chez l’homme, 750 000 nouveaux cas sont diagnostiqués par an aux États-Unis, et son incidence ne devrait qu’augmenter dans les années à venir étant donné l’augmentation de l’exposition aux UV des populations caucasiennes [
2]. Les BCC héréditaires et sporadiques résultent d’une activation constitutive et aberrante de la voie de signalisation Sonic hedgehog (Shh), associée le plus fréquemment à des mutations perte de fonction de Patched - un gène codant pour un inhibiteur de la voie Shh - ou à des mutations gain de fonction du gène Smoothened (Smo) qui code pour un activateur de la voie Shh [
11]. La mutation de Smo la plus fréquente est la mutation W565L appelée SmoM2 [
3]. Comme c’est le cas pour la plupart des cancers, la cible cellulaire exacte des mutations oncogéniques initiales dans le BCC n’est pas connue. L’épiderme cutané est composé de la juxtaposition d’unités pilosébacées comprenant un follicule pileux et des glandes sébacées séparées par l’épiderme interfolliculaire. Afin d’identifier précisément les cellules à l’origine du BCC, nous avons développé des modèles génétiques chez la souris permettant d’exprimer spécifiquement dans les différents compartiments de l’épiderme un mutant constitutivement actif de la protéine Smoothened (SmoM2), qui induit la formation de l’ensemble des cancers liés à l’activation aberrante de la voie Shh, dont les BCC [
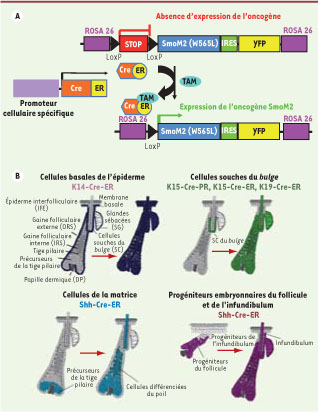
4] (Figure 1). Nous avons obtenu ou généré des souris transgéniques exprimant la recombinase Cre activable par l’administration d’un analogue de l’œstrogène (tamoxifène), Cre-ER, spécifiquement dans les différents compartiments de l’épiderme cutané. Cette approche permet une activation contrôlée dans le temps et dans l’espace de l’oncogène SmoM2 dans les différents types cellulaires de la peau. La présence en aval de la séquence SmoM2 d’un site IRES (internal ribosome entry site) et d’une séquence codant pour une protéine fluorescente (YFP, yellow fluorescent protein) permet de suivre le devenir des cellules exprimant l’oncogène (Figure 1).
 | Figure 1
Modèle d’activation de l’oncogène SmoM2 dans les différents compartiments de l’unité pilosébacée. A. Schéma d’action du système cre-lox inductible par le tamoxifène. L’expression de la recombinase Cre fusionnée au récepteur des œstrogènes (CreER) est contrôlée par un promoteur spécifique d’un compartiment de l’épiderme. En présence de tamoxifène, la recombinase CreER est transportée dans le noyau et excise le site stop, ce qui permet l’expression de l’oncogène et de la YFP présent dans le locus ubiquitaire Rosa26.
B. Schéma représentatif de la localisation de l’expression de chacune des constructions Cre et de leurs descendants. Le promoteur K14 (kératine)-CreER est exprimé dans toutes les cellules basales de l’unité pilosébacée et conduit à la formation de l’entièreté du follicule pileux et de l’épiderme interfolliculaire. Les promoteurs K15 et K19 ciblent exclusivement les cellules souches du follicule pileux qui sont à l’origine de tout le follicule pileux situé en dessous de la glande sébacée (CrePR est une CRE inductible par la progestérone). Le promoteur Shh cible exclusivement les cellules du compartiment d’amplification transitoire de la matrice qui permettent la formation des structures internes du follicule pileux et du poil lui-même. Au cours de la morphogenèse du follicule pileux, le promoteur Shh cible les progéniteurs du follicule conduisant à la formation du follicule pileux incluant la glande sébacée et l’infundibulum. |
|
Les cellules souches du follicule ne sont pas à l’origine du BCC Le follicule pileux se renouvelle grâce à la présence d’une population de cellules souches multipotentes localisée dans une région du follicule pileux nommée le bulge (bulge signifie renflement en français) [
5,
12]. Ces cellules ont été longtemps pressenties comme cibles de l’événement oncogénique initial du BCC [2]. L’expression de SmoM2 dans les cellules souches du bulge et leur descendance, étudiée grâce à l’utilisation de 3 lignées de souris transgéniques différentes exprimant la Cre-ER dans les cellules souches du bulge, n’induit pas de formation de BCC invasif après 10 semaines. Ce délai permet en revanche la formation de nombreux BCC lorsque l’oncogène SmoM2 est exprimé dans l’ensemble des cellules de l’épiderme. Les cellules souches du bulge ne sont cependant pas insensibles à l’expression de SmoM2 et peuvent présenter des lésions histologiques pathologiques comme une hyperplasie ou une dysplasie, mais ces lésions ne semblent pas évoluer vers un cancer invasif. Cette résistance à la progression tumorale ne semble pas être liée à une incapacité des cellules à répondre à l’expression de l’oncogène SmoM2. En effet, l’expression des gènes cibles en aval de la voie Shh comme les gènes Gli1 ou Patched est augmentée, même si c’est de façon plus modérée que dans les cellules de l’épiderme interfolliculaire [
6]. |
Le BCC a pour origine l’épiderme interfolliculaire et l’infundibulum Si les cellules souches du bulge ne sont pas les cellules cibles des BCC, quel autre compartiment de l’épiderme pourrait être impliqué ? Afin de répondre à cette question, nous avons réalisé pour la première fois une analyse clonale au cours du développement cancéreux. Pour ce faire, nous avons administré de faibles doses de tamoxifène aux souris exprimant la Cre-ER dans tous les compartiments de l’épiderme cutané. Ces conditions induisent une expression initiale de SmoM2 dans des cellules suffisamment distantes les unes des autres pour permettre de suivre au cours du temps le devenir de la descendance de chacune des cellules exprimant SmoM2. Nous avons ainsi montré que les BCC émergent majoritairement dans l’épiderme interfolliculaire (> 90 %). Les autres BCC proviennent de l’infundibulum, la partie de l’épiderme qui relie le follicule à l’épiderme interfolliculaire, comme cela avait été précédemment proposé [
7]. De plus, des BCC ont été aussi observés dans les régions auriculaires à faible densité folliculaire et dans la paume des pattes, totalement dépourvue de follicules, ce qui renforce l’idée selon laquelle les BCC ont préférentiellement pour origine l’épiderme non folliculaire. La région de l’infundibulum est constituée de cellules dont certaines ont la même origine embryonnaire que les cellules souches du bulge [
8]. Afin de déterminer si le développement de tumeurs provenant de l’infundibulum est lié à l’environnement dans lequel ces cellules résident ou à leur origine embryonnaire, nous avons exprimé l’oncogène SmoM2 dans les progéniteurs communs à l’infundibulum et au bulge durant la morphogenèse de l’épiderme. D’une manière intéressante, aucun BCC ne s’est développé lors de l’expression de SmoM2 dans ces progéniteurs communs, suggérant que l’origine embryonnaire des cellules de l’infundibulum est un paramètre plus important que leur localisation tissulaire pour leur capacité à former des BCC [6]. |
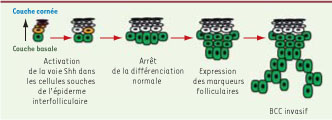
Les cellules souches unipotentes de l’épiderme interfolliculaire à l’origine du BCC L’homéostasie de l’épiderme interfolliculaire est assurée par une population de cellules souches unipotentes localisées tout le long de cet épiderme [5]. Bien qu’il n’existe pas à ce jour de marqueurs connus spécifiques de ces cellules souches unipotentes, l’analyse clonale permet de les marquer et de les visualiser grâce à l’expression à long terme de traceurs dans ces clones qui ressemblent à des colonnes de cellules allant de la couche basale (lieu de localisation des cellules souches) à la couche cornée (différenciée) [
9,
10]. Nous avons cherché à déterminer si l’expression de l’oncogène SmoM2 doit se produire au niveau de ces cellules souches unipotentes ou si l’oncogène SmoM2 change la probabilité des cellules souches de se renouveler ou induit le renouvellement de cellules normalement vouées à la différenciation terminale. Nous avons comparé le nombre de clones à partir de cellules basales au cours du temps dans des souris exprimant soit la YFP uniquement, soit l’oncogène SmoM2 suivi de la YFP. D’une manière intéressante, la proportion de clones dérivés de cellules basales qui se maintiennent à long terme est identique dans les souris YFP et les souris SmoM2. Ceci suggère que dans les phases initiales de la progression tumorale, l’expression de l’oncogène SmoM2 ne change pas la probabilité des cellules souches de s’autorenouveler, et seules celles résidant d’une manière prolongée dans l’épiderme sont compétentes pour développer des BCC. De plus, la majorité des clones SmoM2 résidant d’une manière prolongée dans l’épiderme progressent en cancer invasif, démontrant que la progression tumorale du BCC ne requiert pas l’accumulation d’autres évènements génétiques ou épigénétiques survenant de façon aléatoire dans les cellules souches initialement mutées [6]. Après l’activation de l’expression de SmoM2, les progéniteurs de l’épiderme interfolliculaire perdent progressivement leur capacité de différenciation habituelle et adoptent une morphologie similaire à celle d’un follicule pileux embryonnaire. Ce changement morphologique est accompagné de l’expression de marqueurs folliculaires (Figure 2). Ainsi, la présence de marqueurs folliculaires par les BCC est le reflet de la progression tumorale plus que de son origine folliculaire et démontre clairement que la caractérisation biochimique et morphologique d’une tumeur n’est pas suffisante pour déterminer son origine cellulaire [6].  | Figure 2
Modèle d’initiation du BCC chez la souris adulte. L’activation de la voie Hedgehog dans les cellules souches de l’épiderme entraîne un arrêt de leur différenciation normale, induit l’expression de marqueurs du follicule pileux et finalement conduit à la progression en BCC invasif. |
|
Conclusions et perspectives En conclusion, nous avons montré que les BCC ont pour origine des cellules souches de l’épiderme interfolliculaire et non pas des cellules souches du follicule comme on le croyait. Il reste maintenant à comprendre pourquoi les cellules souches du bulge sont résistantes à la progression maligne et à déterminer les événements moléculaires qui sont nécessaires pour la transformation maligne des cellules souches de l’épiderme interfolliculaire en BCC invasif. Il serait également intéressant de déterminer si les autres types de cancers cutanés, comme le carcinome spinocellulaire, proviennent aussi des cellules souches de l’épiderme interfolliculaire ou si ces tumeurs peuvent provenir des cellules souches du bulge.
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Owens DM, Watt FM. Contribution of stem cells and differentiated cells to epidermal tumours. Nat Rev Cancer 2003 ; 3 : 444-51. 2. Epstein, EH. Basal cell carcinomas: attack of the hedgehog. Nat Rev Cancer 2008 ; 8 : 743-54. 3. Xie J, Murone M, Luoh SM, et al. Activating Smoothened mutations in sporadic basal-cell carcinoma. Nature 1998 ; 391 : 90-2. 4. Mao J, Ligon KL, Rakhlin EY, et al. A novel somatic mouse model to survey tumorigenic potential applied to the Hedgehog pathway. Cancer Res 2006 ; 66 : 10171-8. 5. Blanpain C, Fuchs E. Epidermal homeostasis: a balancing act of stem cells in the skin. Nat Rev Mol Cell Biol 2009 ; 10 : 207-17. 6. Youssef KK, Van Keymeulen A, Lapouge G, et al. Identification of the cell lineage at the origin of basal cell carcinoma. Nat Cell Biol 2010 ; 12 : 299-305. 7. Adolphe C, Hetherington R, Ellis T, Wainwright B. Patched1 functions as a gatekeeper by promoting cell cycle progression. Cancer Res 2006 ; 66 : 2081-8. 8. Levy V, Lindon C, Harfe BD, Morgan BA. Distinct stem cell populations regenerate the follicle and interfollicular epidermis. Dev Cell 2005 ; 9 : 855-61. 9. Ghazizadeh S, Taichman LB. Multiple classes of stem cells in cutaneous epithelium: a lineage analysis of adult mouse skin. Embo J 2001 ; 20 : 1215-22. 10. Clayton E, Doupé DP, Klein AM, et al. A single type of progenitor cell maintains normal epidermis. Nature 2007 ; 446 : 185-9. 11. Basset-Seguin N, Soufir N. Voie Patched/Sonic Hedgehog et carcinomes basocellulaires. Med Sci (Paris) 2004 ; 20 : 899-903. 12. Guasch G, Blanpain C. Les cellules souches épidermiques organisent leur niche. Med Sci (Paris) 2004 ; 20 : 265-7. |