| |
| Med Sci (Paris). 2010 November; 26(11): 950–959. Published online 2010 November 15. doi: 10.1051/medsci/20102611950.Résistance aux carbapénèmes chez les bacilles à Gram négatif Patrice Nordmann* Service de bactériologie-virologie, hôpital de Bicêtre et unité Inserm U914, 78, rue du général Leclerc, 94275 Le Kremlin Bicêtre, France |
Les carbapénèmes (voir Glossaire) demeurent les β-lactamines dont le spectre d’activité est le plus large. Elles sont utilisées pour traiter de nombreuses infections nosocomiales, en particulier celles liées aux espèces de bacilles à Gram négatif les plus fréquentes que sont les entérobactéries Pseudomonas aeruginosa et Acinetobacter baumannii.
L’activité de ces carbapénèmes est liée en particulier à la rapidité de leur pénétration à travers la paroi externe des bacilles à Gram négatif et à leur stabilité vis-à-vis de la plupart des β-lactamases naturelles ou acquises, y compris les β-lactamases à spectre étendu (BLSE) de type TEM1,, SHV2,, CTX-M3 et les céphalosporinases codées par des gènes chromosomiques ou des gènes plasmidiques (voir Glossaire). L’émergence de la résistance aux carbapénèmes (imipénème, méropénème, doripénème, ertapénème) est l’un des problèmes les plus importants posé par la résistance aux antibiotiques car il existe peu d’alternatives thérapeutiques possibles. Cette résistance aux carbapénèmes a été rapportée dans les années 1990. Elle était alors extrêmement limitée géographiquement, essentiellement au Japon, et due à un type particulier de carbapénèmases (enzymes ayant une forte activité d’hydrolyse des carbapénèmes) : les métallo-β-lactamases de type IMP [
1]. Puis, progressivement, l’impact clinique et la diversité des carbapénèmases se sont accrus considérablement pour devenir significatifs au milieu des années 2000, en particulier chez les entérobactéries. Elles constituent désormais une préoccupation majeure de santé publique. Globalement, la résistance aux carbapénèmes des bacilles à Gram négatif s’explique par deux grands mécanismes : (1) l’expression de carbapénèmases, et (2) l’association de déficits quantitatifs ou qualitatifs de porines [
38] qui permettent le passage transmembranaire de carbapénèmes - voire la surexpression de systèmes d’efflux - et d’une surexpression de β-lactamases qui ont une très faible activité intrinsèque de carbapénèmase. L’émergence de résistances aux carbapénèmes est particulièrement notable chez les espèces de bacilles à Gram négatif qui ont naturellement des coefficients de diffusion transmembranaire aux β-lactamines relativement bas comme Enterobacter cloacae, Pseudomonas aeruginosa et Acinetobacter baumannii. Cette résistance reste beaucoup plus fréquente en milieu hospitalier qu’en milieu communautaire.

|
Les carbapénèmes sont essentiellement prescrites dans le traitement des infections à entérobactéries dont l’origine est nosocomiale et, plus rarement, communautaire. Certaines publications montrent l’extension de cette résistance chez les entérobactéries : elle ne demeure plus restreinte à certaines régions du monde et elle touche désormais des espèces qui peuvent être typiquement communautaires comme l’est E. coli [
2-
6]. Imperméabilité membranaire et expression de β-lactamases La résistance aux carbapénèmes des entérobactéries a d’abord été décrite chez des espèces d’entérobactéries qui produisent naturellement des céphalosporinases. La surexpression de ces céphalosporinases chromosomiques, associée à une modification de perméabilité de la membrane externe, a été à l’origine, par exemple, de la résistance aux carbapénèmes (et autres β-lactamines) que l’on avait observée chez Enterobacter sp. (environ 1 % des souches) associée à une modification des porines de type OmpC et OmpF [
7]. Des mécanismes de résistance similaires ont été décrits chez Serratia sp., Citrobacter freundii, Morganella morganii. Ces résistances aux carbapénèmes associant l’expression de céphalosporinases et une diminution de perméabilité ont été observées chez des espèces d’entérobactéries qui, elles, n’expriment pas naturellement de céphalosporinases comme E. coli, K. pneumoniae et Salmonella spp, mais qui expriment des céphalosporinases plasmidiques. Les modifications de porines qui ont été identifiées sont de nature variable et touchent OmpK 35/36 chez K. pneumoniae, OmpF et OmpC chez E. coli, OmpD chez Salmonella typhinurium. Dans ces cas, les souches d’entérobactéries sont nosocomiales ou communautaires et les gènes de céphalosporinases sont variables (CMY-2, DHA-1, etc.) [ 7-
9]. Ces gènes plasmidiques de céphalosporinases proviennent d’entérobactéries diverses : Hafnia alvei, Morganella morganii, Aeromonas sp., etc. Les niveaux de résistance aux carbapénèmes sont assez variables, ces résistances concernant plus l’ertapénème que l’imipénème ou le méropénème. À la différence des mécanismes de résistance qui associent imperméabilité membranaire et surexpression de céphalosporinases chromosomiques, ces résistances associant céphalosporinases plasmidiques et imperméabilité s’observent chez des souches qui sont également résistantes à d’autres antibiotiques (aminosides, tétracycline, sulfamides, etc.) du fait même de la colocalisation plasmidique de ces gènes de résistance [ 7]. Plusieurs études font état de l’émergence de ces souches résistantes (ou ayant une sensibilité diminuée) aux carbapénèmes après traitement par ces antibiotiques [ 7, 9,
10]. De façon très similaire, l’association de β-lactamases de type BLSE (TEM, SHV, CTX-M, etc.) et d’une diminution de perméabilité de la membrane externe peut être la source d’une résistance aux carbapénèmes dans toute espèce d’entérobactéries qui exprime ces BLSE plasmidiques : K. pneumoniae, P. mirabilis, E. coli, Salmonella sp., Enterobacter, etc. [ 7, 10]. La crainte du développement de ces mécanismes de résistance résulte de l’extension mondiale de l’endémie de souches d’ E. coli exprimant des β-lactamases CTX-M. Ces souches, à leur tour, favoriseraient la prescription, en milieu communautaire, de carbapénèmes, bien qu’actuellement, en France, cette prescription reste d’usage hospitalier. Plusieurs études suggèrent cependant que ces souches résistantes aux carbapénèmes et présentant une modification importante de porines seraient relativement instables [ 7]. En effet, une modification de ces porines de membrane entraînerait une diminution de la croissance bactérienne liée à une moindre utilisation de substrats. Le mécanisme de résistance aux carbapénèmes lié à l’expression d’une carbapénèmase est plus stable et plus important d’un point de vue clinique. Expression de carbapénèmases Données moléculaires Les carbapénèmases des entérobactéries appartiennent aux quatre classes de β-lactamases (classes A, B, C, D de la classification de Ambler 4) [
4,
5]. Les plus importantes cliniquement sont, actuellement, les β-lactamases de type KPC (Klebsiella pneumoniae carbapenemase), IMP/VIM 5 et OXA-48 chez les entérobactéries (voir Glossaire).
Parmi les carbapénèmases de classe A, plusieurs études avaient rapporté que des souches d’entérobactéries, le plus souvent de l’environnement (Serratia, Enterobacter), produisaient des β-lactamases dont l’activité était inhibée par l’acide clavulanique et qui hydrolysaient, à des degrés divers, toutes les β-lactamines. Les gènes codant ces enzymes étaient chromosomiques et régulés, ou plasmidiques. Il s’agissait de souches d’entérobactéries exprimant NmcA, Sme-1, Sme-2/Sme-3, IMI-1/IMI-2, ou SFC-1 [4, 5]. Ces souches sont rares et n’ont pas de diffusion clinique importante actuellement, bien que, par exemple, E. asburiae, qui exprime une β-lactamase IMI-1, ait été identifiée dans de très nombreuses rivières américaines [4]. Certaines autres carbapénèmases, des β-lactamases de type GES6,, ont été identifiées chez K. pneumoniae et E. coli [4, 5]. Ces enzymes GES-4, GES-5 et GES-6 hydrolysent les carbapénèmes relativement faiblement. Il s’agit de véritables BLSE analogues à la BLSE GES-1, dont elles ne diffèrent que par de simples changements ponctuels d’acides aminés. Les carbapénèmases de classe A, les plus fréquentes et les plus menaçantes, sont les carbapénèmases de type KPC (KPC-2 à KPC-8) [
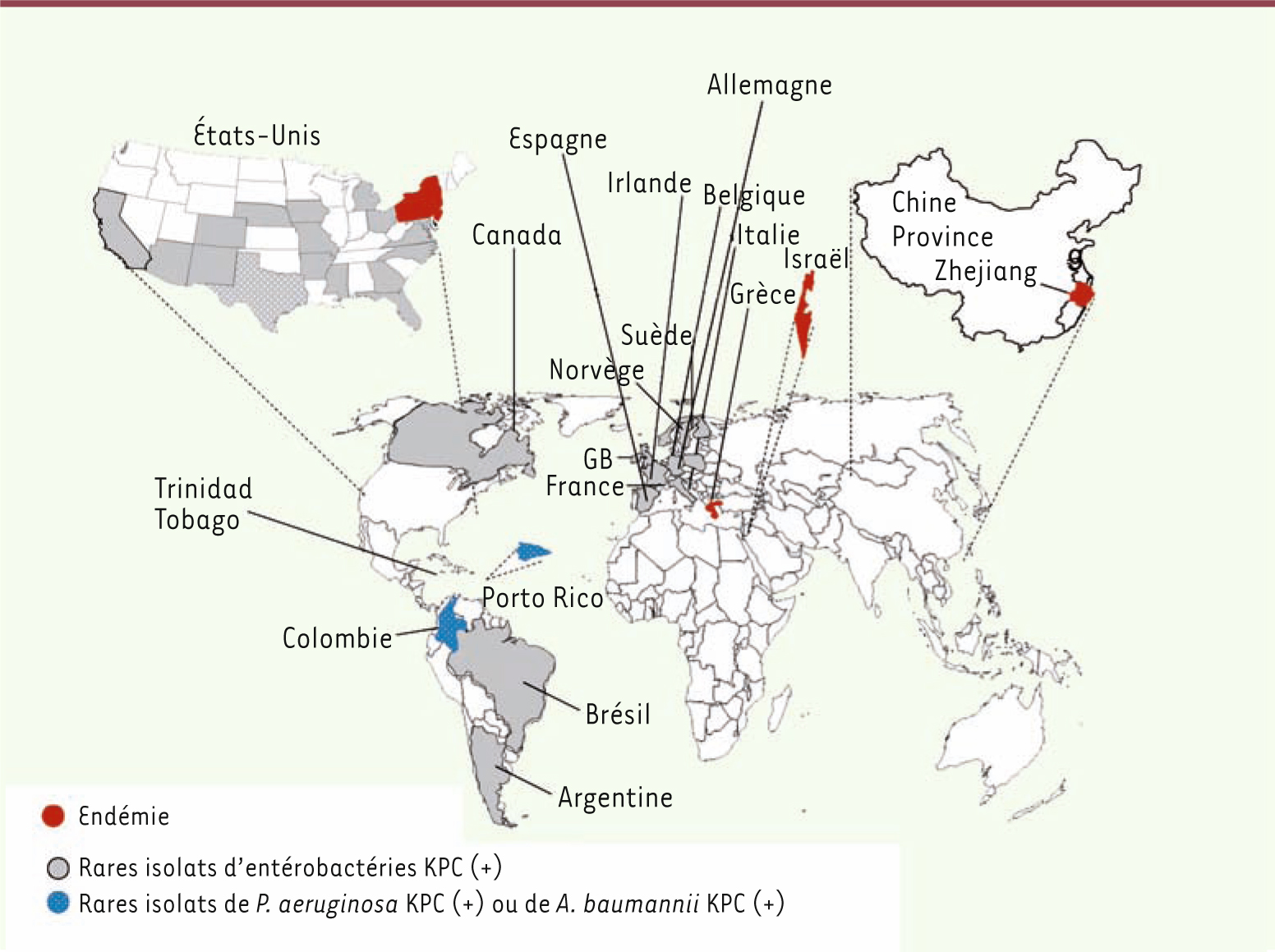
3]. La première souche exprimant KPC (KPC-2) fut une souche de K. pneumoniae, identifiée en 1996 en Caroline du Nord aux États-Unis. KPC-2 hydrolyse toutes les β-lactamines bien que les céfamycines et la ceftazidime soient de mauvais substrats. Son activité est partiellement inhibée par l’acide clavulanique. En l’absence de mécanismes associés de résistance aux carbapénèmes, elle confère des degrés variables de résistance à ces antibiotiques (Tableau I). Mais, dans la plupart des souches cliniques, une modification de perméabilité de la membrane externe lui est associée, expliquant que de hauts niveaux de résistance aux carbapénèmes soient observés. KPC-2 a été identifiée essentiellement chez K. pneumoniae et, dans une moindre mesure, chez E. coli, P. mirabilis, Enterobacter sp., Serratia sp. [3]. Aucune donnée n’explique la diffusion préférentielle de cette carbapénèmase chez K. pneumoniae en milieu hospitalier. Après l’identification des premières souches sur la côte est des États-Unis, d’autres souches d’entérobactéries productrices de KPC ont été fréquemment rapportées dans la plupart des États des États-Unis, avec une forte prévalence dans l’État de New-York. Dans certains cas, 30 % des souches de K. pneumoniae exprimaient une BLSE de type KPC (+) [3]. Puis, ces souches ont été beaucoup décrites en Israël et en Grèce où elles semblent être maintenant endémiques (Figure 1). Elles ont ensuite été rapportées dans la plupart des pays européens de façon sporadique, au Canada, en Amérique du Sud et en Chine (Figure 1) [3]. En France, une dizaine de souches d’entérobactéries KPC (+) ont été identifiées. Dans tous les cas, il s’agit de souches de K. pneumoniae exprimant KPC-2 qui sont présentes chez des patients ayant été hospitalisés au préalable en Grèce et aux États-Unis. Une épidémie de telles souches de K. pneumoniae a été identifiée récemment dans plusieurs hôpitaux parisiens et a été rapidement circonscrite (P. Nordmann, données personnelles).
 | Figure 1
Distribution internationale de la carbapénèmase de type KPC. Situation au 1 er avril 2010 (adapté de P. Nordmann et al. [ 3]). |
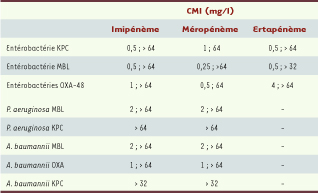
 | Tableau I
Variabilité de la résistance aux carbapénèmes des souches cliniques de bacilles à Gram négatif exprimant une carbapénèmase acquise. CMI : concentration minimale inhibitri ce ; KPC : Klebsiella pneumoniae carbapénèmase ; MBL : métallo-β-lactamase ; OXA : oxacillinases de types OXA-23, OXA-40, OXA-58 et OXA-143. |
Ces souches de K. pneumoniae KPC (+) ont habituellement un même fond génétique, ST-238 et proviendraient d’un même clone [3]. Cependant, une comparaison récente des souches de K. pneumoniae exprimant une même enzyme KPC-2 montre une variabilité à partir de ce fond génétique et une variabilité des plasmides possédant ce même gène. Ce résultat suggère l’émergence de plusieurs clones à l’origine de cette épidémie de résistance. Une analyse moléculaire des structures génétiques associées à ces gènes KPC montre qu’ils sont associés à des transposons de même nature de type Tn3 [3]. La mobilité de ces structures contribuerait à la diffusion de ces gènes de carbapénèmases. Données cliniques et évolution des entérobactéries de type KPC D’un point de vue clinique, les infections associées à ces souches d’entérobactéries associées sont sans grandes particularités en ce qui concerne leur nature ou leur terrain de survenue [ 3,
11,
12]. Cependant, la mortalité liée à ces infections à K. pneumoniae de type KPC est élevée car la multirésistance des souches explique le manque d’efficacité des traitements empiriques de première intention [ 12]. Les études récentes montrent la diffusion de ce déterminant de résistance dans les infections survenant chez des patients hospitalisés en services de soins de suite et de réadaptation, d’où la nécessité de leur détection précoce [ 3, 12].

Les niveaux de résistance aux carbapénèmases étant très hétérogènes dans ces souches KPC (+) [3] (Tableau I), il est parfois difficile de les identifier par une simple analyse de leur phénotype de résistance. La résistance à l’ertapénème semble être l’un des meilleurs indicateurs de leur présence, que ce soit dans des tests en milieu solide ou liquide. Actuellement, seules des techniques de PCR permettent d’identifier avec certitude ces souches résistantes [3,
13]. L’identification des patients sains, porteurs de ces souches dans leur flore intestinale, revêt un intérêt particulier pour circonscrire en son tout début une épidémie naissante. Dans ce cadre, deux milieux de screening peuvent être utilisés avec succès : le milieu dit « CHROMagar KPC » (Chromagar, France) et le milieu dit « ChromID ESBL » (bioMérieux, France) [13,
14]. Le milieu ChromID ESBL permet la détection de toute souche exprimant une BLSE qui fait également partie du spectre d’hydrolyse des enzymes de type KPC, détection d’autant plus aisée que ces souches KPC expriment le plus souvent une BLSE (SHV, TEM, CTX-M) (P. Nordmann, données personnelles).
Ces carbapénèmases plasmidiques de type KPC contribueront de façon significative à la multirésistance à venir de nombreuses souches d’entérobactéries. On ne sait pas si la dissémination de ces souches actuellement nosocomiale est (ou sera) communautaire dans des pays à forte prévalence comme les États-Unis, la Grèce, Israël ou certains pays d’Amérique du Sud ou des Caraïbes. Autres carbapénèmases (hors KPC)
-
Carbapénèmase OXA-48. Mis à part les β-lactamases de type KPC, les entérobactéries peuvent exprimer une carbapénèmase particulière, OXA-48 [
15-
17]. Cette enzyme a été identifiée initialement à partir d’une souche de K. pneumoniae de Turquie, il y a une dizaine d’années [15]. Cette β-lactamase de classe D hydrolyse les carbapénèmes plus faiblement que KPC et n’hydrolyse pas les céphalosporines de troisième génération. Son activité n’est pas inhibée par l’acide clavulanique. OXA-48 a été identifiée à de nombreuses reprises dans plusieurs isolats de Turquie, mais également à partir d’isolats de pays du pourtour méditerranéen, y compris en France, et plus récemment en Grande-Bretagne et en Argentine [15-17]. Cette β-lactamase est souvent associée à des BLSE (SHV, CTX-M), ce qui facilite sa détection par des milieux de screening contenant une céphalosporine (milieu ChromID) [15]. Le réservoir naturel de ce gène de résistance a été déterminé comme étant Shewanella sp., ce qui suggère un transfert environnemental en milieu aqueux de ce gène de résistance [
18]. Le gène codant OXA-48 est inclus dans un transposon comportant deux séquences d’insertion identiques qui assurent mobilité et expression [15]. La diffusion de ce gène de carbapénèmase est déjà probablement effective dans des entérobactéries variées (K. pneumoniae, E. coli, Salmonella, etc.). Sa détection est particulièrement délicate si elle est basée sur le seul phénotype de résistance aux β-lactamines car les niveaux de résistance aux carbapénèmes sont parfois limités à une simple réduction de sensibilité [15]. Ainsi, les porteurs de souches exprimant OXA-48 sont très difficiles à identifier et donc à isoler. Seuls les outils moléculaires permettent leur excellente identification.
-
Certaines carbapénèmases de classe B (IMP) (ou métallo-β-lactamases) avaient été identifiées tout d’abord dans des espèces d’entérobactéries hospitalières (Serratia, Citrobacter et Enterobacter) au Japon [
19]. Puis d’autres carbapénèmases ont été isolées dans d’autres régions du monde [1, 4, 19–
22]. Il s’agit des P-lactamases de types VIM, NDM-17,, GIM8,. Les enzymes de types VIM et IMP sont les plus répandues. Leur hôte le plus habituel est K. pneumoniae et les niveaux d’expression de la résistance sont variables [1] (Tableau I). L’utilisation de différents types de β-lactamines et de quinolones a pu favoriser l’émergence de ces souches [11]. Les facteurs de risque qui favorisent la sélection de ces souches sont ceux, classiques, de la sélection de résistance aux antibiotiques en milieu nosocomial : immunodépression, hospitalisation en service de soins intensifs, pose d’un cathéter, prescription d’antibiotiques [11]. Plusieurs épidémies de souches d’entérobactéries productrices de ce type de carbapénèmases ont été identifiées, notamment au Japon, en Italie, en Espagne et en Grèce [1, 11]. L’Europe du Sud contribue fortement à la diffusion de ces marqueurs de résistance (VIM-1 notamment) [11]. Ici également, les vecteurs de dissémination sont tantôt les souches elles-mêmes, tantôt les plasmides et les gènes, eux-mêmes étant le plus souvent associés à d’autres gènes de résistance aux antibiotiques (aux aminosides notamment) ou à des structures génétiques particulières, comme des intégrons. Cette organisation génétique explique la multirésistance des souches qui peuvent émerger sous l’effet d’une pression de sélection antibiotique variée. Les niveaux de résistance aux carbapénèmes sont en général élevés, notamment chez K. pneumoniae, mais ils peuvent varier (Tableau I). La β-lactamase NDM-1 est la métallo-β-lactamase la plus récemment décrite [22,
23] (voir Encadré). Identifiée en Inde, elle l’est également dans de nombreuses souches de K. pneumoniae et E. coli en Grande-Bretagne (D. Livermore, T. Walsh, données personnelles).
Une détection de ces métallo-β-lactamases peut être faite par une analyse phénotypique de résistance : elles confèrent une résistance à la plupart des β-lactamines sauf à l’aztréonam, et leur activité est inhibée par l’EDTA (bandelette E-test avec une carbapénème ± EDTA) [ 1]. Cette détection première est confirmée par des tests de détection moléculaire (IMP/VIM, etc.). La meilleure technique de screening des porteurs sains n’a pas été encore établie. Dans l’état actuel des connaissances, le milieu ESBL ID utilisé pour le screening des souches productrices de BLSE peut l’être aussi pour détecter ces métallo-β-lactamases car ces souches sont souvent, elles aussi, résistantes aux céphalosporines de troisième génération (propriété de la métallo-β-I actamase seule ou associée à une ESBL) (P. Nordmann, données personnelles).
|
P. aeruginosa est l’un des pathogènes majeurs responsables de pneumonies chez les patients immuno-déprimés [11]. Les patients neutropéniques et sous assistance respiratoire sont particulièrement à risque avec un taux de mortalité due à ces infections qui excède 30 %. P. aeruginosa présente une résistance naturelle élevée à de nombreuses β-lactamines due à l’association d’une imperméabilité naturelle de la membrane dix fois plus élevée que celle de E. coli et d’une céphalosporinase naturelle [
24]. P. aeruginosa est naturellement sensible à l’imipénème, au méropénème et au doripénème, mais naturellement résistant à l’ertapénème. La résistance aux carbapénèmes peut être le résultat de mécanismes assez différents qui sont éventuellement associés : imperméabilité de la membrane, surexpression de protéines d’efflux, expression de β-lactamases [24]. La modification ou la perte de la porine D2 est le principal mécanisme de résistance à l’imipénème [24,
25]. La surexpression du système d’efflux MexXY-OprN peut entraîner une diminution de sensibilité au méropénème associée à une diminution de sensibilité à l’imipénème par corégulation de l’expression de la porine OprD [24, 25,
39] (→).
(→) Voir l’article de François Barbier et Michel Wolff, page 960 de ce numéro
Au cours des dix dernières années, des carbapénèmases ont été largement décrites chez P. aeruginosa. Il s’agit de carbapénèmases dont l’activité est en partie inhibée par l’acide clavulanique, et de métallo-β-lactamases. Parmi les carbapénèmases inhibées par l’acide clavulanique, la β-lactamase plasmidique GES-2 - qui est une BLSE aux propriétés de carbapénèmase - avait été identifiée dans des souches épidémiques d’Afrique du Sud [4]. De même que chez K. pneumoniae, la β-lactamase KPC-2 a été identifiée en Amérique du Sud et dans les Caraïbes chez P. aeruginosa (Figure 1) [12]. Cette identification témoigne d’un franchissement de la barrière d’espèce de ces gènes de résistance. L’identification de souches produisant KPC-2 basée sur le seul phénotype de résistance aux carbapénèmes est impossible chez P. aeruginosa (Tableau I), et l’utilisation d’outils moléculaires est indispensable. Les carbapénèmases les plus fréquentes chez P. aeruginosa sont des métallo-β-lactamases. La biosynthèse de ces enzymes peut conduire à une résistance à l’imipénème, au méropénème, au doripénème mais également aux autres β-lactamines (uréidopénicillines, ceftazidime, céfépime, etc.) sauf à l’aztréonam. En pratique, ces souches sont souvent multirésistantes aux antibiotiques [1, 25]. La première métallo-β-lactamase identifiée chez P. aeruginosa l’avait été au Japon, il s’agissait d’IMP-1 [1]. La carbapénèmase VIM-1 fut tout d’abord identifiée en Italie chez P. aeruginosa, puis VIM-2 le fut en France. VIM-2 est, actuellement, la carbapénèmase la plus répandue chez P. aeruginosa dans le monde [1]. Ces carbapénèmases sont particulièrement prévalentes en Europe du Sud (Italie, Grèce), en Asie et en Amérique du Sud. D’autres métallo-β-lactamases ont été identifiées dans le monde, de nombreuses β-lactamases de type IMP, des variants VIM et les β-lactamases SPM-1, GIM-1 et AIM [1, 17, 19] (T. Walsh, données personnelles). Ces métallo-β-lactamases ont relativement peu d’identité entre elles (20-35 %), mais conservent des acides aminés communs expliquant qu’elles partagent la propriété d’hydrolyse des carbapénèmes [1]. De très nombreuses épidémies de souches de P. aeruginosa exprimant une carbapénèmase ont été rapportées [1]. Ces souches de P. aeruginosa ont été identifiées chez des patients atteints de mucoviscidose, mais très rarement. Leur distribution mondiale est variable avec des particularités géographiques comme, par exemple, celle de la β-lactamase SPM-1 en Amérique du Sud [1 , 22,
26]. Les gènes codant ces β-lactamases sont le plus souvent localisés dans des intégrons qui incluent de nombreux autres gènes de résistance, contribuant à la multirésistance des souches, voire à leur panrésistance. Le doripénème ne résiste pas mieux que le méropénème ou l’imipénème à l’activité hydrolytique de ces enzymes. On peut détecter ces carbapénèmases en utilisant des tests contenant de l’EDTA, chélateur des ions métalliques présents dans leur site actif. Cette détection est possible en l’absence de mécanismes de résistance associés. L’absence de détection contribue certainement à la diffusion de ces souches de P. aeruginosa multirésistantes. L’actualité la plus récente concernant la résistance aux carbapénèmes de P. aeruginosa est liée à la mise en évidence de variants de céphalosporinases de P. aerugi nosa, naturellement présents dans cette espèce et qui contribuent, en tout cas partiellement, à une résistance aux carbapé nèmes, notamment en association avec la modification de l’expression de la porine OprD [
27, 39] (→).
(→) Voir l’article de François Barbier et Michel Wolff, page 960 de ce numéro
|
A. baumannii est un pathogène quasi-exclusivement hospitalier. Il est à l’origine, en particulier, de pneumonies, d’infections sur cathéter et de septicémies chez les patients hospitalisés en réanimation et chez les patients immunodéprimés. La résistance multiple aux antibiotiques dans cette espèce n’a pas une définition consensuelle. Elle inclut habituellement la résistance à l’imipénème (ou au méropénème). A. baumannii est naturellement résistant à l’ertapénème. Les carbapénèmases chez A. baumannii ont maintenant été très bien décrites. Il s’agit rarement des β-lactamases inhibées par l’acide clavulanique (classe A de Ambler) ou de métallo-β-lactamases, mais le plus souvent d’oxacillinases aux propriétés de carbapénèmases [
28,
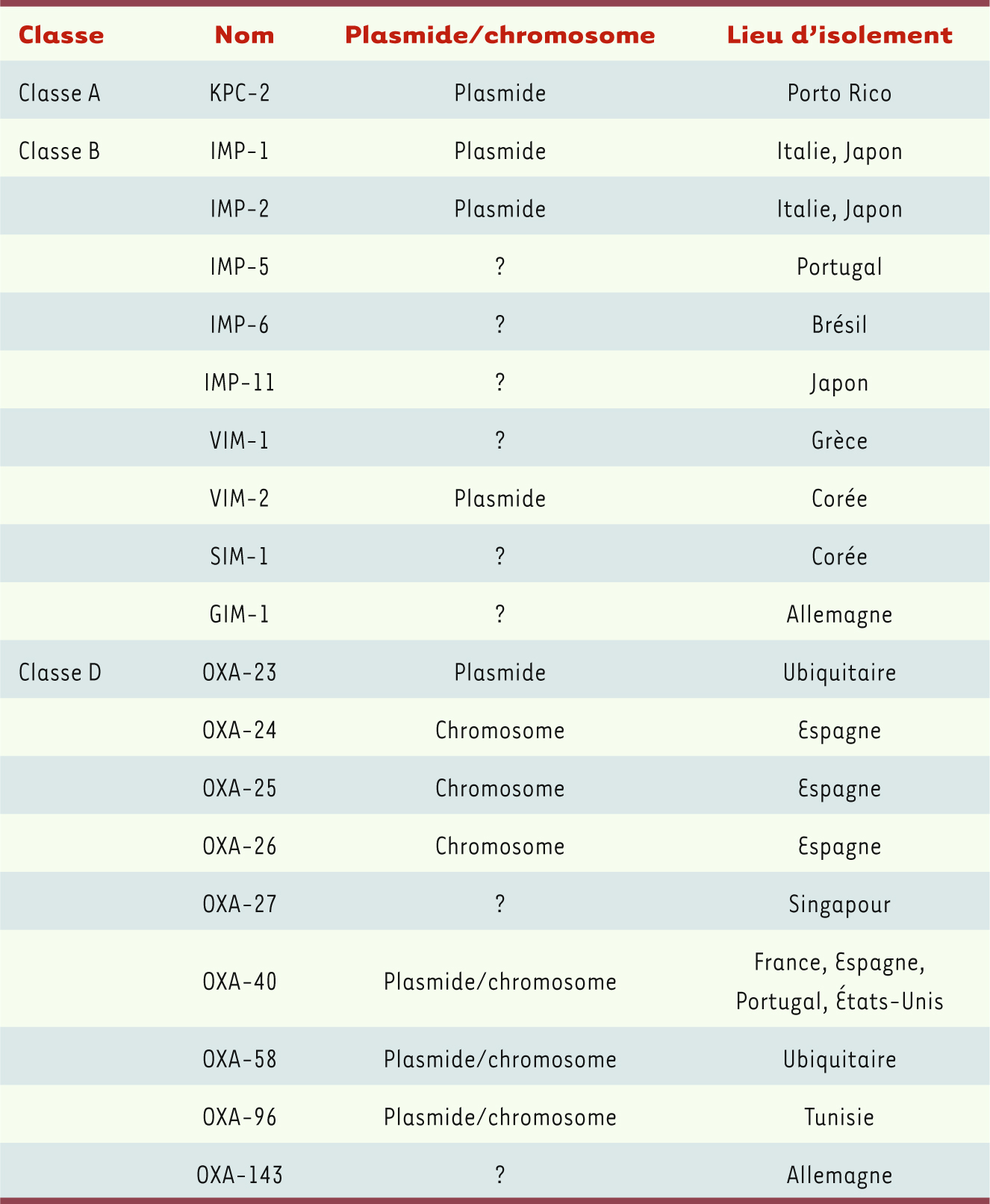
29]. Ces oxacillinases sont quasi-spécifiques à A. baumannii. KPC-2 vient d’être identifiée dans des isolats de A. baumannii de Porto Rico, ce qui souligne la diffusion interespèces de ce gène de β-lactamase parmi de multiples espèces de bacilles à Gram négatif. Sa détection est, comme chez P. aeruginosa, particulièrement difficile par une simple analyse de phénotype de résistance car KPC-2 hydrolyse toutes les β-lactamines et son expression chez A. baumannii contribue à la multirésistance observée (Tableau I). Une faible synergie entre l’acide clavulanique et une céphalosporine, ou une carbapénème, est donc difficile - voire impossible - à mettre en évidence. Une BLSE de type GES, GES-11, vient d’être également identifiée chez A. baumannii. Cette enzyme confère un faible degré de résistance également aux carbapénèmes. Cinq groupes de carbapénèmases de classe B ont été identifiés chez A. baumannii et ce dans de nombreux pays (Tableau II). Il s’agit de variants de types IMP, VIM, SIM, GIM. Ces enzymes hydrolysent toutes les β-lactamines sauf l’aztréonam. Leur mise en évidence en microbiologie clinique peut être basée, comme chez P. aeruginosa et les entérobactéries, sur la comparaison des CMI des carbapénèmes, en présence ou en l’absence d’EDTA. Le support génétique des gènes codant ces enzymes n’est pas différent de celui décrit dans les autres espèces de bacilles à Gram négatif : des intégrons de classe l en association avec des gènes codant pour des protéines qui modifient les aminosides et des plasmides relativement spécifiques.  | Tableau II
Carbapénèmases acquises chez A. baumannii.
|
La résistance aux carbapénèmes est expliquée, en grande partie, par des oxacillinases aux propriétés de carbapénèmases spécifiques à Acinetobacter spp. [29]. L’activité d’hydrolyse des carbapénèmes qu’exercent ces oxacillinases est plus faible que celle des métallo-β-lactamases. Ces oxacillinases n’hydrolysent pas les céphalosporines de troisième génération. Il s’agit des β-lactamases de types OXA-23, OXA-40, OXA-58 et OXA-143 [29,
30]. Leur détection phénotypique en microbiologie est impossible car leur activité n’est inhibée ni par l’acide clavulanique, ni par l’EDTA. La plupart des gènes codant ces β-lactamases sont plasmidiques, ce qui assurerait leur bonne diffusion. À noter que dans certains cas, la surexpression des oxacillinases naturelles de A. baumannii (de type OXA-51) peut contribuer à la résistance aux carbapénèmes [28,
31]. De nombreuses études font état de l’augmentation progressive de la résistance aux carbapénèmes dans cette espèce bactérienne [2, 31,
32]. Le rôle de la porine CarO et celui d’une autre protéine de 43kDa (OprD-like) ont été démontrés dans la résistance à l’imipénème [28,
33]. En revanche, l’importance de la modification de ces porines dans la résistance phénotypique aux carbapénèmes reste à préciser. Il en est de même du rôle additif d’un des systèmes d’efflux naturellement présent chez A. baumannii, le système AdeABC, dont la surexpression, associée à la présence de certaines oxacillinases, pourrait être source de résistance aux carbapénèmes [33]. |
La prévalence de la résistance aux carbapénèmes croît dans le monde entier dans toutes les espèces de bacilles à Gram négatif cliniquement importantes [32]. Chez les entérobactéries, la résistance résulte essentiellement de β-lactamases de type KPC, de métallo-β-lactamases et d’OXA-48. Chez P. aeruginosa, les métallo-carbapénèmases et la modification isolée de la porine OprD sont les mécanismes principaux de résistance aux carbapénèmes, alors que chez A. baumannii, certaines oxacillinases quasi-spécifiques d’espèces contribuent fortement à la résistance aux carbapénèmes. Dans tous les cas, la résistance aux carbapénèmes reste très majoritairement le fait de souches nosocomiales à fort potentiel épidémique. Les facteurs qui favorisent l’émergence de ces déterminants de résistance n’ont pas été identifiés. Dans toutes ces espèces bactériennes, ces déterminants sont le plus souvent associés à des résistances à d’autres familles d’antibiotiques et présents dans des souches multirésistantes aux antibiotiques. Une fois établie, cette multirésistance ne régresse pas spontanément. Il est donc important de dépister et de contrôler les porteurs sains comme les malades infectés par ces souches afin de limiter au maximum leur dissémination incontrôlée. À cet égard, l’émergence récente de souches communautaires d’E. coli qui expriment une BLSE de type CTX-M ne peut être qu’un facteur favorisant les antibiothérapies qui comportent des carbapénèmes, ce qui induirait par la suite la sélection des souches résistantes aux carbapénèmes. L’analyse du support génétique de ces résistances aux carbapénèmes souligne la diversité des gènes et des mécanismes de résistance sousjacents. Cependant, certains déterminants sont communs aux entérobactéries, à P. aeruginosa et A. baumannii. C’est le cas des métallo-β-lactamases et des carbapénèmases de type KPC. Il n’y a pas de barrières d’espèce qui limitent la dissémination de la plupart des déterminants de résistance aux carbapénèmes (sauf les oxacillinases chez A. baumannii). Ces déterminants peuvent donc librement diffuser à la faveur de traitements antibiotiques qui les sélectionnent, ne se limitant pas à provoquer la résistance aux carbapénèmes. En effet, la plupart des carbapénèmases confèrent une résistance à de très nombreuses autres β-lactamines et leurs gènes sont habituellement physiquement associés à des gènes de résistance aux aminosides dans des souches souvent résistantes aux fluoroquinolones. Le contrôle du réservoir de souches résistantes aux carbapénèmes est donc désormais un objectif majeur de santé publique afin, notamment, d’assurer aux traitements probabilistes9 une forte probabilité de succès. Dans certains pays, notamment ceux de l’Europe du Sud, cette probabilité de succès est devenue déjà virtuelle. La mise au point des tests moléculaires rapides permettant la détection des souches productrices de carbapénèmases contribuerait à éviter leur dissémination nosocomiale. De même, la recherche systématique des porteurs sains de souches productrices de carbapénèmases devra être mise en place en dépistant tout patient transféré d’un hôpital étranger afin de limiter l’introduction, puis la diffusion, de ces souches dans tout système de soins. Compte tenu de l’absence de développement de nouvelles molécules actives contre les bactéries à Gram négatif dans les prochaines années, ceci devient impératif. Une diffusion communautaire de ces résistances aux carbapénèmes rendrait le contrôle de ces souches impossible. Le niveau de résistance aux carbapénèmes, notamment chez les entérobactéries, peut être considéré, désormais, comme un indice de la qualité des soins avec une corrélation positive entre taux de prévalence d’infections nosocomiales et multirésistance aux antibiotiques. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Walsh TR, Toleman MA, Poirel L, Nordmann P. Metallo-β-lactamases: the quiet before the storm? Clin Microbiol Rev 2005 ; 18 : 306-25. 2. Giamarellou H, Poulakou G. Multidrug-resistant Gram-negative infections: what are the treatment options? Drugs 2009 ; 69 : 1879-901. 3. Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumonia carbapenemase-producing bacteria. Lancet Infect Dis 2009 ; 9 : 228-36. 4. Poirel L, Pitout JD, Nordmann P. Carbapenemases: molecular diversity and clinical consequences. Future Microbiol 2007 ; 2 : 501-12. 5. Queenan AM, Bush K. Carbapenemases: the versatile β-lactamases. Clin Microbiol Rev 2007 ; 20 : 440-58. 6. Rossolini GM, Mantengoli E, Docquier JD, et al. Epidemiology of infections caused by multiresistant gram-negatives: ESBL, MBL, panresistant strains. New Microbiol 2007 ; 30 : 332-9. 7. Martinez-Martinez L. Extended-spectrum beta-lactamases and the permeability barrier. Clin Microbiol Infect 2008 ; 14 (Suppl 1) : 82-9. 8. Doumith M, Ellington MJ, Livermore DM, Woodford N. Molecular mechanisms disrupting porin expression in ertapenem-resistant Klebsiella and Enterobacter spp. clinical isolates from the UK. J Antimicrob Chemother 2009 ; 63 : 659-67. 9. Lee K, Yong D, Choi YS, et al. Reduced imipenem susceptibility in Klebsiella pneumoniae clinical isolates with plasmid-mediated CMY-2 and DHA-1 β-lactamases co-mediated by porin loss. Int J Antimicrob Agents 2007 ; 29 : 201-6. 10. Lartigue MF, Poirel L, Poyart C, et al. Ertapenem resistance of Escherichia coli. Emerg Infect Dis 2007 ; 13 : 315-7. 11. Carmeli Y, Akova M, Cornaglia G, et al. Controlling the spread of carbapenemase-producing Gram-negatives: therapeutic approach and infection control. Clin Microbiol Infect 2010 ; 16 : 102-11. 12. Schwaber MJ, Klarfeld-Lidji S, Navon-Venezia S, et al. Predictors of carbapenem-resistant Klebsiella pneumoniae acquisition among hospitalized adults and effect of acquisition on mortality. Antimicrob Agents Chemother 2008 ; 52 : 1028-33. 13. Miriagou V, Cornaglia G, Edelstein M, et al. Acquired carbapenemases in Gram-negative bacterial pathogens: detection and surveillance issues. Clin Microbiol Infect 2010 ; 16 : 112-22. 14. Samra Z, Bahar J, Madar-Shapiro L, et al. Evaluation of CHROMagar KPC for rapid detection of carbapenem-resistant Enterobacteriaceae. J Clin Microbiol 2008 ; 46 : 3110-1. 15. Carrër A, Poirel L, Yilmaz M, et al. Emerging spread of OXA-48-encoding plasmid from Turkey and beyond. Antimicrob Agents Chemother 2010 ; 54 :1369-73. 16. Gülmez D, Woodford N, Palepou MF, et al. Carbapenem-resistant Escherichia coli and Klebsiella pneumoniae isolates from Turkey with OXA-48-like carbapenemases and outer membrane protein loss. Int J Antimicrob Agents 2008 ; 31 : 523-6. 17. Uzun O, Hascelik G, Livermore DM. Carbapenem-resistant Escherichia coli and Klebsiella pneumoniae isolates from Turkey with OXA-48-like carbapenemases and outer membrane protein loss. Int J Antimicrob Agents 2008 ; 31 : 523-6. 18. Poirel L, Héritier C, Nordmann P. Chromosome-encoded ambler class D β-lactamase of Shewanella oneidensis as a progenitor of carbapenem-hydrolyzing oxacillinase. Antimicrob Agents Chemother 2004 ; 48 : 348-51. 19. Walsh TR. Clinically significant carbapenemases: an update. Curr Opin Infect Dis 2008 ; 21 : 367-71. 20. Lartigue MF, Poirel L, Nordmann P. First detection of a carbapenem-hydrolyzing metalloenzyme in an Enterobacteriaceae isolate in France. Antimicrob Agents Chemother 2004 ; 48 : 4929-30. 21. Rodriguez-Martinez JM, Nordmann P, Fortineau N, Poirel L. VIM-19, a metallo-β-lactamase with increased carbapenemase activity from Escherichia coli and Klebsiella pneumoniae. Antimicrob Agents Chemother 2010 ; 54 : 471-6. 22. Yong D, Toleman MA, Giske CG, et al. Characterization of a new metallo-β-lactamase gene, b/a(NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India. Antimicrob Agents Chemother 2009 ; 53 : 5046-54. 23. Kumarasamy KK, Toleman MA, Walsh TR, et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis 2010 ; 10 : 597-602. 24. Strateva T, Yordanov D. Pseudomonas aeruginosa - a phenomenon of bacterial resistance. J Med Microbiol 2009 ; 58 : 1133-48. 25. Mesaros N, Nordmann P, Plésiat P, et al. Pseudomonas aeruginosa: resistance and therapeutic options at the turn of the new millennium. Clin Microbiol Infect 2007 ; 13 : 560-78. 26. Toleman MA, Simm AM, Murphy TA, et al. Molecular characterization of SPM-1, a novel metallo-β-lactamase isolated in Latin America: report from the SENTRY antimicrobial surveillance programme. J Antimicrob Chemother 2002 ; 50 : 673-9. 27. Rodriguez-Martinez JM, Poirel L, Nordmann P. Molecular epidemiology and mechanisms of carbapenem resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother 2009 ; 53 : 4783-8. 28. Nordmann P, Poirel L. Acinetobacter baumannii: Basic and emerging mechanisms of resistance. Eur Infect Dis 2009 ; 2 : 94-7. 29. Poirel L, Naas T, Nordmann P. Diversity, epidemiology, and genetics of class D β-lactamases. Antimicrob Agents Chemother 2010 ; 54 : 24-38. 30. Higgins PG, Poirel L, Lehmann M, et al. OXA-143, a novel carbapenem-hydrolyzing class D β-lactamase in Acinetobacter baumannii. Antimicrob Agents Chemother 2009 ; 53 : 5035-8. 31. Towner KJ. Acinetobacter : an old friend, but a new enemy. J Hosp Infect 2009 ; 73 : 355-63. 32. Thomson JM, Bonomo RA. The threat of antibiotic resistance in Gram- negative pathogenic bacteria: β-lactams in peril! Curr Opin Microbiol 2005 ; 8 : 518-24. 33. Perez F, Hujer AM, Hujer KM, et al. Global challenge of multidrug-resistant Acinetobacter baumannii. Antimicrob Agents Chemother 2007 ; 51 : 3471-84. 34. Desphande P, Rodrigues C, Shetty A, et al. New Delhi metallo β-lactamase (NDM-1) in Enterobacteriaceae; treatment options with carbapenems compromised. J Assoc Physicians India 2010 ; 58 ; 1-6. 35. Karthikeyan K, Thirunarayan MA, Krishnan P. Coexistence of blaOXA-23 with blaNDM-1 and armA in clinical isolates of Acinetobacter baumannii from India. J Antimicrob Chemother 2010 ; 65 : 2253-4. 36. Poirel L, Lagrutta E, Taylor P, et al. Emergence of metallo-β-lactamase NDM-1-producing multidrug resistant Escherichia coli in Australia. Antimicrob Agents Chemother 2010 ; 54 : 4914-6. 37. Zahar JR, Bille E, Schnell D, et al. Diffusion communautaire des entérobactéries sécrétrices de P-lactamase à spectre élargi (EBLSE). Med Sci (Paris) 2009 ; 25 : 939-44. 38. Pagès JM. Porines bactériennes et sensibilité aux antibiotiques. Med Sci (Paris) 2004 ; 20 : 346-51. 39. Barbier F, Wolff M. Multirésistance chez Pseudomonas aeruginosa. Vers l’impasse thérapeutique ? MedSci (Paris) 2010 ; 26 : 960-8. |