C’était prévisible : fin 2009, nous avons rapporté les résultats de la complémentation d’embryons tétraploïdes murins par des cellules iPS murines (induced pluripotent stem cells) [ 1] ; un an après, une équipe japonaise confirme dans un article de Cell [ 2] le potentiel fascinant des iPS [ 3], en démontrant qu’elles sont capables de façonner un organe entier (pancréas) in vivo après leur implantation dans des blastocystes hôtes non seulement dépourvus d’un gène maître de l’organogenèse pancréatique, mais également xénogéniques. Les premiers balbutiements de la technique de complémentation du blastocyste datent des années 1970, mais, hormis la chimère geep entre le mouton et la chèvre, les succès de chimères interespèces sont rares. Dans ces expériences, il est possible que la présence de cellules xénogéniques contribuant aux annexes placentaires ait été délétère pour l’implantation utérine ou le développement embryonnaire.
En 1993, l’équipe de F. Alt avait montré que des cellules ES pluripotentes (embryonic stem cells) de souris normales, lorsqu’elles sont injectées dans des blastocystes de souris rag−/− (déficientes en une enzyme indispensable à la recombinaison des gènes d’immunoglobulines, et donc dépourvues de lymphocytes T et B), restauraient chez le receveur rag−/− des lignées lymphoïdes et une immunité normales [ 4]. Plus tard, d’autres auteurs ont également décrit la correction de défauts de certains organes (cœur) par complémentation blastocytaire via des cellules ES [ 5]. La complémentation de blastocystes dont il est question dans l’article de T. Kobayashi et al. [2] va au-delà de la correction d’un lignage spécifique, et aboutit bel et bien à produire un organe entier. Les blastocystes murins receveurs sont déficients en un gène maître de l’organogenèse pancréatique, pdx1, et lorsqu’ils sont transférés dans l’utérus de souris femelles, entraînent la formation de souriceaux sans pancréas qui meurent à la naissance. L’organogenèse pancréatique se façonne grâce à des inductions entre tissus originaires de différents feuillets embryonnaires, notamment entre l’ébauche prépancréatique endodermique et le mésenchyme. Mais si l’ébauche pancréatique ne peut pas se former chez les embryons pdx1−/− , en revanche le pouvoir inductif du mésenchyme est intact de même que la niche mésodermique, vide chez les animaux pdx1−/− , mais qui conserve la capacité de guider la spécification de cellules ES ou iPS pdx1+/+ avec lesquelles elles entreraient en contact. De fait, des iPS ou des ES murines (avec une étiquette GFP) pdx1+/+ injectées dans des blastocystes pdx1−/− ensuite transférés dans l’utérus de souris femelles pseudogestantes contribuent à la formation d’embryons viables (25 %-40 %). Chez ces derniers, tous les tissus sont chimériques (taux avoisinant 50 %) sauf le placenta, ce qui était attendu. Plus important, ces souris chimériques ont développé un pancréas complet fonctionnel dont les structures endocrine et exocrine, normales, sont exclusivement d’origine donneur (ES ou iPS pdx1 +/+ ) alors que l’environnement stromal est chimérique. Les îlots β pancréatiques issus de ces iPS ont pu être greffés avec succès à des receveurs diabétiques, confirmant ce qu’avait démontré la complémentation des embryons tétraploïdes, la capacité des iPS à former un organe entier in vivo [1].
La même démarche a ensuite été appliquée en situation xénogénique : des cellules iPS et ES de rat et de souris ont été greffées (10 à 15 cellules par blastocyste) dans des blastocystes de l’autre espèce, souris ou rat respectivement, donc en conditions interespèces. L’efficacité du développement d’embryons viables et le taux de chimérisme (en moyenne 20 %-25 %) étaient inférieurs à ceux obtenus quand le donneur et l’hôte étaient de la même espèce (> 50 %). Manifestement, les blastocystes hôtes ne toléraient que de très petits nombres de cellules xénogéniques. Comme dans le cas des greffes de la même espèce, le chimérisme concernait tous les tissus, à l’exception notable, ici, des cellules germinales et des annexes placentaires, et 20 % des embryons viables atteignaient l’âge adulte. Incidemment, la taille de la chimère est conforme à celle de l’espèce du blastocyste hôte, l’explication se trouvant probablement dans le fait que les annexes placentaires (et l’environnement utérin) vraisemblablement déterminantes pour ce paramètre de taille, ont une origine hôte. Enfin, des cellules d’une lignée iPS de rat, sélectionnée parmi 11, furent injectées dans des blastocystes (n = 139) de souris pdx1−/− . Trente-quatre souriceaux viables furent obtenus, dont le pancréas était d’origine donneur (iPS de rat). Peu d’animaux ont atteint l’âge adulte, mais la réponse de ceux-ci à une charge en glucose était appropriée, validant la fonctionnalité du pancréas xénogénique et démontrant que des iPS de rat sont capables de complémenter un défaut génétique chez la souris. So what now au-delà de l’exploit technique remarquable ? Hormis une spéculation un peu facile sur les chimères hommes-porcs, cette expérience pose des questions intéressantes de biologie du développement : la taille de la chimère, mais surtout l’organogenèse, indiquent des capacités de régulations morphogénétiques par le blastocyste hôte. Par exemple, la vésicule biliaire, normalement absente chez le rat mais présente chez la souris, existe dans les chimères où le blastocyste hôte est souris. On peut aussi rêver a cette occasion d’un débat serein sur l’intérêt, mais aussi les limites [ 6], que l’on pose à de telles démarches expérimentales si elles venaient à être envisagées avec des cellules humaines ; cette question se posera forcément, notamment pour tester la réalité du potentiel pluripotent des iPS humaines.
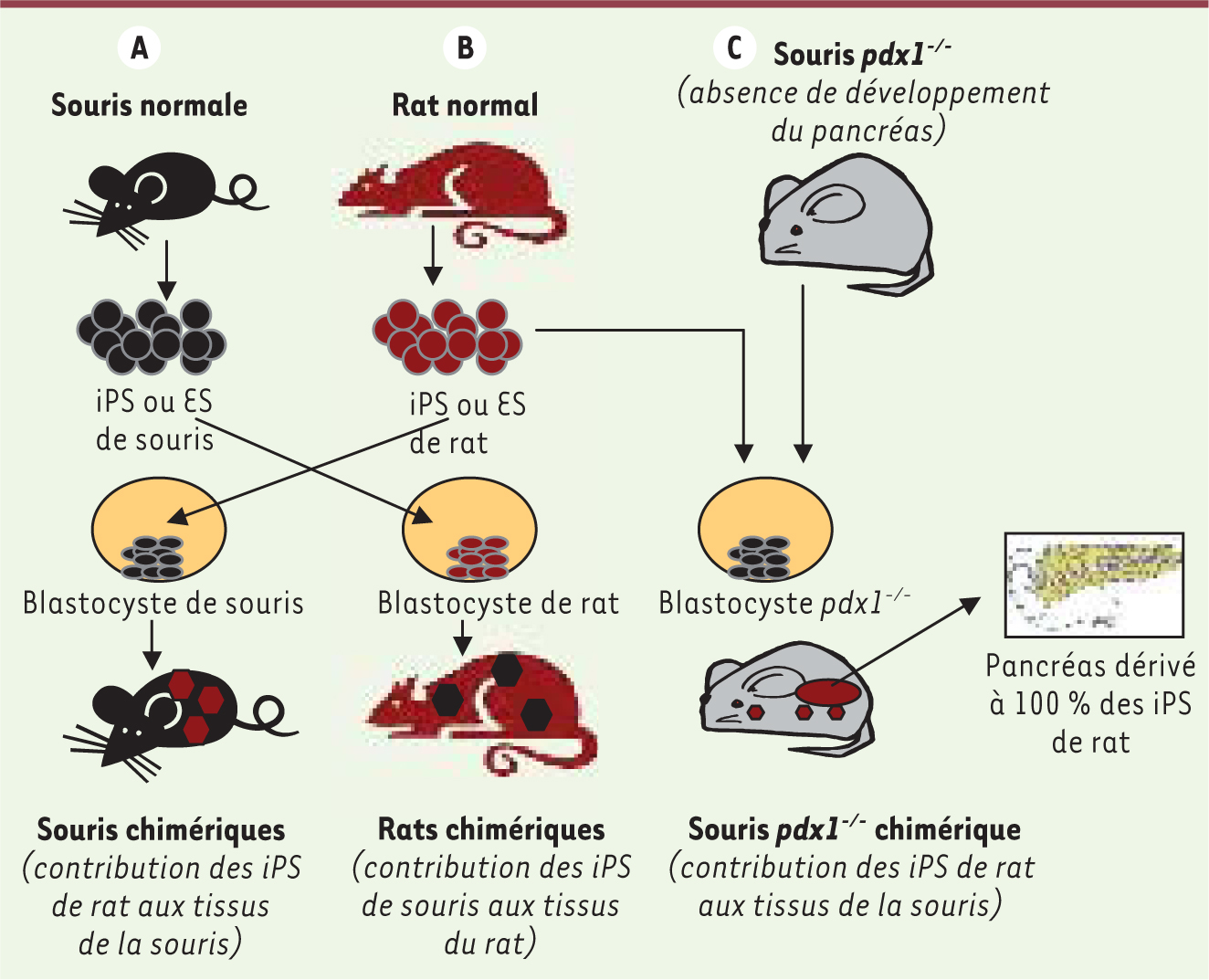
| Figure 1
Construction de chimères interespèces à partir d’induced pluripotent stem cells. A. Les cellules iPS dérivées de fibroblastes de souris normales sont injectées dans des blastocystes issus de rattes. Ces blastocytes « chimères xénogéniques » sont transférés dans l’utérus de femelles rattes pseudogestantes, et certains se développeront et aboutiront à la naissance de ratons dont tous les tissus contiennent un contingent de cellules issues des iPS de souris, y compris la lignée germinale (à l’exception des annexes placentaires). B. La même procédure est réalisée à partir d’iPS dérivées de rat, mais cette fois injectées dans des blastocystes de souris. Le transfert de ces blastocystes dans des femelles souris aboutit à la naissance de souriceaux dont tous les tissus contiennent un contingent de cellules issues des iPS de rat, y compris la lignée germinale. C. Les iPS de rat sont injectées dans des blastocystes de souris invalidées pour pdx1, le gène maître du développement pancréatique. Les blastocystes « chimères » sont transférés dans l’utérus de souris pdx1−/−
pseudogestantes. Les tissus des nouveau-nés sont chimériques comme en (A), mais surtout il y a formation d’un pancréas fonctionnel entièrement dérivé des cellules iPS de rat. |