En août 2006, l’équipe de S. Yamanaka publiait dans la revue Cell la possibilité de reprogrammer in vitro un fibroblaste murin pour lui conférer les propriétés d’une cellule souche embryonnaire pluripotente (ES) par la simple surexpression de 4 gènes (Oct3/4, Sox2, Klf4 et c-Myc) [ 1, 11]. Cet exploit fut renouvelé un an plus tard en produisant des iPS (induced pluripotent stem cells) à partir de cellules humaines, ouvrant une nouvelle voie à la médecine régénératrice avec un espoir thérapeutique considérable [ 12]. En effet, dérivées du patient, ces cellules écartent tout risque de rejet de greffe. Une période de doutes mêlée de scepticisme succéda à cette phase d’euphorie, pendant laquelle les iPS furent présentées comme de pâles copies des cellules ES avec des capacités de différenciation différentes [ 2– 5]. L’idée que les iPS pouvaient avoir conservé des traces épigénétiques de leur vie antérieure avait germé dans les esprits.
Trois études majeures publiées cet été dans les revues Nature, Nature Biotechnology et Cell Stem Cell ont tenté d’y apporter une réponse convaincante. Le groupe de K. Hochedlinger [ 6] a comparé des i PS issues de trois types cellulaires distincts, dérivés des trois feuillets embryonnaires, prélevés sur des souris chimères obtenues par injection d’iPS dans un blastocyste. Après avoir révélé que ces iPS « secondaires » (donc génétiquement identiques aux iPS primaires contribuant aux chimères) n’avaient pas totalement éteint certains gènes caractéristiques de leur type cellulaire d’origine, les auteurs démontrent clairement que les transcriptomes des iPS produites à partir de différents tissus des chimères se regroupent systématiquement selon leur tissu d’origine et non pas en fonction de la chimère d’origine [6]. Ils démontrent également que ces iPS se différencient de manière préférentielle dans la voie de leur feuillet d’origine [ 7], ce qui suggère la présence d’une mémoire épigénétique qui n’aurait pas été totalement effacée par la reprogrammation.
L’équipe de G.Q. Daley [7] recherche ces traces de leur passé dans le niveau de méthylation de l’ADN qui régule, en accord avec les marques spécifiques d’histone, l’activité transcriptionnelle d’une majorité de promoteurs. Les auteurs comparent des iPS produites à partir de souris de même fond génétique et les cellules ES dérivées d’embryons obtenus par transfert nucléaire ou par fécondation naturelle et prélevés in utero, et arrivent à la même conclusion : les iPS se redifférencient préférentiellement vers leur tissu d’origine. Ils notent alors que la différenciation des iPS est, d’une façon générale, moins efficace que celle des ES, et effectuent alors une cartographie à grande échelle des régions différentiellement méthylées (DMR) établissant pour la première fois le lien entre un défaut de méthylation/déméthylation, le tissu d’origine et les altérations de la différenciation [7, 8].
La troisième étude émane des groupes de R. Jaenish et R.A. Young. Ces auteurs ont ré-analysé des transcriptomes et les marques répressives/activatrices portées par les histones des cellules à l’état pluripotent (ES ou iPS) au niveau des promoteurs géniques [ 9, 10], en utilisant de nouveaux algorithmes. Ils n’identifient que des différences minimes entre un large panel d’ES et d’iPS humaines provenant de différents laboratoires, qui ne permettent pas de faire une distinction nette entre ES et iPS. Bien que ces résultats ne préjugent pas de ce qu’il advient au cours de la différenciation, qui n’a pas été analysée dans ce travail, ils n’excluent pas cependant que certains mécanismes de mémoire épigénétique chez l’homme pourraient être plus subtils et nécessiter des analyses plus approfondies dans le futur.
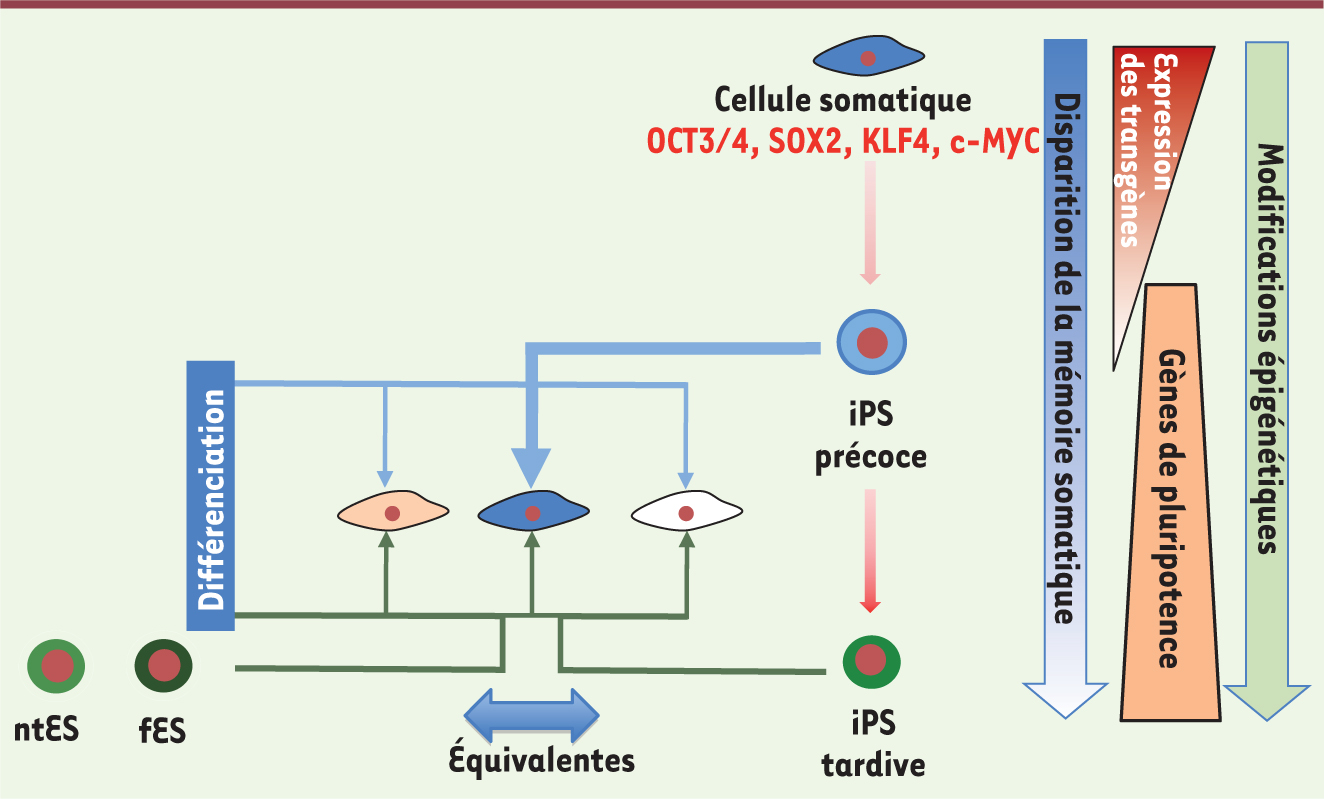
Un certain nombre d’agents modifiant le programme épigénétique sont susceptibles d’aider à effacer cette mémoire. L’utilisation de 5-azacytidine, agent déméthylant le génome, augmente l’efficacité de différenciation des iPS produites, mimant ainsi la déméthylation active subie par le noyau pendant les premières divisions de l’embryon lors d’un transfert nucléaire [7]. Il semblerait également qu’une reprogrammation dite tertiaire [7], à partir d’iPS secondaires différenciées dans une voie déterminée puis reprogrammées à leur tour, permette d’effacer cet engagement préférentiel dans une voie donnée de différenciation. Mais les auteurs offrent tout de même un espoir moins artificiel, puisqu’ils s’accordent sur le fait qu’au cours des passages successifs en culture, le regroupement des cellules iPS au niveau transcriptionnel ou épigénétique n’est plus aussi évident et « leur passé » s’efface avec le temps (Figure 1) [7]. Effacer le souvenir d’une vie antérieure serait donc possible, si tant est que l’on ait trouvé toutes les clefs qui permettent de décrypter l’épigénome de la cellule embryonnaire, véritable chef d’orchestre de cette plasticité du destin cellulaire. Cependant, ces efforts sont essentiels si l’on ne veut pas que cette fabuleuse découverte des iPS ne se transforme en boîte de Pandore.
| Figure 1
Mémoire épigénétique de cellules iPS. À la suite d’une première phase de reprogrammation induite par les facteurs de reprogrammation, les cellules IPS produites présentent transitoirement une pluripotence partielle (iPS précoce). À ce stade, malgré l’expression de gènes de pluripotence et l’extinction des transgènes utilisés pour la reprogrammation, la différenciation de telles iPS sera dirigée préférentiellement vers la lignée somatique de départ (cellule bleu foncé) sous l’effet d’une mémoire épigénétique persistante. Une seconde phase de reprogrammation induite par les passages successifs en culture aboutit à des cellules iPS pluripotentes, capables de se différencier dans n’importe quelle voie de manière équivalente (iPS tardive, traits verts). Ces cellules ont alors perdu la mémoire épigénétique de leur vie antérieure et ne peuvent plus être distinguées des cellules souches embryonnaires dérivées de blastocystes obtenus après fécondation (fES) ou transfert nucléaire (ntES). |