| |
| Med Sci (Paris). 2010 October; 26(10): 875–880. Published online 2010 October 15. doi: 10.1051/medsci/20102610875.Âge et stress oxydant Vers un déséquilibre irréversible de l’homéostasie endothéliale Nathalie Thorin-Trescases,1 Guillaume Voghel,1 Nada Farhat,1 Annick Drouin,1 Marie-Ève Gendron,1 and Éric Thorin1* 1Université de Montréal, Département de chirurgie, Institut de cardiologie de Montréal, centre de recherche, 5000, rue Bélanger est, Montréal (Québec) H1T 1C8, Canada |
L’implication des radicaux libres et du stress oxydant dans le vieillissement a été proposée il y plus de 50 ans [
1]. Il a été amplement décrit qu’avec l’âge, le stress oxydant - défini comme un déséquilibre entre les sources oxydantes et les anti-oxydants, en défaveur de ces derniers - induit des dommages moléculaires aux lipides, aux protéines et aux acides nucléiques dans différents tissus de diverses espèces [
2]. Plus d’une douzaine de mécanismes de réparation de ces dommages et de maintien de l’homéostasie ont été répertoriés [
3]. Ceux-ci sont continuellement activés au cours de la vie et permettent une adaptation temporaire face aux agressions multiples. C’est le principe d’hormesis, terme employé en toxicologie qui s’applique quand un agent procure des effets bénéfiques à faibles doses et des effets toxiques à hautes doses [
4]. En biologie, l’hormesis se définit comme une réponse adaptative des cellules ou d’un organisme à un stress modéré : celuici induit des mécanismes cellulaires qui protègent les cellules contre un stress ultérieur [
5]. La longévité est ainsi strictement corrélée à l’efficacité de ces mécanismes réparateurs. Le vieillissement, la sénescence et finalement la mort, résultent de l’inefficacité à maintenir l’homéostasie cellulaire et à réparer les dommages. Les cellules endothéliales sont très sensibles au stress oxydant et leur dysfonction est une caractéristique du vieillissement vasculaire [
6]. Toutefois, en accord avec le principe d’hormesis, une exposition précoce des cellules endothéliales, durant leur phase de maturation, à de faibles concentrations de radicaux libres, devrait augmenter leur longévité vasculaire. |
Définition du vieillissement Le vieillissement est caractérisé par un déclin graduel des fonctions biologiques causé par un dysfonctionnement progressif des différents systèmes cellulaires de réparation et de maintien de l’homéostasie. En conséquence, des dommages irréversibles s’accumulent dans les lipides, protéines et acides nucléiques [3,
7]. Ce concept général s’applique aussi au système vasculaire et aux cellules endothéliales [6,
8]. Il n’existe toutefois aucune théorie capable d’expliquer les causes et les mécanismes de toutes les facettes du vieillissement. Néanmoins, la plus populaire est celle « des radicaux libres » ou « du stress oxydant » [8] conçue par D. Harman [1]. Elle stipule que des substances réactives oxygénées (ROS) provoquent le vieillissement en endommageant l’ADN et en oxydant les protéines et les lipides [
9]. Les principaux radicaux libres sont l’anion superoxyde (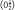 ), le radical hydroxyle ( ), le radical hydroxyle (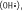 ), le peroxyde d’hydrogène (H2O2, qui n’est pas en soi un composé radicalaire), le monoxyde d’azote (NO) et le peroxynitrite (ONOO−). Divers systèmes enzymatiques produisent des ROS dans les vaisseaux. Les principaux sont le cytochrome P450, les cyclo-oxygénases, les lipo-oxygénases, les NOS (NO synthases), ainsi que la xanthine oxydase et la NADPH oxydase [
10]. Ces deux dernières enzymes sont d’ailleurs retrouvées dans l’endothélium vasculaire, lui-même une source importante de ROS. Les nombreuses sources potentielles de ROS exogènes comprennent les radiations, les infections pathogènes, les herbicides/insecticides, les toxines, les UV et la fumée de cigarette [8]. ), le peroxyde d’hydrogène (H2O2, qui n’est pas en soi un composé radicalaire), le monoxyde d’azote (NO) et le peroxynitrite (ONOO−). Divers systèmes enzymatiques produisent des ROS dans les vaisseaux. Les principaux sont le cytochrome P450, les cyclo-oxygénases, les lipo-oxygénases, les NOS (NO synthases), ainsi que la xanthine oxydase et la NADPH oxydase [
10]. Ces deux dernières enzymes sont d’ailleurs retrouvées dans l’endothélium vasculaire, lui-même une source importante de ROS. Les nombreuses sources potentielles de ROS exogènes comprennent les radiations, les infections pathogènes, les herbicides/insecticides, les toxines, les UV et la fumée de cigarette [8]. Tous les facteurs de risque cardiovasculaires sont associés à une augmentation du stress oxydant. Par exemple, les ROS participent à la modification fonctionnelle de plusieurs protéines, à l’oxydation des LDL (light density lipoproteins), à des changements de perméabilité membranaire, à des dommages moléculaires (ADN, lipides, protéines), à la dysfonction endothéliale, toutes conditions qui prédisposent à l’athérogenèse. De ce fait, les dommages moléculaires induits par le stress oxydant sont souvent utilisés comme biomarqueurs du vieillissement. Les mécanismes enzymatiques anti-oxydants de maintien cellulaire comprennent la SOD (superoxyde dismutase) qui catalyse la dismutation de l’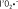 en H2O2, la catalase (qui dégrade le H2O2 en eau et oxygène) et la GPx (glutathion peroxydase) qui dégrade le H2O2 en eau. La GPx est la principale défense anti-oxydante dans les cellules endothéliales. Les anti-oxydants endogènes non enzymatiques incluent les vitamines C et E, le glutathion, les caroténoïdes et les flavonoïdes. Selon Bokov et al. [2], pour que la théorie d’une responsabilité des radicaux libres dans le vieillissement soit validée, trois critères doivent être respectés : (1) les dommages moléculaires causés par le stress oxydant doivent s’accumuler avec l’âge ; (2) les manipulations diététiques, pharmacologiques ou génétiques augmentant la longévité doivent en parallèle diminuer les dommages moléculaires ; (3) les manipulations diminuant le niveau de stress oxydant doivent en parallèle allonger la durée de vie. De nombreuses études ont confirmé le premier critère [
11]. De même, l’augmentation de la longévité par restriction calorique chez la souris [
12] ou par manipulation génétique chez un invertébré [2] réduit les dommages moléculaires associés au stress oxydant. En revanche, la plupart des essais cliniques n’ont démontré aucun effet bénéfique des anti-oxydants (α-tocophérol, vitamines C et/ou E) sur la morbidité et la mortalité associées aux maladies cardiovasculaires [
13]. De plus, l’administration de différents anti-oxydants chez la souris ou les invertébrés n’a pas augmenté leur longévité [2]. De même, la surexpression des gènes codant pour des enzymes anti-oxydantes (Cu/Zn SOD, catalase) chez des insectes n’a pas clairement permis d’allonger leur durée de vie [2]. Ces données suggèrent donc que la théorie des radicaux libres ne peut à elle seule expliquer le processus complexe du vieillissement. D’autres mécanismes pourraient également être à l’origine du vieillissement : anomalies ou mutations génétiques, modifications des protéines, perte de fonction immunitaire, inflammation des tissus, augmentation de l’incidence des tumeurs [3]. Enfin, il est probable que le vieillissement ne soit pas génétiquement programmé par des « gérontogènes1, » [11]. en H2O2, la catalase (qui dégrade le H2O2 en eau et oxygène) et la GPx (glutathion peroxydase) qui dégrade le H2O2 en eau. La GPx est la principale défense anti-oxydante dans les cellules endothéliales. Les anti-oxydants endogènes non enzymatiques incluent les vitamines C et E, le glutathion, les caroténoïdes et les flavonoïdes. Selon Bokov et al. [2], pour que la théorie d’une responsabilité des radicaux libres dans le vieillissement soit validée, trois critères doivent être respectés : (1) les dommages moléculaires causés par le stress oxydant doivent s’accumuler avec l’âge ; (2) les manipulations diététiques, pharmacologiques ou génétiques augmentant la longévité doivent en parallèle diminuer les dommages moléculaires ; (3) les manipulations diminuant le niveau de stress oxydant doivent en parallèle allonger la durée de vie. De nombreuses études ont confirmé le premier critère [
11]. De même, l’augmentation de la longévité par restriction calorique chez la souris [
12] ou par manipulation génétique chez un invertébré [2] réduit les dommages moléculaires associés au stress oxydant. En revanche, la plupart des essais cliniques n’ont démontré aucun effet bénéfique des anti-oxydants (α-tocophérol, vitamines C et/ou E) sur la morbidité et la mortalité associées aux maladies cardiovasculaires [
13]. De plus, l’administration de différents anti-oxydants chez la souris ou les invertébrés n’a pas augmenté leur longévité [2]. De même, la surexpression des gènes codant pour des enzymes anti-oxydantes (Cu/Zn SOD, catalase) chez des insectes n’a pas clairement permis d’allonger leur durée de vie [2]. Ces données suggèrent donc que la théorie des radicaux libres ne peut à elle seule expliquer le processus complexe du vieillissement. D’autres mécanismes pourraient également être à l’origine du vieillissement : anomalies ou mutations génétiques, modifications des protéines, perte de fonction immunitaire, inflammation des tissus, augmentation de l’incidence des tumeurs [3]. Enfin, il est probable que le vieillissement ne soit pas génétiquement programmé par des « gérontogènes1, » [11]. |
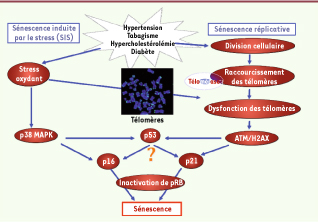
Vieillissement cellulaire ou sénescence cellulaire Au niveau cellulaire, le vieillissement est dénommé sénescence, un état irréversible dans lequel les cellules endommagées ne prolifèrent plus, mais demeurent métaboliquement actives [
14,
15]. Très étudiée en culture cellulaire [
16–
19], la sénescence joue un rôle physiopathologique in vivo [
20,
21]. Les cellules sénescentes s’accumulent dans des endroits stratégiques de dommages cellulaires [21,
22], par exemple dans la plaque athérosclérotique [
23]. Les cellules endothéliales sénescentes sont pro-inflammatoires, pro-thrombotiques et pro-athérosclérotiques et pourraient ainsi participer à la maturation de la plaque [16–
18, 20, 23]. La sénescence est un processus moléculaire complexe activé par différents stimuli (Figure 1). Dans les conditions physiologiques, les mitoses successives induisent la sénescence dite réplicative. Elle est provoquée par le raccourcissement des télomères (l’extrémité des chromosomes eucaryotes), inhérent à la division cellulaire et reconnu comme un dommage à l’ADN [9]. Des études ont démontré que la longueur des télomères de certains types de cellules humaines (leucocytes, fibroblastes) diminuait parallèlement à l’augmentation du nombre de mitoses effectuées et à l’âge chronologique des individus [
24]. Ce raccourcissement active les protéines inhibitrices du cycle cellulaire comme p21, p53, p16 et Rb (protéine rétinoblastome) et mène finalement à la sénescence par épuisement du potentiel réplicatif [
25]. 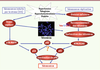 | Figure 1
Activation des cascades de signalisation de la sénescence par différents stimulus. La sénescence peut survenir selon deux voies majeures, la sénescence réplicative et la sénescence induite par le stress (SIPS). La sénescence réplicative est inhérente à la division cellulaire et conduit à l’érosion progressive des télomères (l’extrémité des chromosomes) jusqu’à un seuil critique où les télomères deviennent dysfonctionnels. Ceci active des protéines telles qu’ATM qui induit la phosphorylation de H2AX, un marqueur de dommage à l’ADN. De nombreuses protéines sont alors activées pour propager ce signal de dommage, dont p53, une protéine dite suppresseur de tumeurs. Celle-ci joue un rôle clé en activant p21, une protéine inhibitrice du cycle cellulaire qui empêche la phosphorylation de Rb et bloque ainsi la prolifération cellulaire. La sénescence induite par le stress, dont le stress oxydant associé aux facteurs de risque des maladies cardiovasculaires, est observée prématurément. Elle découle, entre autres, de l’activation de p38 MAPK, qui induit l’activation de la voie p53-pRb. Un autre inhibiteur de cycline, p16, serait un intermédiaire potentiel. Ces différentes voies peuvent se croiser, puisque le stress oxydant peut directement endommager les télomères, et varier selon les types cellulaires. MAPK : mitogen activated protein kinase ; ATM : ataxia telangiectasia muté ; H2AX : histone de type H2AX ; pRb : protéine rétinoblastome phosphorylée. |
Toutefois, la sénescence peut aussi être déclenchée indépendamment de la longueur des télomères, en présence de diverses sources de stress (oncogènes, rayons UV, irradiations, stress oxydant). On parle alors de sénescence induite prématurément par le stress (SIPS). Elle passe par la cavéoline-1, la voie de ERK1/2 (extracellular signal regulated kinases 1 and 2) et celle de p38 MAPK (mitogen activated protein kinase) qui activent également les protéines inhibitrices du cycle cellulaire [14] (Figure 1).
Dans des conditions pathologiques telles que les maladies cardiovasculaires, la sénescence s’avèrerait plutôt être une réponse précoce au stress. Ainsi, dans des cellules endothéliales vasculaires provenant de patients athérosclérotiques, nous avons démontré que l’apparition de la sénescence est prématurée et qu’elle possède des composantes des voies réplicative et SIPS [18]. L’apparition de la sénescence dans les cellules endothéliales corrèle avec la durée d’exposition de ces patients aux facteurs de risque cardiovasculaires (hypertension, diabète, hypercholestérolémie, tabagisme), mais pas avec leur âge chronologique. Cette sénescence prématurée des cellules endothéliales peut être retardée in vitro par un traitement avec l’anti-oxydant N-acétyl-cystéine (NAC) [
17]. Le NAC possède un groupement thiol et ressemble aux composés anti-oxydants endogènes comme le glutathion [
26]. Il neutralise ainsi directement les radicaux libres et il est capable de régénérer les concentrations intracellulaires de glutathion et indirectement celles de glutathion peroxydase. Dans notre étude, l’effet anti-oxydant du NAC est démontré par une réduction significative du niveau de peroxydation lipidique [17]. Dans d’autres études, le NAC a aussi ralenti la sénescence réplicative des cellules endothéliales [
27], tout comme d’autres anti-oxydants, tels que la vitamine C [
28] ou l’atovastatine [27]. Surexprimer la sous-unité catalytique de la télomérase (hTERT, human telomerase reverse transcriptase), une ribonucléoprotéine qui allonge les télomères, peut également ralentirla sénescence de cellules endothéliales isolées chez des patients coronariens [
29]. L’apparition de la sénescence dans des cultures de cellules endothéliales de fumeurs réguliers, donc issues d’un environnement toxique hautement inflammatoire et oxydant, est totalement indépendante de l’âge chronologique des donneurs [16]. Cette sénescence résulte entièrement du stress oxydant et des dommages moléculaires qui l’accompagnent. En effet, elle n’est ni associée à un changement de longueur des télomères, ni à une activation de la télomérase, mais à un niveau de stress oxydant endogène très élevé ainsi qu’à des défenses anti-oxydantes très basses. Ces dommages produits par la SIPS pourraient contribuer à la dysfonction endothéliale précoce observée chez les fumeurs [
30]. |
Vieillissement endothélial dans un environnement pro-oxydant Le système vasculaire est particulièrement vulnérable aux dommages et il a été proposé que son vieillissement pourrait précéder les différentes altérations cellulaires et tissulaires engendrées par le vieillissement en général [8]. La dysfonction endothéliale caractéristique du vieillissement vasculaire [6] se traduit par une baisse de la capacité vasodilatatrice de l’endothélium [
31] et par un déséquilibre des facteurs endothéliaux dilatateurs (NO, prostacycline, H2O2 et facteurs endothéliaux hyperpolarisants, endothelium-derived hyperpolarizing factor, EDHF) et constricteurs (endothéline-1, thromboxane A2, angiotensine II, anion superoxyde et acide 20-hydroxyeicosatétraénoïque) qui contrôlent le tonus vasculaire [
32]. Nous avons démontré que l’endothélium est un système dynamique continuellement exposé à des dommages et à des réparations [32,
33]. Nous avons ainsi observé des changements dans la contribution des différents facteurs vasoactifs endothéliaux au cours de la maturation (phase normale du développement de l’endothélium, qui est suivie de la dysfonction lors du vieillissement). Ces changements permettent de maintenir une fonction endothéliale, mais ils sont néanmoins prédictifs d’une future dysfonction [32–
34]. Ainsi, l’endothélium artériel rénal d’une souris adulte âgée de 6 mois sécrète plus de thromboxane A2 (TXA2) que celui d’une souris jeune de 3 mois [34]. Cette production de thromboxane est induite par les ROS puisqu’elle est réversible par un traitement anti-oxydant tel que la NAC [34]. Chez une souris âgée (12 à 20 mois) et dyslipidémique, la dysfonction endothéliale dans une artère de conductance (artère rénale) provient d’une perte de NO partiellement compensée par une augmentation de production de prostacycline dilatatrice [32], alors qu’elle provient plutôt d’un déclin précoce d’EDHF dans une artère de résistance (artère gracilis) [33]. Nous avons également observé que dans les artères cérébrales de souris athérosclérotiques (souris C57 Bl6 LDLR
−/−
-ApoB+/+) la dysfonction endothéliale précoce (observée dès l’âge de 3 mois) résulte d’une diminution de la fonction de la NOS, d’une augmentation de ROS et d’une production anormale de TXA2 vasoconstrictrice, cette dernière pouvant être bloquée par un traitement anti-oxydant de type polyphénol (A. Drouin, manuscrit en préparation). Une augmentation de TXA2 à la suite d’une augmentation de l’activité des cyclo-oxygénases avec l’âge et la dyslipidémie conduit à une augmentation du taux de ROS, selon un mécanisme à déterminer. En conséquence, un découplage de la NOS et/ou une chélation du NO peuvent survenir et engendrer une dysfonction endothéliale. Un changement graduel de l’environnement redox semble ainsi contribuer à la redistribution progressive des facteurs endothéliaux avec l’âge. Le fait que dans nos données, un traitement anti-oxydant (NAC ou polyphénol) renverse la redistribution des facteurs endothéliaux avec l’âge suggère un rôle global des ROS. Ni leur source, ni leur type n’ont clairement été identifiés, mais nous avons impliqué au moins l’anion superoxyde puisqu’on observe un fort marquage au DHE (dihydroxyethidium, sensible au 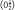 ) dans les vaisseaux de souris âgées et/ou dyslipidémiques [
35]. ) dans les vaisseaux de souris âgées et/ou dyslipidémiques [
35]. |
Vieillissement et principe d’hormesis Alors que de fortes concentrations de ROS sont dommageables pour le système vasculaire, des concentrations physiologiques sont essentielles à la maturation de l’endothélium. En effet, les ROS jouent un rôle crucial dans la physiologie de la cellule et dans des processus aussi variés que le développement, la croissance cellulaire ou le système immunitaire [
36]. Nos données suggèrent que la longévité fonctionnelle de l’endothélium vasculaire est déterminée en grande partie durant la phase de maturation et qu’elle dépend de l’exposition physiologique aux ROS. Le principe d’hormesis aurait un rôle important à jouer. Ainsi, des dommages modérés à l’ADN causés par une exposition mineure aux ROS induiraient l’activation de la machinerie télomérique et la surexpression d’enzymes de réparation de l’ADN [19, 21]. De même, un stress oxydant modéré induit la surexpression d’enzymes et de molécules anti-oxydantes qui maintiennent l’homéostasie cellulaire [37, 38]. Afin de tester l’application du principe d’hormesis au vieillissement vasculaire, nous avons administré un traitement anti-oxydant (avec le polyphénol catéchine) avant ou après la phase de maturation endothéliale pour en détecter les effets sur la dysfonction endothéliale chez des souris saines, âgées de 12 mois [35]. Débuter le traitement avant la maturation (de l’âge de 3 mois à 12 mois) n’a pas amélioré la fonction endothéliale : la dysfonction persistait toujours à 12 mois, associée à une expression marquée de facteurs pro-inflammatoires comme Cox-2 (cyclo-oxygénase-2) et à une diminution d’antioxydants endogènes comme la MnSOD (superoxyde dismutase à manganèse). En revanche, débuter le traitement après le début de la maturation (de l’âge de 9 mois à 12 mois), a prévenu la dysfonction endothéliale, empêché l’augmentation de l’expression de Cox-2 et maintenu un niveau d’expression élevé de Sirtuin-1, une désacétylase capable d’induire la résistance au stress. Ces données suggèrent qu’un traitement anti-oxydant tardif préserve la fonction endothéliale en s’opposant à l’augmentation croissante du stress oxydant qui survient post-maturation. En même temps, ce traitement tardif ne perturbe pas l’équilibre redox durant la phase de maturation, équilibre indispensable au bon fonctionnement endothélial. En d’autres mots, un stress oxydant endogène modéré est bénéfique à long terme car il contribue à l’activation des défenses antioxydantes, selon le principe d’hormesis. |
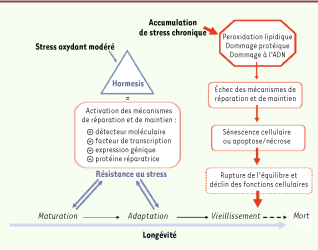
La sénescence, l’hormesis et la mort cellulaire sont les différents résultats de l’interaction des cellules avec leur environnement. Ces résultats dépendent non seulement de l’intensité et de la durée du stress, mais aussi de l’efficacité et de la rapidité des mécanismes de défense, de réparation et d’élimination. Notre hypothèse est que l’hormesis est essentielle à la maturation cellulaire car, en activant les mécanismes endogènes de défense et d’adaptation, un stress modéré arme les cellules pour mieux combattre un stress ultérieur. Dans le cas des cellules endothéliales, une exposition modérée à un stress oxydant durant la phase de maturation stimule les mécanismes antioxydants. En revanche, l’accumulation chronique de stress conduit ultimement à l’épuisement des mécanismes protecteurs, à l’impossibilité de s’adapter au nouvel environnement cellulaire et donc à la sénescence, ainsi qu’à la mort cellulaire (Figure 2).
 | Figure 2
Schématisation du principe d’hormesis dans la longévité endothéliale. Lescellules sont constamment exposées à des ROS, endogènes et environnementaux. Durant la phase de maturation endothéliale, une exposition à un stress oxydant modéré, en plus de ses effets physiologiques, stimule des mécanismes de réparation et de défenses cellulaires. L’expression de gènes codant pour les enzymes anti-oxydantes, les molécules de détoxification et les systèmes de réparation de l’ADN, est augmentée afin de maintenir un niveau physiologique de stress oxydant, ce qui prépare les cellules face à un stress ultérieur. C’est le principe d’hormesis. Cependant, l’accumulation de stress conduit à l’inefficacité de ces mécanismes protecteurs, à des dommages irréversibles et donc à la sénescence cellulaire, au vieillissement et finalement à la mort. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Harman D. Aging : a theory based on free radical and radiation chemistry. J Gerontol 1956 ; 11 : 298-300. 2. Bokov A, Chaudhuri A, Richardson A. The role of oxidative damage and stress in aging. Mech Ageing Dev 2004 ; 125 : 811-26. 3. Holliday R. Aging is no longer an unsolved problem in biology. Ann NY Acad Sci 2006 ; 1067 : 1-9. 4. Mattson MP. Hormesis defined. Ageing Res Rev 2008 ; 7 : 1-7. 5. Gems D, Partridge L. Stress-response hormesis and aging: that which does not kill us makes us stronger. Cell Metab 2008 ; 7 : 200-3. 6. Brandes RP, Fleming I, Busse R. Endothelial aging. Cardiovasc Res 2005 ; 66 : 286-94. 7. Rattan SI. Increased molecular damage and heterogeneity as the basis of aging. Biol Chem 2008 ; 389 : 267-72. 8. Kregel KC, Zhang HJ. An integrated view of oxidative stress in aging: basic mechanisms, functional effects, and pathological considerations. Am J Physiol Regul Integr Comp Physiol 2007 ; 292 : R18-36. 9. Londoño-Vallejo JA. Un Nobel centenaire célèbre télomères et télomérase. Med Sci (Paris) 2009 ; 25 : 973-6 10. Fortuno A, San Jose G, Moreno MU, et al. Oxidative stress and vascular remodelling. Exp Physiol 2005 ; 90 : 457-62. 11. Rattan SI. Theories of biological aging: genes, proteins, and free radicals. Free Radic Res 2006 ; 40 : 1230-8. 12. Masoro EJ. The role of hormesis in life extension by dietary restriction. Interdiscip Top Gerontol 2007 ; 35 : 1-17. 13. Steinberg D, Witztum JL. Is the oxidative modification hypothesis relevant to human atherosclerosis? Do the antioxidant trials conducted to date refute the hypothesis? Circulation 2002 ; 105 : 2107-11. 14. Ben-Porath I, Weinberg RA. The signals and pathways activating cellular senescence. Int J Biochem Cell Biol 2005 ; 37 : 961-76. 15. Bischof O, Dejean A, Pineau P. Une revue de la sénescence cellulaire : ami ou ennemi de la promotion tumorale ? Med Sci (Paris) 2009 ; 25 : 153-60 16. Farhat N, Thorin-Trescases N, Voghel G, et al. Stress-induced senescence predominates in endothelial cells isolated from atherosclerotic chronic smokers. Can J Physiol Pharmacol 2008 ; 86 : 761-9. 17. Voghel G, Thorin-Trescases N, Farhat N, et al. Chronic treatment with N-acetyl-cystein delays cellular senescence in endothelial cells isolated from a subgroup of atherosclerotic patients. Mech Ageing Dev 2008 ; 129 : 261-70. 18. Voghel G, Thorin-Trescases N, Farhat N, et al. Cellular senescence in endothelial cells from atherosclerotic patients is accelerated by oxidative stress associated with cardiovascular risk factors. Mechanisms of ageing and development 2007 ; 128 : 662-71. 19. Von Zglinicki T, Burkle A, Kirkwood TB. Stress, DNA damage and ageing: an integrative approach. Exp Gerontol 2001 ; 36 : 1049-62. 20. Erusalimsky JD, Kurz DJ. Cellular senescence in vivo: its relevance in ageing and cardiovascular disease. Exp Gerontol 2005 ; 40 : 634-42. 21. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev 2007 ; 128 : 36-44. 22. Herbig U, Ferreira M, Condel L, et al. Cellular senescence in aging primates. Science 2006 ; 311 : 1257. 23. Minamino T, Komuro I. Vascular cell senescence: contribution to atherosclerosis. Circ Res 2007 ; 100 : 15-26. 24. Kappei D, Londono-Vallejo JA. Telomere length inheritance and aging. Mech Ageing Dev 2008 ; 129 : 17-26. 25. Takai H, Smogorzewska A, de Lange T. DNA damage foci at dysfunctional telomeres. Curr Biol 2003 ; 13 : 1549-56. 26. Zafarullah M, Li WQ, Sylvester J, Ahmad M. Molecular mechanisms of Nacetylcysteine actions. Cell Mol Life Sci 2003 ; 60 : 6-20. 27. Haendeler J, Hoffmann J, Diehl JF, et al. Antioxidants inhibit nuclear export of telomerase reverse transcriptase and delay replicative senescence of endothelial cells. Circ Res 2004 ; 94 : 768-75. 28. Furumoto K, Inoue E, Nagao N, et al. Age-dependent telomere shortening is slowed down by enrichment of intracellular vitamin C via suppression of oxidative stress. Life Sci 1998 ; 63 : 935-48. 29. Voghel G, Thorin-Trescases N, Mamarbachi AM, et al. Endogenous oxidative stress prevents telomerase-dependent immortalization of human endothelial cells. Mech Ageing Dev 2010 ; 131 : 354-63. 30. Ambrose JA, Barua RS. The pathophysiology of cigarette smoking and cardiovascular disease: an update. J Am Coll Cardiol 2004 ; 43 : 1731-7. 31. Lakatta EG. Age-associated cardiovascular changes in health: impact on cardiovascular disease in older persons. Heart Fail Rev 2002 ; 7 : 29-49. 32. Gendron ME, Thorin-Trescases N, Villeneuve L, Thorin E. Aging associated with mild dyslipidemia reveals that COX-2 preserves dilation despite endothelial dysfunction. Am J Physiol Heart Circ Physiol 2007 ; 292 : H451-8. 33. Krummen S, Drouin A, Gendron ME, et al. ROS-sensitive cytochrome P450 activity maintains endothelial dilatation in ageing but is transitory in dyslipidaemic mice. Br J Pharmacol 2006 ; 147 : 897-904. 34. Gendron ME, Thorin E. A change in the redox environment and thromboxane A2 production precede endothelial dysfunction in mice. Am J Physiol Heart Circ Physiol 2007 ; 293 : H2508-15. 35. Gendron ME, Théorêt JF, Mamarbachi AM, et al. Late chronic catechin antioxidant treatment is deleterious to the endothelial function in aging mice with established atherosclerosis. Am J Physiol Heart Circ Physiol 2010 ; 298 : H2062-70. 36. Droge W. Free radicals in the physiological control of cell function. Physiol Rev 2002 ; 82 : 47-95. 37. Radak Z, Chung HY, Goto S. Systemic adaptation to oxidative challenge induced by regular exercise. Free Radic Biol Med 2008 ; 44 : 153-9. 38. Yokoo S, Furumoto K, Hiyama E, Miwa N. Slow-down of age-dependent telomere shortening is executed in human skin keratinocytes by hormesis-like-effects of trace hydrogen peroxide or by anti-oxidative effects of pro-vitamin C in common concurrently with reduction of intracellular oxidative stress. J Cell Biochem 2004 ; 93 : 588-97. |


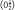 ), le radical hydroxyle (
), le radical hydroxyle (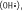 ), le peroxyde d’hydrogène (H2O2, qui n’est pas en soi un composé radicalaire), le monoxyde d’azote (NO) et le peroxynitrite (ONOO−). Divers systèmes enzymatiques produisent des ROS dans les vaisseaux. Les principaux sont le cytochrome P450, les cyclo-oxygénases, les lipo-oxygénases, les NOS (NO synthases), ainsi que la xanthine oxydase et la NADPH oxydase [
), le peroxyde d’hydrogène (H2O2, qui n’est pas en soi un composé radicalaire), le monoxyde d’azote (NO) et le peroxynitrite (ONOO−). Divers systèmes enzymatiques produisent des ROS dans les vaisseaux. Les principaux sont le cytochrome P450, les cyclo-oxygénases, les lipo-oxygénases, les NOS (NO synthases), ainsi que la xanthine oxydase et la NADPH oxydase [
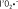 en H2O2, la catalase (qui dégrade le H2O2 en eau et oxygène) et la GPx (glutathion peroxydase) qui dégrade le H2O2 en eau. La GPx est la principale défense anti-oxydante dans les cellules endothéliales. Les anti-oxydants endogènes non enzymatiques incluent les vitamines C et E, le glutathion, les caroténoïdes et les flavonoïdes. Selon Bokov et al. [
en H2O2, la catalase (qui dégrade le H2O2 en eau et oxygène) et la GPx (glutathion peroxydase) qui dégrade le H2O2 en eau. La GPx est la principale défense anti-oxydante dans les cellules endothéliales. Les anti-oxydants endogènes non enzymatiques incluent les vitamines C et E, le glutathion, les caroténoïdes et les flavonoïdes. Selon Bokov et al. [