| |
| Med Sci (Paris). 2010 October; 26(10): 842–847. Published online 2010 October 15. doi: 10.1051/medsci/20102610842.La maladie de Charcot-Marie-Tooth Jean-Michel Vallat1* and Benoît Funalot2* 1Service de neurologie, Laboratoire de neuropathologie, Centre de référence « neuropathies périphériques rares » 2Laboratoire de biochimie et génétique moléculaire, CHU de Limoges, 2, avenue Martin-Luther-King, 87042 Limoges Cedex, France |
Les syndromes CMT sont les maladies neuromusculaires héréditaires les plus fréquentes, représentant environ 40 % des neuropathies chroniques d’origine génétique. Leur prévalence est comprise entre 4,7 et 36 pour 100 000 personnes selon les études [
1,
2]. Elles sont aussi dénommées « neuropathies héréditaires sensitivo-motrices » (NHSM), alors que les neuropathies héréditaires purement sensitives, qui n’appartiennent pas aux syndromes CMT, sont appelées « neuropathies héréditaires sensitives et autonomes » (NHSA). |
Historique des syndromes CMT En 1886, Tooth rapporte des cas identiques à ceux décrits par Charcot et Marie la même année [
3,
4] et cliniquement caractérisés par une atrophie musculaire distale, en particulier péronière. Alors que Charcot et Marie évoquaient une atteinte médullaire, Tooth suspectait une atteinte primaire des troncs nerveux. En 1957, Gilliatt et Thomas décrivent des ralentissements très importants des vitesses de conduction nerveuse chez ces patients [
5]. En 1968, Dyck et Lambert distinguent le type 1 (CMT1), en rapport avec une atteinte démyélinisante chronique des nerfs périphériques, et le type 2 (CMT2), lié à une atteinte axonale avec des vitesses de conduction normales ou discrètement ralenties [
6,
7]. Les tentatives de classification actuelle tiennent toujours compte de la vitesse au-dessus ou au-dessous de 38 m/s, par convention mesurée au niveau d’un nerf médian. Si la distinction du mécanisme démyélinisant et axonal a toujours un intérêt réel, il faut prendre en compte que, dans le cadre d’une neuropathie chronique évoluant sur plusieurs dizaines d’années, l’atteinte axonale deviendra toujours prédominante. Les signes initialement démyélinisants seront ainsi plus difficiles à mettre en évidence à un stade évolué, que ce soit sur le plan électrophysiologique ou sur le plan histologique [
8]. Par ailleurs, il est apparu plus tard que certains patients ne pouvaient être classés en prenant en compte de façon stricte ces critères électrophysiologiques, car dans une même famille, les vitesses de conduction nerveuse de différents sujets atteints pouvaient varier entre des valeurs normales et 25 m/s d’où une terminologie adaptée à de tels cas qui sont appelés « CMT intermédiaires ». |
Phénotypes cliniques des syndromes CMT Les syndromes CMT regroupent donc des polyneuropathies héréditaires hétérogènes qui ont en commun un phénotype clinique voisin et une évolution chronique sur plusieurs dizaines d’années. Les premiers symptômes surviennent habituellement au cours des deux premières décennies. Les patients présentent un déficit moteur distal associé à une atrophie péronière, la neuropathie débutant au niveau des membres inférieurs. Il existe un steppage bilatéral, des déformations des pieds, des troubles sensitifs distaux modérés et une abolition des réflexes ostéotendineux. Peu à peu, l’atteinte motrice et trophique diffuse aux muscles intrinsèques des mains et aux avant-bras. En fait, l’étude détaillée des corrélations génotype-phénotype a souligné une très grande complexité. Il existe en effet des variantes phénotypiques tant cliniques qu’électrophysiologiques et histologiques entre des familles différentes et au sein d’une même famille ayant une anomalie génique identique. Il est donc vraisemblable que les manifestations phénotypiques de ces maladies ne soient pas déterminées uniquement par les effets délétères d’un gène muté, mais aussi par le fond génétique des individus, des modifications épigénétiques et/ou des facteurs environnementaux. |
Mode de transmission des syndromes CMT La transmission des syndromes CMT peut se faire sur le mode autosomique récessif ou lié à l’X (Tableaux I et II). Les cas de transmission récessive sont habituellement de début précoce voire très précoce et ont un phénotype clinique souvent sévère. Lorsque le début est tardif (après l’adolescence), il s’agit presque toujours de formes dominantes. Dans un contexte de polyneuropathie d’évolution très chronique et en l’absence d’histoire familiale évocatrice, reconnaître une forme sporadique de CMT (en particulier lorsqu’elle est due à une mutation génique de novo) peut être difficile si on n’y pense pas systématiquement. Les examens systématiques clinique et électrophysiologique d’autres membres de la famille ne se plaignant de rien peuvent s’avérer très utiles pour le diagnostic, en identifiant des signes mineurs de neuropathie périphérique chez des apparentés et en apportant ainsi une information génétique supplémentaire. Il est très vraisemblable qu’un nombre significatif de cas apparemment sporadiques de CMT soient diagnostiqués et traités à tort comme des polyradiculonévrites inflammatoires démyélinisantes chroniques [
9].  | Tableau I
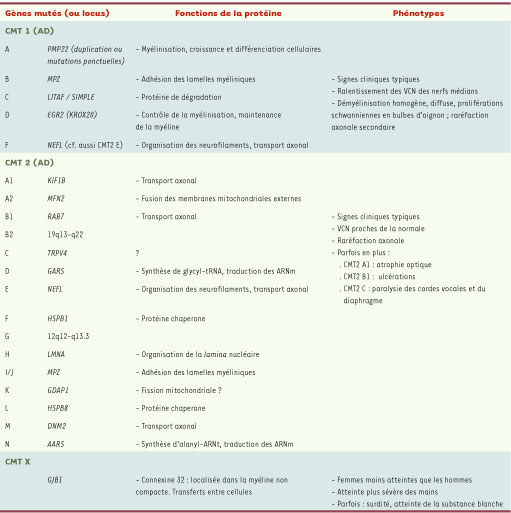
Classification des CMTautosomiques dominants et liés a l’X. VCN : vitesses de conduction nerveuse. |
|
Une terminologie discutée et discutable Utilisation des termes NHSM et CMT La NHSM de type 1 est habituellement synonyme de CMT1, mais cette transposition n’est pas applicable à toutes les formes de CMT. Ainsi, le CMT4 correspond à la forme démyélinisante autosomique récessive, tandis que le type NHSM IV renvoie à la maladie de Refsum. En fait, au lieu de CMT4, il serait plus logique d’utiliser CMT1 autosomique récessif (AR-CMT1) qui pour des raisons historiques peu claires n’est jamais employé. 
Le syndrome de Dejerine-Sottas (SDS) : une entité individualisée (CMT3 ou NHSM III) ? Il s’agit d’une neuropathie démyélinisante débutant avant l’âge de 2 ans, initialement décrite avec une transmission récessive et pouvant être responsable d’un retard des acquisitions motrices. Une ataxie est souvent rencontrée chez des patients plus âgés. Ce syndrome peut être considéré comme un continuum avec la neuropathie hypomyélinisante congénitale (NHC) (CHN, congenital hypomyelination neuropathy) qui est la forme clinique la plus sévère du CMT. Dans ces deux syndromes, les vitesses de conduction nerveuse motrices sont très basses, inférieures à 10 m/s. La biopsie objective une neuropathie très démyélinisante, hypertrophique du fait de la prolifération schwannienne en bulbes d’oignon souvent intense. La plupart de ces cas sont dus à des mutations hétérozygotes des gènes codant pour des protéines impliquées dans la myélinisation du nerf : PMP22, P0, EGR2 (Krox-20), mais des cas récessifs liés aux gènes codant pour la périaxine, l’EGR2 et le GDAP1 (voir Glossaire) ont été aussi décrits. Si le SDS correspond à des lésions sévères de démyélinisation-remyélinisation, la NHC serait induite par une anomalie primaire de la myélinisation ou dysmyélinisation. En fait, progressivement, le SDS est devenu synonyme d’une forme grave, précoce et très démyélinisante d’un CMT quelles que soient ses modalités de transmission. |
Gènes actuellement en cause dans le déterminisme des syndromes CMT Les classifications qui résultent des études génétiques (Tableaux I et II) reposent sur la proposition que les CMT1 pourraient être causés par des gènes exprimés par les cellules de Schwann (vitesses de conduction ralenties) tandis que les CMT 2 seraient liés à des mutations de gènes exprimés par les neurones (vitesses de conduction normales). La réalité est probablement plus complexe, mais cette vision simplifiée des choses est utile en première intention pour orienter le diagnostic moléculaire chez les patients. Identifier les bases moléculaires des CMT et étudier les gènes impliqués et leurs fonctions est évidemment important pour essayer de comprendre les mécanismes physiopathologiques de ces maladies neurodégénératives et les processus qui interviennent dans le développement et le fonctionnement du système nerveux périphérique.  | Tableau II
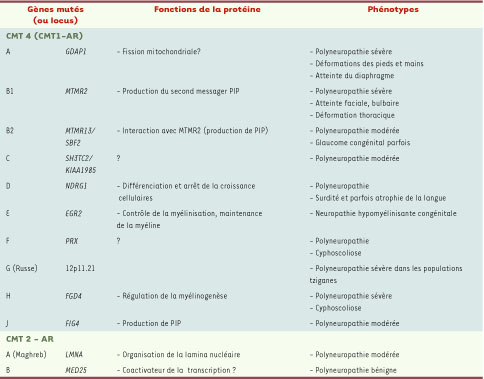
Classification des CMT récessifs. AD : autosomique dominant. AR : autosomique récessif. |
Lorsque chez un patient les principaux gènes de CMT ont été explorés sans succès, il arrive que l’on réalise une biopsie nerveuse (prélèvement d’un fragment de nerf sensitif). L’étude fine de cette biopsie, notamment par un examen en microscopie électronique (ME), permettra parfois d’orienter vers un gène particulier quand les autres données familiales, cliniques et électrophysiologiques ne l’ont pas permis. Les maladies de CMT sont directement induites par des mutations de gènes codant pour des protéines dont les localisations sont variées : myéline compacte et non compacte, cellule de Schwann, axone. Leurs fonctions sont aussi diverses et plus ou moins bien connues : compaction de la myéline, initiation de la myélinisation, maintien de la myéline, formation du cytosquelette, métabolisme des mitochondries, etc. |
Hétérogénéité des fonctions des gènes impliqués dans les CMT CMT de type 1 (démyélinisants) Différentes protéines impliquées dans le processus de myélinisation des nerfs périphériques et/ou l’organisation/la maintenance de la gaine de myéline peuvent être mutées [
10] : le gène EGR2 (voir Glossaire) intervient le plus en amont puisqu’il code pour un facteur de transcription (appelé indifféremment EGR2 ou KROX-20) exprimé dans les cellules de Schwann et qui contrôle l’expression de gènes impliqués dans la myélinisation. Il existe des sites de fixation pour EGR2 dans les promoteurs des gènes codant pour les différentes protéines de structure de la myéline périphérique. Au premier rang de celles-ci, on trouve les protéines membranaires PMP22 et P0, présentes à la membrane des enroulements schwanniens qui constituent les gaines de myélines des nerfs périphériques. La protéine P0 est la principale protéine de la myéline compacte et elle favorise l’adhésion entre les différentes couches des enroulements schwanniens, en formant des multimères de protéines P0 qui ancrent entre elles les membranes des enroulements adjacents. Des mutations de P0 peuvent ainsi être responsables d’une mauvaise compaction de la myéline des nerfs périphériques, uniquement détectable en microscopie électronique (Figure 1). La connexine 32, protéine de type gap junction codée par le gène GJB1, est également exprimée à la membrane des cellules de Schwann mais dans des zones de myéline non compacte. Ces zones, situées en bordure des nœuds de Ranvier (région paranodale) et au niveau des incisures de Schmidt-Lantermann, apparaissent comme assez régulièrement intercalées entre de longues portions de myéline compacte. Les gap junctions de la myéline non compacte permettent la diffusion de petites molécules et d’ions à travers les différentes couches de myéline du nerf. La périaxine est une autre protéine de la myéline non compacte, située quant à elle à la partie la plus externe de la gaine de myéline (qui porte le nom de bande de Cajal). Sa fonction est encore inconnue. Les protéines MTMR2 et MTMR13 sont des phosphatases qui interagissent l’une avec l’autre et modifient la production du second messager phosphatidyl inositol-phosphate (PIP). Une autre phosphatase, FIG4, interagit également avec ce système. La protéine frabine est un facteur d’échange nucléotidique qui transfère une guanine à la rhoGTPase CDC42, laquelle a une fonction de régulation de la myélinogenèse. Enfin, certains gènes mutés dans des formes démyélinisantes de CMT codent pour des protéines aux fonctions encore inconnues. C’est notamment le cas de LITAF, NDRG1 et SH3TC2 (voir Glossaire).
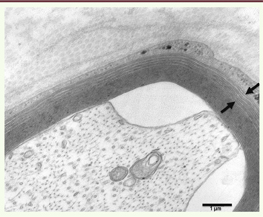
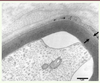 | Figure 1
Biopsie nerveuse d’un patient atteint de CMT1B (mutation de P0). Micrographie électronique, section transversale. Les lamelles myéliniques les plus périphériques sont anormalement mais régulièrement décompactées (entre les 2 flèches) en comparaison des lamelles myéliniques plus internes. |
CMT de type 2 (atteinte axonale) Les gènes mutés codent pour des protéines aux fonctions bien différentes [
11]. Tout d’abord, plusieurs d’entre elles sont impliquées dans les transports axonaux : c’est le cas de la protéine NEFL (chaîne légère des neurofilaments), de KIF1B (protéine motrice de type kinésine), de la dynamine-2 (une mécanoprotéine impliquée dans différentes fonctions cellulaires) et de RAB7 (régulateur du transport vésiculaire). Un deuxième groupe rassemble des gènes codant pour des protéines mitochondriales, la mitofusine-2 et GDAP1. Les mitofusines (1 et 2) jouent un rôle central dans la fusion des membranes externes des mitochondries. En effet, ces organites sont en perpétuelle interaction à l’intérieur de la cellule et de constants processus de fusion et fission entre mitochondries permettent à la fois les échanges entre mitochondries et le transport des mitochondries à travers la cellule (en particulier le long des très longs axones des nerfs périphériques) [
16] (→).
(→) Voir l’article de Guy Lenaers et al., page 836 de ce numéro
Dans les nerfs périphériques, la mitofusine-1 serait très peu exprimée, expliquant que des mutations de MFN2 puissent induire un défaut de la dynamique mitochondriale. Ainsi, chez les patients porteurs de mutations de MFN2, les mitochondries axonales apparaissent anormales, arrondies et agrégées les unes aux autres au lieu d’avoir la forme tubulaire habituelle (Figure 2) [
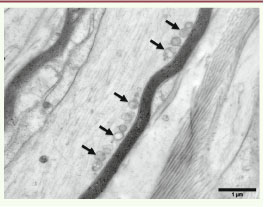
17] (→). 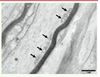 | Figure 2
Biopsie nerveuse d’un patient atteint de CMT2A2 (mutation de MFN2). Micrographie électronique, section longitudinale. Les mitochondries intra-axonales sont anormalement arrondies et ont des crêtes très modifiées. Elles sont regroupées à la périphérie de l’axone (flèches). |
(→) Voir l’article de Cécile Sauvanet et al., page 823 de ce numéro
Le gène GDAP1 code également pour une protéine mitochondriale, dont la fonction est moins bien connue mais qui pourrait être impliquée dans le processus de fission mitochondriale. Un troisième groupe est constitué des deux gènes codant pour des protéines impliquées dans la traduction des ARN messagers : GARS (voir Glossaire) et AARS. Ces deux enzymes permettent la chargement des acides aminés glycine et alanine sur leurs ARN de transfert respectifs. Deux autres gènes (HSPB8 et HSPB1) codent pour des protéines chaperones, HSP22 et HSP27. Ces protéines « de choc thermique » (heat shock proteins) ont pour fonction de préserver la conformation spatiale de leurs protéines cibles, en particulier en milieu oxydant. D’autres gènes sont les uniques représentants de leur catégorie : c’est le cas de LMNA, qui code pour la lamine A/C, un filament intermédiaire qui entre dans la composition de la lamina nucléaire (réseau de protéines sous-jacent à la membrane nucléaire interne et qui détermine la forme et la taille du noyau). Un autre exemple est TRPV4, le gène tout récemment identifié comme muté dans le CMT2C [
12–
14]. Ce gène code pour un récepteur vanilloïde qui a une fonction de canal cationique polymodal, et est activé par divers stimulus. Rien de la fonction de ce récepteur dans le nerf périphérique n’est connu à ce jour. Enfin, le gène MED25 qui code pour une protéine coactivatrice de la transcription, a été trouvé muté à l’état homozygote dans une grande famille atteinte de CMT2-AR [
15]. La fonction exacte de cette protéine au cours de la régulation transcriptionnelle est inconnue, de même que son rôle dans le nerf périphérique. |
Cette brève mise au point concernant les neuropathies héréditaires sensitivo-motrices met en évidence l’hétérogénéité des phénotypes, des modalités de transmission, des gènes en cause et de leurs fonctions, ce qui nous semble justifier l’utilisation de la terminologie « syndromes CMT » plutôt que celle de maladie de CMT. De nouveaux gènes de CMT sont découverts régulièrement et il est possible que certains soient rapportés entre la rédaction de cet article et sa publication. Par ailleurs, les fonctions de certains gènes, de découverte plus ou moins récente, restent aussi à préciser. Des collaborations entre chercheurs cliniciens qui examinent des patients atteints de CMT et chercheurs fondamentaux qui créent des modèles in vivo ou in vitro de CMT sont en cours et contribuent à faire progresser la compréhension et le traitement de ces maladies. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Pareyson D, Marchesi C. Diagnosis, natural history, and management of Charcot-Marie-Tooth disease. Lancet Neurol 2009 ; 8 : 654-67. 2. Ouvrier R, Geevasingha N, Ryann MM. Autosomal-recessive and X-linked forms of hereditary motor and sensory neuropathy in childhood. Muscle Nerve 2007 ; 36 : 131-43. 3. Charcot JM, Marie P. Sur une forme particulière d’atrophie musculaire progressive, souvent familiale, débutant par les pieds et les jambes et atteignant plus tard les mains. Rev Neurol 1886 ; 6 : 97-138. 4. Tooth HH. The peroneal type of progressive muscular atrophy. Thesis, HK Lewis. London : University of Cambridge, 1886. 5. Gilliatt RW, Thomas PK. Extreme slowing of nerve conduction in peroneal muscular atrophy. Ann Phys Med 1957 ; 15 : 104-7. 6. Dyck PJ, Lambert EH. Lower motor and primary sensory neuron diseases with peroneal muscular atrophy. I. Neurologic, genetic, and electrophysiological findings in hereditary polyneuropathies. Arch Neurol 1968 ; 18 : 603-18. 7. Dyck PJ, Lambert EH. Lower motor and primary sensory neuron diseases with peroneal muscular atrophy. II. Neurologic, genetic, and electrophysiological findings in various neuronal degenerations. Arch Neurol 1968 ; 18 : 619-25. 8. Vallat JM. Dominantly inherited peripheral neuropathies. J Neuropathol Exp Neurol 2003 ; 62 : 699-714. 9. Tabaraud F, Lagrange E, Sindou P, et al. Demyelinating X-linked Charcot-Marie-Tooth disease: unusual electrophysiological findings. Muscle Nerve 1999 ; 22 : 1442-7. 10. Scherer SS, Wrabetz L. Molecular mechanisms of inherited demyelinating neuropathies. Glia 2008 ; 56 : 1578-89. 11. Züchner S, Vance JM. Mechanisms of disease: a molecular genetic update on hereditary axonal neuropathies. Nat Clin Pract Neurol 2006 ; 2 : 45-53. 12. Auer-Grumbach M, Olschewski A, Papi L, et al. Alterations in the ankyrin domain of TRPV4 cause congenital distal SMA, scapuloperoneal SMA and HMSN2C. Nat Genet 2010 ; 42 : 160-4. 13. Deng HX, Klein CJ, Yan J, et al. Scapuloperoneal spinal muscular atrophy and CMT2C are allelic disorders caused by alterations in TRPV4. Nat Genet 2010 ; 42 : 165-9. 14. Landouré G, Zdebik AA, Martinez TL, et al. Mutations in TRPV4 cause Charcot-Marie-Tooth disease type 2C. Nat Genet 2010 ; 42 : 170-4. 15. Leal A, Huehne K, Bauer F, et al. Identification of the variant Ala335Val of MED25 as responsible for CMT2B2: molecular data, functional studies of the SH3 recognition motif and correlation between wild-type MED25 and PMP22 RNA levels in CMT1A animal models. Neurogenetics 2010 (sous presse). 16. Lenaers G, Amati-Bonneau P, Delettre C, et al. De la levure aux maladies neurodégénératives : dix ans d’exploration des pathologies de la dynamique mitochondriale. Med Sci (Paris) 2010 ; 26 : 836-41. 17. Sauvanet C, Arnauné-Pelloquin L, David C. Dynamique et morphologie mitochondriales : acteurs, mécanismes et pertinence fonctionnelle. Med Sci (Paris) 2010 ; 26 : 823-9. |