| |
| Med Sci (Paris). 2010 October; 26(10): 800–803. Published online 2010 October 15. doi: 10.1051/medsci/20102610800.GRK6, une nouvelle piste thérapeutique pour diminuer les dyskinésies induites par la L-dopa Amandine Berthet1 and Erwan Bézard1* 1Université Victor Segalen-Bordeaux 2, Centre national de la recherche scientifique, Institut des neurosciences de Bordeaux, UMR 5227, 33000 Bordeaux, France MeSH keywords: Animaux, Dyskinésies, traitement médicamenteux, étiologie, Endocytose, effets des médicaments et des substances chimiques, physiologie, Kinases associées à des récepteurs couplés à une protéine G, usage thérapeutique, Haplorhini, Humains, Lévodopa, effets indésirables |
Dyskinésies induites par le traitement de la maladie de Parkinson La maladie de Parkinson est une maladie neurodégénérative caractérisée notamment par la perte progressive des neurones dopaminergiques pigmentés de la substance noire [
1]. Cliniquement, le syndrome parkinsonien repose sur une triade de symptômes moteurs associant akinésie/bradykinésie (difficulté à l’initiation des mouvements et ralentissement de leur exécution), rigidité et tremblement de repos. Ces manifestations cliniques s’associent différemment selon les patients. Les traitements de la maladie de Parkinson ont pour objectif de remplacer la dopamine par l’utilisation, soit d’agonistes dopaminergiques, soit de la L-dopa, un précurseur de la dopamine. Ces traitements sont efficaces pendant quelques années mais restent toutefois insatisfaisants. Non seulement ils ne résolvent pas l’ensemble des problèmes rencontrés par les patients, mais ils induisent des complications motrices appelées dyskinésies, ensemble de mouvements anormaux involontaires, et des fluctuations dans la réponse au traitement [
2]. À ce jour, il n’existe pas de traitement efficace des dyskinésies induites par la L-dopa mais seulement des stratégies dilatoires. La première vise à retarder l’exposition à la L-dopa par un traitement à base d’agonistes dopaminergiques. Ce traitement peut être administré seul ou en association avec la L-dopa au cours de la phase initiale de la maladie. La seconde tend à stabiliser les taux de L-dopa en la remplaçant par des formes retard ou en réduisant sa dégradation grâce à l’association d’inhibiteurs de la catéchol-O-méthyl-transférase (entacapone) ou d’inhibiteurs de la monoamine oxydase B (sélégiline, rasagiline). La troisième a recours à l’amantadine, la seule molécule anti-dyskinétique disponible, quoique d’efficacité limitée et source d’effets secondaires psychogéniques indésirables. Enfin, lorsque ces approches n’ont plus d’effet, une intervention neurochirurgicale est proposée telle que la stimulation cérébrale profonde du noyau sous-thalamique. |
Rôle central des récepteurs à la dopamine dans l’apparition des dyskinésies Notre connaissance des mécanismes cellulaires impliqués dans la physiopathologie des dyskinésies, qui était parcellaire au début des années 2000, a grandement évolué. La déplétion dopaminergique caractéristique de la maladie de Parkinson provoque de nombreux changements dans la signalisation des récepteurs de la dopamine. Ces dérèglements sont aggravés par le traitement chronique à la L-dopa et conduisent progressivement à l’apparition des dyskinésies. De nombreuses études contribuent à montrer que les récepteurs de la dopamine, qui appartiennent à la superfamille des récepteurs membranaires couplés aux protéines G (RCPG), et plus particulièrement le récepteur de type D1, jouent un rôle central dans l’apparition des dyskinésies [1]. Notre équipe a précédemment mis en évidence l’augmentationde l’expression des récepteurs D1 et de leur couplage aux protéines G au niveau des neurones striataux dans un modèle primate chez lequel la maladie de Parkinson était induite par la 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP) - une neurotoxine qui détruit spécifiquement les neurones dopaminergiques. Les animaux développaient des dyskinésies après un traite ment chronique par la L-dopa [
3]. Ces données suggèrent que l’hypersensibilité des récepteurs D1 de la dopamine observée dans le striatum peut jouer un rôle dans la physiopathologie des dyskinésies. Cette hypersensibilisation peut s’expliquer par : (1) l’augmentation du nombre de récepteurs D1 à la membrane plasmique des neurones épineux de taille moyenne du striatum (structure cible de la dopamine) lors des dyskinésies [
4,
5], alors qu’ils devraient être internalisés après avoir été stimulés par leur ligand naturel, la dopamine, et (2) par la diminution de l’expression des composants de la machinerie de désensibilisation homologue [
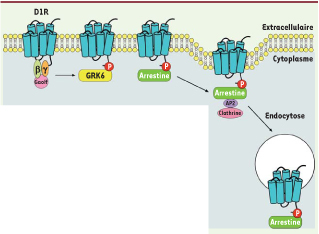
6]. La désensibilisation homologue est le processus d’internalisation qui survient en réponse à une stimulation (Figure 1). En effet, lorsque les dyskinésies sont manifestes, une réduction du niveau d’expression de deux protéines impliquées dans ce processus, la GRK6 (G protein-coupled receptor kinase 6), une kinase qui phosphoryle le RCPG, et l’arrestine 2, qui empêche le couplage du récepteur à une nouvelle protéine G pour permettre l’arrêt de la transmission du signal [
8] (Figure 1), est démontrée.  | Figure 1
Mécanisme de désensibilisation homologue d’un récepteur membranaire couplé aux protéines G, le récepteur de type D1 de la dopamine. Après stimulation par la dopamine, son ligand naturel, le récepteur de type D1 est recyclé afin d’éviter une stimulation constante. Le récepteur est phosphorylé via une kinase, G protein-coupled receptor kinase 6 (GRK6), puis une arrestine vient se fixer au récepteur pour empêcher son couplage avec une nouvelle protéine G, ce qui arrête la transmission du signal. Le récepteur est alors internalisé dans le cytoplasme par endocytose. |
|
Réduction des dyskinésies par la surexpression de GRK6 En collaboration avec l’équipe américainede E.V. Gurevich (Université Vanderbilt de Nashville), nous avons tenté de corriger ce déficit en GRK6 dans le but de restaurer une désensibilisation homologue du récepteur D1. L’étude des effets comportementaux que provoque la surexpression de GRK6 obtenue par transfert du gène codant GRK6 via un vecteur lentiviral injecté par voie intracérébrale a été menée chez deux modèles animaux de la maladie de Parkinson traités avec de la L-dopa [
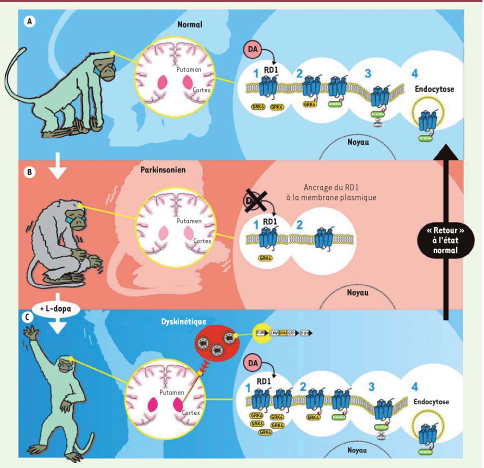
7] (Figure 2). Cette thérapie génique a permis de réduire considérablement la sévérité des dyskinésies. La réduction de la sévérité des dyskinésies a d’abord été observée dans un modèle animal simple de la maladie de Parkinson, celui du rat chez lequel une déplétion unilatérale en dopamine est induite par injection intracérébrale de 6-hydroxydopamine. Une fois cette étape de faisabilité acquise, nous avons répété ces travaux chez le singe macaque intoxiqué au MPTP, le modèle expérimental de référence de la maladie (Figure 2). Dans ce modèle, la surexpression de GRK6 dans le striatum permet de diminuer la sévérité des dyskinésies de façon remarquable et de restaurer les effets thérapeutiques de la L-dopa. En effet, GRK6 prolonge l’effet antiparkinsonien de la L-dopa, les singes macaques bénéficiant ainsi plus longtemps de faibles doses. Ces effets sont la conséquence de la restauration des mécanismes de désensibilisation homologue. La surexpression de GRK6 entraîne en effet l’internalisation spécifique des récepteurs D1 sans que la localisation subcellulaire d’autres récepteurs, comme les récepteurs de type D2 [1] et les récepteurs au glutamate (mGluR5), ne soit affectée. L’ensemble de ces données souligne l’importance du rôle fonctionnel de GRK6 dans les mécanismes sous-jacents des dyskinésies. L’enjeu principal de notre stratégie était de réduire la signalisation pathologique pour réduire les dyskinésies tout en préservant l’action antiparkinsonienne bénéfique de la L-dopa, qui intervient également via les récepteurs à la dopamine. Ces travaux valident GRK6 en tant que cible thérapeutique d’intérêt pour traiter les dyskinésies et les fluctuations de la réponse thérapeutique à la L-dopa. Une stratégie de thérapie génique requérant l’utilisation de vecteurs viraux n’est toutefois pas privilégiée pour développer un nouveau traitement. Nous avons donc adopté une stratégie de crible pharmacologique pour identifier de petites molécules mimant l’action de GRK6. Audelà des effets bénéfiques potentiels dans les dyskinésies induites par la L-dopa, ce type d’approche pourrait avoir un intérêt dans d’autres troubles neuropsychiatriques associés à une hyperdopaminergie comme la schizophrénie et l’addiction aux psychostimulants.  | Figure 2
Comment le traitement par GRK6 marche-t-il ? A. La dopamine se trouve dans le striatum (zone rose) chez le singe normal. Elle transmet le signal via ses récepteurs, en particulier le récepteur de type D1. Après stimulation par la dopamine, le récepteur est recyclé pour éviter une stimulation continue. Les protéines impliquées dans ce processus sont, par exemple, GRK6 (jaune) et arrestine 2 (vert). B. La maladie de Parkinson est causée par la déplétion dopaminergique dans le striatum (zone rose pâle). La dopamine ne se lie plus au récepteur et aucun signal n’est transmis. Les récepteurs séjournent à la surface du neurone. Le traitement de référence de la maladie de Parkinson, la L-dopa, précurseur de la dopamine, échoue à inverser cet ancrage à la membrane. Ceci est la conséquence d’une diminution de la disponibilité des protéines capables de les retirer de la membrane (moins de GRK6 comme illustré). C. Les dyskinésies, mouvements involontaires anormaux survenant après un traitement par la L-dopa sur une longue période, pourraient être diminuées par la surexpression de GRK6 dans le striatum. Dans cette situation, l’apport de L-dopa entraîne une augmentation massive des taux de dopamine dans le striatum (zone rose foncé sur la coupe de cerveau). Pour obtenir la surexpression de la protéine d’intérêt, le gène de GRK6 a été inséré dans un lentivirus. Ce lentivirus est ensuite chirurgicalement injecté dans le striatum. L’expression accrue des GRK6 (représenté par l’augmentation du nombre d’ovales jaunes) permet alors l’internalisation, donc le retrait de la surface des neurones des récepteurs de type D1, et, par conséquent, la diminution de la sévérité des mouvements anormaux involontaires. Les animaux dyskinétiques peuvent alors pleinement bénéficier du traitement à la L-dopa : leurs symptômes parkinsoniens sont améliorés et ils ne présentent plus de dyskinésies sévères. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Thibault D, Kortleven C, Fasano C, et al. Découvertes récentes sur la fonction et la plasticité des voies dopaminergiques du cerveau. Med Sci (Paris) 2010 ; 26 : 165-70. 2. Cotzias GC, Papavasiliou PS, Gellene R. Modification of Parkinsonism-chronic treatment with L-dopa. N Engl J Med 1969 ; 280 : 337-45. 3. Aubert I, Guigoni C, Hakansson K, et al. Increased D1 dopamine receptor signaling in levodopa-induced dyskinesia. Ann Neurol 2005 ; 57 : 17-26. 4. Guigoni C, Doudnikoff E, Li Q, et al. Altered D1 dopamine receptor trafficking in parkinsonian and dyskinetic non-human primates. Neurobiol Dis 2007 ; 26 : 452-63. 5. Berthet A, Porras G, Doudnikoff E, et al. Pharmacological analysis demonstrates dramatic alteration of D1 dopamine receptor neuronal distribution in the rat analog of L-DOPA-induced dyskinesia. J Neurosci 2009 ; 29 : 4829-35. 6. Bezard E, Gross CE, Qin L, et al. L-DOPA reverses the MPTP-induced elevation of the arrestin2 and GRK6 expression and enhanced ERK activation in monkey brain. Neurobiol Dis 2005 ; 18 : 323-35. 7. Ahmed MR, Berthet A, Bychkov E, et al. Lentiviral overexpression of GRK6 alleviates L-dopa-induced dyskinesia in experimental Parkinson’s disease. Sci Transl Med 2010 ; 2 : 28ra28. 8. Métayé T, Perdrisot R, Kraimps JL. GRK et arrestines : la piste thérapeutique ? Med Sci (Paris) 2006 ; 22 : 537-43. |