| |
| Med Sci (Paris). 2010 October; 26(10): 795–797. Published online 2010 October 15. doi: 10.1051/medsci/20102610795.Rôle du TGFβ dans un modèle d’anévrisme de l’aorte abdominale chez la souris Hafid Ait-Oufella,1 Yu Wang,1 Olivier Herbin,1 Alain Tedgui,1 and Ziad Mallat1* 1Centre de recherche cardiovasculaire de Paris, Inserm U970, hôpital européen Georges Pompidou, 56, rue Leblanc, 750 15 Paris, France MeSH keywords: Immunité acquise, physiologie, Animaux, Aorte abdominale, immunologie, anatomopathologie, Anévrysme de l'aorte abdominale, physiopathologie, Modèles animaux de maladie humaine, Humains, Macrophages, enzymologie, Matrix metalloproteinases, métabolisme, Souris, Facteur de croissance transformant bêta |
Les maladies anévrismales aortiques sont caractérisées par une faiblesse de la paroi aortique qui induit une dilatation progressive de l’aorte pouvant conduire à une rupture aortique. Le diagnostic clinique est difficile, leur découverte est souvent fortuite ou faite lors de compli cations potentiellement mortelles comme la rupture d’anévrisme [
1]. Les anévrismes représentent la troisième cause de décès d’origine cardiovasculaire et leur incidence augmente. Il est donc important d’en comprendre les mécanismes physiopathologiques afin de développer de nouvelles stratégies thérapeutiques. De façon schématique, les anévrismes syndromiques, qui correspondent aux formes familiales rencontrées dans le syndrome de Marfan1, ou le syndrome de Loeys-Dietz2 [
2] se distinguent des formes non syndromiques, beaucoup plus fréquentes et qui compliquent les lésions athéromateuses. Plusieurs travaux menés chez l’animal et chez l’homme suggèrent que le TGFβ (transforming growth factorβ) participe au développement de l’anévrisme [
3,
4]. Ces données proviennent essentiellement d’études menées chez les patients atteints du syndrome de Marfan dont la physiopathologie est probablement différente de celle de l’anévrisme aortique athéromateux. Ces résultats sont en contradiction avec le fait que le TFCβ est un médiateur qui favorise la survie des cellules vasculaires comme les cellules musculaires lisses, induit la synthèse de collagène, inhibe la dégradation de la matrice extracellu laire et possède également des propriétés anti-inflammatoires puissantes [
5]. Nous avons étudié le rôle du TGFβ dans un nou veau modèle murin d’anévrisme de l’aorte abdominale dont les caractéristiques physiopathologiques sont très proches de cel les de l’anévrisme de l’aorte abdominale athéromateuse humaine. |
Le modèle d’anévrisme de l’aorte abdominale L’infusion continue d’angiotensine II chez la souris (fond génétique C57BL/6) induit une hypertension artérielle et s’accompa gne d’une dilatation modérée de l’aorte abdominale sans rupture dans 10 à 20 % des cas. Nous avons montré que l’injection répétée d’anticorps bloquants anti-TGFβ chez des souris traitées par angiotensine II induisait des anévrismes de l’aorte abdo minale chez 100 % des animaux avec des complications mortelles chez 70 % d’entre eux [
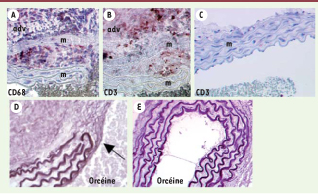
6]. Les complications visualisées a l’échographie et confirmées par l’examen histologique post-mortem comportent des dissections3, avec ou sans faux chenal et des ruptures rétropéritonéales. Nous avons confirmé que l’anticorps inhibiteur provoquait une forte diminution de l’ac tivité TGFβ dans le plasma des souris trai tées ainsi qu’une diminution importante de la phosphorylation de Smad24 dans la paroi aortique. L’analyse histologique des coupes aor tiques montrait une mort des cellu les musculaires lisses de la paroi, une dégradation de l’élastine, un amincisse ment des parois et un infiltrat inflamma toire (Figure 1). L’infiltration des cellules inflammatoires débute dès le troisième jour avec une accumulation de macro phages dans la média et l’adventice suivie d’un afflux de lymphocytes TCD3+.  | Figure 1
Coupes d’aorte abdominale de souris C57BI/6. Les souris ont reçu une infusion continue sous-cutanée d’angiotensine II avec (A, B, D) ou sans (C, E) administration d’un anticorps neutralisant anti-TGFβ : infiltration de macrophages (A, CD68 +, colorés en violet foncé) et de lymphocytes T (B, CD3 +, colorés en violet foncé) au niveau de l’adventice (adv) et de la média (m) de la paroi anévrismale. Les couches de la média sont disséquées, séparées les unes des autres et massivement infiltrées de cellules inflammatoires dans le cas de sections provenant de souris ayant reçu l’anti-TGFβ (A, B) par comparaison à l’inté grité de la média chez les souris n’ayant pas reçu l’anticorps (C). Destruction et interruption complète des couches d’élastine marquée à l’orcéine chez les souris ayant reçu l’anti-TGFβ (D) par comparaison aux souris n’ayant pas reçu l’anticorps (E) (adapté de Wang et al. [ 6]). |
|
Rôle de l’immunité adaptative L’analyse histologique suggère un rôle des lymphocytes T dans la physiopathologie de l’anévrisme de l’aorte abdomi nale. Le blocage pharmacologique (par des anticorps anti-interféron [IFN]-γ) ou génétique (souris Il-4
−/−, invalidées pour l’expression du gène codant l’interleukine 4 [IL-4]) de l’activation des lymphocytes T helper ne modifie ni l’in cidence ni la gravité des anévrismes de l’aorte abdominale, suggérant que ni les voies d’activation des lymphocytes Th1 ni celles des Th2 ne sont indispensables à la formation de l’anévrisme dans notre modèle murin. En revanche, il existe une diminution modérée mais significative de la mortalité par rupture anévrismale chez les souris Rag
−/− (souris déficientes en lymphocytes T et B du fait de l’in validation du gène Rag [recombina tion activating gene]), ce qui suggère le rôle dans la physiopathologie de la maladie de populations lymphocytaires autres que Th1/Th2, comme les lympho cytes B les lymphocytes Th17 et/ou les T régulateurs. |
Pour explorer le rôle des monocytes/ macrophages dans la formation des anévrismes, nous avons induit une déplétion des monocytes circulants par des injections répétées de clodronate encapsulé dans des liposomes, un biphosphonate qui induit l’apoptose des monocytes/macrophages. La déplétion monocytaire s’accompagne d’une réduction de 90 % du taux de mortalité par rupture anévrismale. Chez les sou ris survivantes 20 jours après le début des injections d’anticorps anti-TGFβ, la déplétion monocytaire induit égale ment une diminution de la sévérité de la maladie. Parallèlement, nous avons mis en évidence une diminution significative de la maladie chez les souris déficientes en CX3CR1 (CX3C motif chemokine receptor 1) et/ou CCR2 (C-C motif chemokine receptor 2), des récepteurs de chimiokines importants pour le recrutement des monocytes/macrophages. L’ensemble de ces données in vivo conforte l’idée que les monocytes/macrophages jouent un rôle central dans la physiopathologie de l’anévrisme de l’aorte abdominale. |
Rôle des métalloprotéases matricielles Les macrophages produisent de nom breux médiateurs qui peuvent participer à la formation de l’anévrisme de l’aorte abdominale. Dans un premier temps, nous avons examiné le rôle des cytoki nes. Ni l’injection répétée d’anticorps inhibiteurs anti-TNFα (tumor necrosis factor) ni la déficience génétique en IL6 n’altèrent l’incidence des anévrismes rompus, suggérant qu’aucune de ces deux cytokines ne joue un rôle majeur dans la physiopathologie de l’anévrisme de l’aorte abdominale. Nous avons ensuite examiné l’implication des métalloprotéinases (MMP) dans la dégradation de la matrice induite par le traitement anti-TGFβ. L’activité métalloprotéasique d’origine macrophagique, de type MMP-9 et MMP-12, est effectivement augmentée chez les souris traitées par l’anti-TGFβ. Surtout, les souris déficientes en MMP-12 sont protégées de la rupture aortique, ce qui souligne le rôle majeur de cette métalloélastase dans les complications de la maladie anévrismale. |
Discussion : pertinence du modèle murin en clinique humaine Nous avons développé un modèle d’anévrisme de l’aorte abdominale chez la souris en associant une infusion conti nue d’angiotensine II a des injections répétées d’anticorps neutralisants anti-TGFβ. Nous avons montré que le TGFβ était important pour la survie des cellules musculaires lisses vasculaires et l’intégrité matricielle de la paroi aortique. Le TGFβ diminue l’infiltration inflammatoire lymphocytaire et monocytaire. Il apparaît que les monocytes/ macrophages ont un rôle majeur dans la physiopathologie de la maladie aortique probablement via la production de métalloprotéinases, essentiellement la MMP-12. Les propriétés protectrices du TGFβ ne sont pas limitées a ce modèle puisque la neutralisation du TGFβ chez la souris hypercholestérolémique (modèle des souris apoE
−/−, déficientes en apolipoprotéine E) aggrave considérablement la maladie anévrismale aortique avec des ruptures fréquentes et précoces. Quelle est la pertinence clinique de ces données nouvelles et peuvent-elles être transposées à la maladie humaine ? Tout d’abord, notre modèle possède de nombreuses similitudes phénotypiques avec la maladie aortique athéromateuse caractérisée par une localisation préférentiellement abdominale et des complications à type de dissection, faux chenal et rupture. Sur le plan histologique, on retrouve également une infiltration inflammatoire, une apoptose des cel lules vasculaires et une dégradation de la matrice extracellulaire [
7]. Plusieurs études épidémiologiques ont mis en évidence un lien entre le polymorphisme du gène de l’enzyme de conversion de l’angiotensine (ACE DD)5 et l’existence d’anévrismes de l’aorte abdominale. Enfin, une étude récente a montré que l’association des polymorphismes ACE DD avec des polymorphismes du gène codant pour le récepteur du TGFβ (TGBR1, 6A) augmentait la prédispo sition au développement d’anévrismes de l’aorte abdominale [
8]. Nos résul tats semblent donc pertinents en ce qui concerne la pathologie anévrismale associée à l’athérosclérose, la forme la plus fréquente. En revanche, il n’est pas certain qu’ils puissent s’appliquer aux formes syndromiques d’anévrismes comme le syndrome de Marfan dont la physiopathologie est très différente. |
Nous avons développé un modèle murin d’anévrisme qui possède de nombreu ses similitudes avec la pathologie ané vrismale humaine associée à l’athé rosclérose. Nous avons démontré dans ce modèle le rôle protecteur du TGFβ vis-à-vis du développement d’anévris mes et de leurs complications, et l’im plication des monocytes/macrophages dans la maladie, via la production de métalloprotéinases, en particulier la MMP-12. Des travaux complémentai res sont nécessaires afin de préciser le rôle d’autres populations comme les mastocytes ou les lymphocytes B. |
Les auteurs déclarent n’avoir aucun conflit d’in térêts concernant les données publiées dans cet article. |
Footnotes |
1. Ernst CB. Abdominal aortic aneurysm. N Engl J Med 1993 ; 328 : 1167-72. 2. Loeys BL, Schwarze U, Holm T, et al. Aneurysm syndromes caused by mutations in the TGF-beta receptor. N Engl J Med 2006 ; 355 : 788-98. 3. Neptune ER, Frischmeyer PA, Arking DE, et al. Dysregulation of TGF-beta activation contributes to pathogenesis in Marfan syndrome. Nat Genet 2003 ; 33 : 407-11. 4. Nataatmadja M, West J, West M. Overexpression of transforming growth factor-beta is associated with increased hyaluronan content and impairment of repair in Marfan syndrome aortic aneurysm. Circulation 2006 ; 114 : 1371-7. 5. Gorelik L, Flavell RA. Transforming growth factor-beta in T-cell biology. Nat Rev Immunol 2002 ; 2 : 46-53. 6. Wang Y, Ait-Oufella H, Herbin O, et al. TGF-beta activity protects against inflammatory aortic aneurysm progression and complications in angiotensin Il-infused mice. J Clin Invest 2010 ; 120 : 422-32. 7. Koch AE, Haines GK, Rizzo RJ, et al. Human abdominal aortic aneurysms. Immunophenotypic analysis suggesting an immune-mediated response. Am J Pathol 1990 ; 137 : 1199-213. 8. Lucarini L, Sticchi E, Sofi F, et al. ACE and TGFBR1 genes interact in influencing the susceptibility to abdominal aortic aneurysm. Atherosclerosis 2009 ; 202 : 205-10. |