| |
| Med Sci (Paris). 2010 August; 26(8-9): 724–728. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9724.Faire et refaire une synapse en choisissant un partenaire Une question d’étiquette pour les neurones ? Mathieu Letellier,1,2* Rachel M. Sherrard,2 Ann M. Lohof,2 and Jean Mariani2,3 1MRC Laboratory for Molecular Cell Biology and Cell Biology Unit, University College London, Gower Street, WC1E 6BT Londres, Royaume Uni 2UPMC Université Paris 6 et CNRS, UMR7102 Neurobiologie des Processus Adaptatifs, 9, quai Saint-Bernard, F-75005 Paris, France 3AP-HP, Hôpital Charles Foix, UEF, F-94200 Ivry-sur-Seine, France |
Le système nerveux doit faire face à un problème fondamental : s’adapter en permanence à un environnement changeant tout en gardant un niveau de stabilité pour maintenir son intégrité et garantir une cohérence au niveau comportemental. Cet équilibre entre adaptation et stabilité évolue profondément au cours de la vie d’un organisme, en particulier pendant le développement du cerveau. Les circuits neuronaux, d’abord très plastiques et exubérants, sont en effet largement sculptés par l’action de facteurs environnementaux qui modifient l’activité des réseaux de neurones et à partir desquels se constitue l’expérience « vécue » du sujet. L’élimination de certaines connexions nerveuses conduit ainsi à la mise en place de circuits synaptiques appropriés. Chez l’adulte, ces derniers montrent en revanche une capacité beaucoup plus limitée à se réorganiser en fonction de l’expérience, maintenant ainsi le plan général d’organisation des connexions entre neurones. Cette simple observation suggère que l’architecture, ou « câblage », du système nerveux mise en place et stabilisée pendant le développement constitue chez l’adulte un cadre au sein duquel des événements de plasticité contrôlent les flux d’informations nerveuses et sous-tendent des processus tels que l’apprentissage et la mémoire. Si la relative stabilité de l’architecture du système nerveux adulte apparaît évidente dans une situation normale (physiologique), qu’advient-il lorsque les circuits synaptiques adultes sont rompus (situation pathologique) et que les neurones survivants forment de nouvelles connexions ? Ces dernières permettent-elles la récupération des fonctions cognitives perdues ? Si oui, cette reconstruction a-t-elle besoin d’être régulée de la même façon que pendant le développement, c’est-à-dire façonnée en partie par l’activité neuronale ? Des études récentes réalisées dans le cervelet montrent que des neurones adultes peuvent reformer des connexions précises et fonctionnelles sans pour autant reproduire les phases développementales d’exubérance et de raffinement des connexions synaptiques. Nous présentons ici ces découvertes et discutons la possibilité de la mise en place d’une « trace développementale » qui permettrait de maintenir ou de reformer des connexions spécifiques similaires à celles formées pendant le développement. |
L’activité synaptique distingue les connexions à éliminer de celles à stabiliser Quels sont les mécanismes qui, pendant le développement, conduisent à la stabilisation de certaines connexions synaptiques et à l’élimination d’autres ? Cette question reste largement ouverte, mais il est raisonnable de penser que les neurones, à un certain stade de leur développement, sont capables de distinguer les connexions à éliminer de celles qui doivent être conservées et que le processus de sélection n’est pas aléatoire mais contribue plutôt à la formation de circuits spécifiques et fonctionnels. Dès lors, un enjeu important pour comprendre la signification fonctionnelle de l’élimination synaptique consiste à identifier les critères de sélection utilisés par les neurones pour choisir les partenaires avec lesquels ils forment ou maintiennent des connexions. Parmi les systèmes utilisés pour aborder cette question, le cervelet est un modèle intéressant car son développement, bien décrit, se produit en grande partie après la naissance, ce qui permet donc une investigation relativement aisée chez le rongeur. Dans ce système, les cellules de Purkinje sont transitoirement innervées par plusieurs afférences appelées fibres grimpantes (axones en provenance de l’olive bulbaire) avant que l’élimination massive de synapses surnuméraires ne conduise à la sélection d’une seule et unique fibre grimpante qui se stabilise chez l’adulte (Figure 1). Quels critères permettent la stabilisation sélective d’une seule fibre grimpante parmi plusieurs sur un neurone cible ? Des études d’électrophysiologie suggèrent l’existence d’une compétition entre les différentes fibres grimpantes, dont l’issue serait principalement dépendante de l’activité synaptique. Ainsi, les réponses synaptiques produites au niveau d’une même cellule de Purkinje par différentes fibres grimpantes sont d’abord d’am- plitudes homogènes puis évoluent différemment, si bien que l’une des fibres grimpantes produit des réponses de plus en plus fortes comparativement à celles de ses « concurrentes » qui finissent par être éliminées [
1–
3] (Figure 3). Des études suggèrent que des mécanismes de plasticité synaptique permettent à la connexion forte de se renforcer de plus en plus facilement (rétrocontrôle positif) sur les dendrites alors que les autres connexions restent faibles avant d’être éliminées du corps cellulaire [
2,
4].  | Figure 1
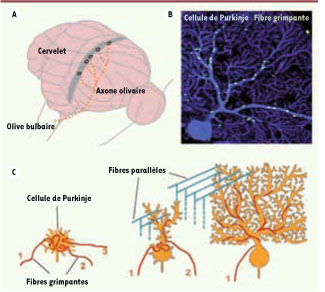
Organisation et développement de la voie olivo-cérébelleuse chez le rongeur. A. La voie olivo-cérébelleuse correspond à la projection des neurones olivaires (situés dans le tronc cérébral) sur les cellules du cervelet.
B.
Chez l’adulte, l’axone olivaire (en vert) s’enroule autour de l’arbre dendritique des cellules de Purkinje (en bleu) pour former des connexions spécifiques.
C.
Pendant leur développement, les cellules de Purkinje sont transitoirement innervées par plusieurs fibres grimpantes avant la sélection d’une seule d’entre elles par élimination sélective des fibres surnuméraires. Les fibres parallèles (en bleu), une autre afférence de la cellule de Purkinje, qui sont les axones des cellules granulaires, jouent un rôle crucial pour la régression de la multi-innervation par les fibres grimpantes. |
En cohérence avec l’hypothèse d’un rôle déterminant de l’activité synaptique, les récepteurs synaptiques au glutamate et des voies de signalisation en aval ont été identifiés comme des acteurs importants, au moins dans les dernières étapes, de l’élimination des synapses surnuméraires (Figure 3). En particulier, des signaux en provenance des synapses de fibres parallèles, une autre afférence excitatrice, et qui impliquent le récepteur GRID2 (récepteur ionotropique au glutamate δ2) semblent jouer un rôle crucial pour l’élimination des synapses surnuméraires [
5]. De même, une série d’études a révélé la contribution dans la phase finale de l’élimination des fibres grimpantes des signalisations induites par l’activation du récepteur synaptique mGluR1 (récepteur métabotropique du glutamate 1), présent sur la cellule de Purkinje aux synapses de fibres grimpantes et de fibres parallèles [5], et un rôle du récepteur de type NMDA exprimé par les cellules granulaires. |
Une période critique pour l’élimination synaptique : conséquences pour la restauration de synapses chez l’adulte Les processus de compétition et d’élimination synaptiques interviennent pendant une période déterminée du développement post-natal [
6]. Afin de connaître les possibilités de réparation des circuits nerveux après une lésion, il est important de savoir si les mécanismes développementaux de la formation de connexions synaptiques entre partenaires synaptiques spécifiques peuvent être réexprimés, notamment chez l’adulte. Dans le système olivo-cérébelleux, une première réponse a été apportée grâce à l’étude de Kakizawa et al. [
7] montrant que la phase finale du processus d’élimination synaptique dépendant de l’activation des récepteurs au glutamate de type NMDA est restreinte à une période critique du développement correspondant aux 15e et 16e jours postnataux chez la souris. Plus récemment, nous avons montré, grâce à un système de coculture, que des cellules de Purkinje matures innervées « trop tard » (c’est-à-dire après la période normale de stabilisation et d’élimination synaptiques) sont incapables d’éliminer leurs afférences surnuméraires [3] (Figure 2). De façon intéressante, le processus de différenciation fonctionnelle des synapses de fibres grimpantes, immatures ou matures, est très altéré, si bien qu’aucune des afférences ne sort « gagnante » ou n’est éliminée. Cette observation montre que l’ensemble du processus de compétition et d’élimination synaptiques est contraint dans une période critique du développement de la cellule de Purkinje mais pas des neurones olivaires, ce qui souligne le rôle prépondérant de la cible post-synaptique dans la sélection de son afférence. Si cette observation se généralise à d’autres systèmes, la perte de la capacité du neurone post-synaptique à éliminer des synapses surnuméraires chez l’adulte doit être prise en compte dans le développement éventuel de thérapies cellulaires qui visent à remplacer des populations neuronales à l’aide de cellules souches. À la lumière de ces résultats, il apparaît indispensable de prendre en compte la capacité des cellules immatures injectées ou greffées à établir de nouvelles connexions synaptiques précises et fonctionnelles avec les neurones adultes du cerveau hôte, en particulier leur capacité à sélectionner des partenaires synaptiques. 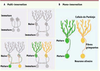 | Figure 2
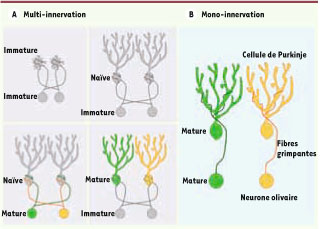
Rôle de la maturation des partenaires synaptiques dans l’établissement de la multi-innervation : mise en évidence d’une trace développementale. Des expériences de coculture ont montré que la multi-innervation des cellules de Purkinje
(A)
s’établit toujours lorsqu’au moins l’un des partenaires synaptiques est immature ou naïf (en gris) alors que la mono-innervation
(B)
s’établit ou se maintient lorsque les deux partenaires synaptiques sont matures et ont déjà vécu l’élimination synaptique développementale (vert et orange). Cette observation suggère la mise en place d’une trace développementale permettant le maintien de connexions entre partenaires compatibles (ici, de même couleur). |
 | Figure 3
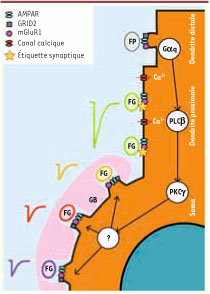
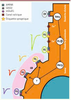
L’hypothèse de l’étiquette synaptique. Pendant le développement, une fibre grimpante stabilise et renforce ses synapses sur les dendrites de la cellule de Purkinje produisant une réponse post-synaptique de plus en plus forte (en vert) alors que les synapses formées par d’autres fibres grimpantes sur le soma produisent des réponses qui restent faibles avant d’être éliminées. Les mécanismes de l’élimination des fibres grimpantes surnuméraires restent en grande partie inconnus mais des signalisations en provenance des synapses de fibres parallèles (en particulier la signalisation faisant intervenir les récepteurs métabotropiques mGluR1 et des protéines en aval) semblent contribuer au processus. Une hypothèse possible est que les synapses de la fibre grimpante sélectionnée (stabilisée) sont protégées du processus d’élimination grâce à l’expression d’étiquettes moléculaires spécifiques les protégeant des mécanismes de dégradation. De telles étiquettes pourraient marquer définitivement les partenaires synaptiques et garantir ainsi la spécificité des connexions chez l’adulte et permettre la reformation de connexions spécifiques après une lésion, selon un modèle de reconnaissance clé-serrure. FP : fibre parallèle ; FG : fibre grimpante ; GB : glie de Bergmann ; Gαq : protéine Gαq ; PLCβ : phospholipase Cβ ; PKCγ : protéine kinase Cγ. |
|
Mise en évidence d’une empreinte neuronale laissée par les interactions synaptiques : conséquences pour la restauration de synapses Lichtman et Colman [
8] ont proposé que l’élimination synaptique pourrait instituer une mémoire indélébile à long terme car l’élimination sélective de synapses pendant le développement du système nerveux est définitive (stable) et structure les circuits synaptiques pour le reste de la vie. Des études récentes apportent des arguments en faveur de cette idée en montrant que la stabilisation de synapses pendant le développement est impliquée dans la constitution de mémoires et conditionne les comportements durant toute la vie d’un organisme [
9,
10]. Une question corollaire est celle de la restauration des synapses dans le système nerveux adulte mature après une lésion : des neurones matures sont-ils capables de reformer des circuits synaptiques ? Nos études récentes menées in vivo et in vitro suggèrent que tel est le cas des neurones du cervelet mature qui, s’ils ont précédemment formé des synapses, sont capables de reformer des circuits synaptiques spécifiques et fonctionnels après une lésion [
11–
13]. De façon plus surprenante, ces travaux montrent que le processus de réinnervation postlésionnelle conduit à la mono-innervation des cellules de Purkinje matures, alors que ces cellules sont en principe incapables d’éliminer des fibres grimpantes surnuméraires après la fin de la période critique [3,
12]. Ces études ont montré que la maturation neuronale empêche l’établissement de connexions synaptiques redondantes en favorisant l’établissement de connexions précises d’emblée (mono-innervation directe). Plus récemment, des expériences de cocultures utilisant des explants maintenus in vitro [3] ont montré que la maturation de la cellule de Purkinje, mais aussi celle du neurone olivaire, contrôle la mise en place de l’exubérance synaptique (Figure 2). La multi-innervation s’établit toujours lorsqu’au moins l’un des partenaires établit des connexions pour la première fois (quel que soit son âge) mais beaucoup plus rarement lorsqu’ils sont tous les deux matures et ont déjà « vécu » le processus de sélection synaptique pendant le développement. Ces observations montrent que l’établissement de l’exubérance synaptique ne dépend pas de l’âge des neurones mais des interactions synaptiques qu’ils ont eues auparavant. Ainsi, la sélection d’une afférence parmi plusieurs pendant une période critique du développement semble modifier durablement les neurones, limitant fortement leur capacité à former une seconde fois des connexions avec des partenaires multiples non spécifiques. |
L’hypothèse de l’étiquetage moléculaire des synapses pour la formation et la stabilisation de synapses spécifiques S’il est maintenant clair que les fibres grimpantes se distinguent les unes des autres d’un point de vue fonctionnel pendant le développement, les mécanismes moléculaires permettant d’éliminer sélectivement les synapses de fibres grimpantes « perdantes » tout en épargnant les synapses « gagnantes » pendant le développement demeurent inconnus. Une première hypothèse pour expliquer cette élimination sélective vient des observations récentes de Hashimoto et al. [
14]. Celles-ci suggèrent une compartimentation des signaux responsables de l’élimination synaptique qui affecteraient sans distinction l’ensemble des synapses de fibres grimpantes formées sur le corps cellulaire mais pas les synapses formées sur les dendrites. Ainsi, une seule et unique fibre grimpante « sélectionnée » échapperait au processus d’élimination en stabilisant ses synapses sur les dendrites (Figures 1 et 3). Ceci étant, d’autres observations montrent que l’élimination et la stabilisation sélective de synapses peuvent prendre place dans un même compartiment subcellulaire (corps cellulaire ou dendrites), dans certaines situations physiologiques ou expérimentales [3,
15,
16]. Compte tenu de ces observations, nous proposons l’hypothèse alternative suivante : les signaux responsables de l’élimination synaptique sont capables de discriminer les synapses « gagnantes » des synapses « perdantes » dans un même compartiment grâce à l’expression d’« étiquettes moléculaires ». Selon ce modèle, la stabilisation et le renforcement des synapses de la fibre grimpante « gagnante » [2, 4] induisent l’adressage de protéines « étiquettes » qui, à leur tour, peuvent recruter des complexes protéiques protégeant ces synapses de l’élimination (Figure 3). Cette hypothèse s’accorde bien avec celle du synaptic tagging proposée dans l’hippocampe (une structure impliquée dans l’apprentissage et la mémoire) pour expliquer le maintien de la potentialisation synaptique à très long terme [
17] grâce à l’expression de protéines « étiquettes » spécifiquement exprimées au niveau des synapses activées. L’existence de telles protéines reste à démontrer dans la cellule de Purkinje, mais il est intéressant de remarquer qu’un système similaire d’étiquetage synaptique existe dans des organismes plus simples tels que le ver Caenorhabditis elegans où des complexes impliquant des molécules d’adhésion guident la formation de synapses au bon endroit sur la cellule cible et protègent de façon sélective les synapses à stabiliser des mécanismes cellulaires de dégradation [
18]. Un tel système d’étiquetage moléculaire, qui utilise par exemple des molécules d’adhésion synaptiques, pourrait permettre de spécifier les connexions stabilisées pendant le développement et assurer le maintien ou la restauration des connexions spécifiques et fonctionnelles entre partenaires compatibles chez l’adulte, selon un modèle « cléserrure ». |
Ces études réalisées dans le cervelet montrent que des neurones adultes peuvent reformer des connexions précises et fonctionnelles sans pour autant reproduire les phases développementales d’exubérance et de raffinement des connexions synaptiques. Cette différence frappante dans la façon de reformer des connexions précises chez l’adulte tient à ce que les étapes du développement laissent une « trace »> neuronale. Cette découverte souligne l’importance capitale des étapes d’élimination et de stabilisation des connexions synaptiques dans le système nerveux central pendant le développement. Celles-ci influencent profondément la capacité des neurones adultes à reformer ou simplement maintenir des connexions spécifiques, précises et fonctionnelles. D’un point de vue plus général, cette découverte souligne le fait que les neurones « apprennent » de leurs interactions avec leurs partenaires cellulaires. Nous proposons que, dans un système où les synapses stabilisées pendant le développement seraient spécifiées par un système d’étiquettes moléculaires, ces dernières permettent le maintien ou la reformation de connexions entre partenaires compatibles. Ce mécanisme permettrait de garantir un niveau de stabilité et de spécificité dans l’organisation des circuits synaptiques, laquelle conditionne les comportements. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Hashimoto K, Kano M. Functional differentiation of multiple climbing fiber inputs during synapse elimination in the developing cerebellum. Neuron 2003 ; 38 : 785-96. 2. Bosman LW, Takechi H, Hartmann J, et al. Homosynaptic long-term synaptic potentiation of the winner climbing fiber synapse in developing Purkinje cells. J Neurosci 2008 ; 28 : 798-807. 3. Letellier M, Wehrle R, Mariani J, et al. Synapse elimination in olivo-cerebellar explants occurs during a critical period and leaves an indelible trace in Purkinje cells. Proc Natl Acad Sci USA 2009 ; 106 : 14102-7. 4. Ohtsuki G, Hirano T. Bidirectional plasticity at developing climbing fiberpurkinje neuron synapses. Eur J Neurosci 2008 ; 28 : 2393-400. 5. Kano M, Hashimoto K. Synapse elimination in the central nervous system. Curr Opin Neurobiol 2009 ; 19 : 154-61. 6. Bourgeois JP. Synaptogenèses et épigenèses cérébrales. Med Sci (Paris) 2005 ; 21 : 428-33. 7. Kakizawa S, Yamasaki M, Watanabe M, et al. Critical period for activity-dependent synapse elimination in developing cerebellum. J Neurosci 2000 ; 20 : 4954-61. 8. Lichtman JW, Colman H. Synapse elimination and indelible memory. Neuron 2000 ; 25 : 269-78. 9. Hofer SB, Mrsic-Flogel TD, Bonhoeffer T, et al. Experience leaves a lasting structural trace in cortical circuits. Nature 2009 ; 457 : 313-7. 10. Yang G, Pan F, Gan WB. Stably maintained dendritic spines are associated with lifelong memories. Nature 2009 ; 462 : 920-4. 11. Dixon KJ, Sherrard RM. Brain-derived neurotrophic factor induces postlesion transcommissural growth of olivary axons that develop normal climbing fibers on mature purkinje cells. Exp Neurol 2006 ; 202 : 44-56. 12. Letellier M, Bailly Y, Demais V, et al. Reinnervation of late postnatal purkinje cells by climbing fibers: neosynaptogenesis without transient multi-innervation. J Neurosci 2007 ; 27 : 5373-83. 13. Willson ML, McElnea C, Mariani J, et al. BDNF increases homotypic olivocerebellar reinnervation and associated fine motor and cognitive skill. Brain 2008 ; 131 : 1099-112. 14. Hashimoto K, Ichikawa R, Kitamura K, et al. Translocation of a winner climbing fiber to the Purkinje cell dendrite and subsequent elimination of losers from the soma in developing cerebellum. Neuron 2009 ; 63 : 106-18. 15. Scelfo B, Strata P, Knopfel T. Sodium imaging of climbing fiber innervation fields in developing mouse Purkinje cells. J Neurophysiol 2003 ; 89 : 2555-63. 16. Guenet JL, Sotelo C, Mariani J. Hyperspiny Purkinje cell, a new neurological mutation in the mouse. J Heredity 1983 ; 74 : 105-8. 17. Frey U, Morris RG. Synaptic tagging and long-term potentiation. Nature 1997 ; 385 : 533-6. 18. Ding M, Chao D, Wang GM, et al. Spatial regulation of an E3 ubiquitin ligase directs selective synapse elimination. Science 2007 ; 317 : 947-51. |