| |
| Med Sci (Paris). 2010 August; 26(8-9): 696–698. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9696.Comment percer les mystères de la ségrégation asymétrique de l’ADN pendant la mitose Traduction de l’anglais de Laure Coulombel Shahragim Tajbakhsh* Département de biologie du développement, cellules souches et développement, Institut Pasteur, 25, rue du Docteur Roux, 75015 Paris, France MeSH keywords: Animaux, Chromatides, génétique, ADN, Humains, Mammifères, Mitose |
Une ségrégation asymétrique (ou ségrégation biaisée) de l’ADN au cours de la mitose - c’est-à-dire une répartition des chromatides sœurs non aléatoire dans les deux cellules filles - a été décrite chez nombre d’organismes, des bactéries aux vertébrés [
1]. Chez les eucaryotes, ce processus peut impliquer un nombre variable de chromatides, voire toutes. On connaît mal les mécanismes contrôlant ce processus fascinant, mais plusieurs études récentes ont apporté un éclairage nouveau et suggéré des pistes. Nous en évoquerons deux, publiées récemment [
2,
3], et qui utilisent le modèle emblématique des cellules de la crypte intestinale [
4]. L’hypothèse initiale chez les eucaryotes supérieurs est qu’une ségrégation asymétrique des brins d’ADN assurait une « protection » contre les erreurs de réplication de l’ADN, survenant dans le brin néoformé. Le brin « mère » étant retenu dans les cellules souches, l’accumulation de mutations potentiellement dangereuses y est évitée. C’est ce que l’on appelle « l’hypothèse du brin immortel » [
5,
6]. Mais il est difficile techniquement de suivre la distribution des brins d’ADN sur plusieurs générations de cellules, ce qui explique que l’hypothèse d’immortalité soit difficile à prouver formellement [
7]. De plus, d’autres explications ont été proposées, dont la régulation épigénétique de l’expression génique pendant les décisions entre l’autorenouvellement et la différenciation [1, 7–
11]. |
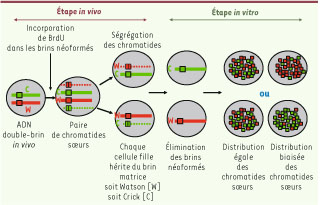
La ségrégation asymétrique des chromatides sœurs observée chromosome par chromosome… Deux études récentes enrichissent ce débat déjà très animé à propos de la ségrégation biaisée de l’ADN qui confronte les chercheurs à un véritable défi expérimental. La première, publiée dans Nature [2], explore l’hypothèse d’une non-équivalence des chromatides sœurs1 dont la distribution entre les cellules filles ne se ferait pas au hasard. L’équipe de Peter Lansdorp réussit une prouesse technologique qui permet de tester cette hypothèse : il distingue par marquage les chromatides sœurs à l’échelle chromosomique et analyse leur ségrégation lors de la mitose suivante. Le modèle est celui des cellules de la crypte intestinale. Une approche d’hybridisation in situ ciblée sur un chromosome (CO-FISH, chromosome orientation fluorescence in situ hybridisation) permet de suivre le devenir de chacun des deux brins de l’ADN individuellement (Figure 1). Une incorporation de BrdU limitée à un cycle de réplication (pulse suivi d’une chasse) aboutit au seul marquage des brins d’ADN néoformés. On peut ensuite faire disparaître ces brin BrdU+ en incubant les cellules filles avec du Hoechst 33258 (un intercalant de l’ADN), puis en les exposant aux rayons ultraviolets. Cela induit des cassures dans les brins marqués, ensuite éliminés par une digestion à l’exonucléase. Seul persiste dans la cellule le brin matrice, qui est ensuite hybridé avec des sondes spécifiques reconnaissant des séquences répétées au niveau des télomères (désigné comme Watson ou Crick arbitrairement) (Figure 1). Ces sondes reconnaissent tous les chromosomes à l’exception des chromosomes 4, 18 et Y (où elles reconnaissent les deux brins W et C).  | Figure 1
Stratégie expérimentale d’analyse de la distribution des chromatides sœurs
(d’après [
14
]). |
Les auteurs ont appliqué cette technique d’analyse aux paires de cellules filles de la crypte intestinale in vivo. C. Potten a, il y a une dizaine d’années, démontré la ségrégation biaisée des brins d’ADN dans ce modèle cellulaire et a bâti à partir de ces observations l’hypothèse du « brin immortel » dans la crypte intestinale [6, 7]. Mais la ségrégation de l’ADN n’avait pas été analysée avec une telle résolution au niveau de chromosomes individuels. L’application du CO-FISH confirme la ségrégation biaisée de l’ADN lors de la mitose dans les cellules des cryptes intestinales, et démontre qu’il concerne les deux-tiers, voire les troisquarts des chromatides. Dans quelques cas, la distribution des brins Watson et Crick est très biaisée, de type 90 %/10 %. Les auteurs se sont assurés que ce biais de distribution n’était pas dû au hasard. Cette observation est surprenante, et en contradiction avec les résultats précédents où tous les brins BrdU+ ségrégaient dans une des cellules filles, l’autre n’héritant d’aucun de ces brins [
8,
12], bien que la résolution était moindre et certainement pas faite à l’échelle d’un seul chromosome. Si la ségrégation biaisée de l’ADN est maintenant démontrée sans ambiguïté, reste à savoir si elle concerne tous les chromosomes ou une partie d’entre eux seulement. Autre point important : quelle en est la signification, et dans quels types cellulaires survient-elle ? S’agitil exclusivement de cellules souches ou de précurseurs plus matures, ou les deux ? On se heurte dans ce cas précis au problème de l’identification des cellules souches de la crypte intestinale : au moins deux populations de CS ont été décrites : les cellules Lgr5+ au fond de la crypte, les cellules Bmi1+ en position + 4 [
13]. Falconer et al. ne répondent pas précisément à la question même si l’ob- servation d’une ségrégation asymétrique dans des cellules au fond de la crypte laisse penser que certaines cellules sou- ches Lgr5+ sont concernées. Un autre point intéressant concerne l’organisation des chromatides Watson et Crick dans les deux cellules filles : lors de leur ségréga- tion, elles se positionnent « en miroir » au niveau des centrosomes, suggérant qu’il y peu de déplacement et de mélange des chromatides individuelles lors de leur ségrégation, même si celle-ci est biaisée. |
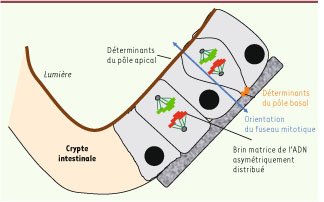
Orientation du fuseau mitotique et ségrégation biaisée de l’ADN : deux facettes du même phénomène ? La seconde étude de Quyn et al. [3] tire aussi parti du modèle des cellules de la crypte intestinale pour analyser (par microscopie multiphotonique) le lien entre la ségrégation biaisée de l’ADN et un autre mécanisme d’asymétrie : l’orientation du fuseau mitotique. L’étude est faite en parallèle chez la souris et l’homme avec des résultats similaires. Dans les cellules en position + 1 à + 7 par rapport au fond de la crypte - dont la plupart, à ce niveau, sont des cellules souches -, le fuseau s’oriente perpendiculairement à la lumière alors que dans les cellules en position + 7 et au-delà, c’est-à-dire dans les progéniteurs dits « transit amplifying cells » en phase de prolifération, il est orienté parallèllement et beaucoup moins fréquemment perpendiculairement à la lumière. L’orientation perpendiculaire du fuseau aboutit lors de la mitose à deux cellules filles qui ne seront plus dans la même « niche » et dont une seule est proposée comme étant « souche ». Cela signifie que la fréquence des divisions asymétriques diminue quand on s’éloigne de la crypte en progressant le long de la villosité, où on trouve des précurseurs plus matures. Or, cette différence dans l’orientation du fuseau mitotique entre cellules souches et transit amplifying cells s’atténue si l’on analyse les cryptes des animaux hétérozygotes mutés pour le gène Apc (adenomatous polyposis coli), Apc
min/+, qui développent des lésions précancéreuses. Les mutations de ce gène sont associées, chez la souris comme chez l’homme, au développement quasi-constant de tumeurs. Ces mêmes altérations de l’orientation du fuseau sont aussi observées dans les cellules souches germinales des mutants drosophile Apc, et entraînent la perte de ce compartiment souche [14]. Peut-on voir un lien entre la ségrégation biaisée des brins d’ADN, qui est avéré dans les cellules de la crypte, l’orientation du fuseau mitotique et la présence d’Apc ? Pour analyser spécifiquement les marqueurs d’asymétrie et notamment la distribution des brins d’ADN pendant la mitose des cellules souches, les auteurs les ont d’abord éliminées par irradiation, puis administré aux souris une dose d’EdU (5-éthynyl-2-désoxyuridine) ; ils ont examiné les tissus des animaux 8 jours après, ce qui laisse le temps au tissu de se régénérer. Dans ces conditions, le marqueur est dilué dans les transit amplifying cells alors qu’il sera retenu dans les cellules souches qui auront recolonisé les cryptes mais seront quiescentes. De fait, les cellules ayant retenu le marqueur (LRC, label retaining cells) ont été observées au fond la crypte mais également en position + 4, confirmant les deux localisations des cellules souches décrites précédemment [13], même s’il est difficile d’affirmer leur caractère souche en raison des difficultés techniques. Dans les rares mitoses des cellules LRC, l’ADN marqué (EdU) était distribué de façon asymétrique et localisé au pôle basal de la cellule, le fuseau mitotique étant orienté perpendiculairement à la lumière. Il y a donc une corrélation entre l’orientation perpendiculaire du fuseau et la distribution asymétrique de l’ADN. Chez le mutant Apc
min/+
, il y a une perte prononcée du nombre des LRC et un faible nombre de mitoses. La perte du compartiment des cellules souches, qui est encore plus prononcée dans le côlon, peut refléter un épuisement de cette population, les cellules se divisant plus fréquemment, ou ayant perdu la propriété de ségrégér asymétriquement l’ADN, ou les deux. En raison du faible nombre de figures mitotiques comptées, il est difficile actuellement d’impliquer Apc dans la régulation de la ségrégation biaisée de l’ADN. Mais on peut néanmoins émettre l’hypothèse selon laquelle Apc intervient dans ce mécanisme, ce que suggèrent d’ailleurs Falconer et al. [2]. On peut aussi faire l’hypothèse que Apc contrôlerait l’orientation du fuseau mitotique. C’est d’autant plus probable que le mutant Apc
min/+ utilisé est tronqué dans sa partie carboxy-terminale, ce qui n’affecte pas la signalisation Wnt, dont Apc est un intermédiaire-clé. Au-delà de ce qu’elle nous apprend du contrôle du destin normal des cellules souches intestinales, l’analyse des processus d’asymétrie de ségrégation de l’ADN et de leur lien avec l’orientation du fuseau mitotique nous rèvèle qu’une perte d’asymétrie pourrait être liée à l’émergence tumorale. Il est intéressant de noter que, chez les patients atteints de polypose adénomateuse colique familiale, l’orientation du fuseau est effectivement altérée.  | Figure 2
Mécanismes contrôlant les divisions asymétriques des cellules souches de la crypte (d’après [ 14]). |
|
Il sera nécessaire d’approfondir ces études en utilisant ces techniques à haute résolution au cours du développement tissulaire et également en période postnatale, pour établir une cartographie de ces processus, en particulier dans les compartiments des cellules souches et des progéniteurs en aval. Ensuite, il sera important d’analyser les conséquences fonctionnelles d’une rupture de cette asymétrie de ségrégation, à la fois sur le phénotype cellulaire et sur le contrôle épigénétique, y compris chez des animaux âgés. Quoiqu’il en soit, la non-équivalence des brins de l’ADN est maintenant un fait avéré. Ce domaine fascinant nous réserve bien des surprises scientifiques dans l’avenir. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Tajbakhsh S, Gonzalez C. Biased segregation of DNA and centrosomes: moving together or drifting apart? Nat Rev Mol Cell Biol 2009 ; 10 : 804-10. 2. Falconer E, Chavez EA, Henderson A, et al. Identification of sister chromatids by DNA template strand sequences. Nature 2010 ; 463 : 93-7. 3. Quyn AJ, Appleton PL, Carey FA, et al. Spindle orientation bias in gut epithelial stem cell compartments is lost in precancerous tissue. Cell Stem Cell 2010 ; 6 : 175-81. 4. Joubert D, Hollande F, Jay P, Legraverend C. Les cellules souches intestinales : 30 ans d’une histoire exemplaire. Med Sci (Paris) 2009 ; 25 : 441-4. 5. Rocheteau P, Tajbakhsh S. ADN immortel ou signature épigénétique ? Med Sci (Paris) 2008 ; 24 : 847-52. 6. Potten CS, Owen G, Booth D. Intestinal stem cells protect their genome by selective segregation of template DNA strands. J Cell Sci 2002 ; 115 : 2381-8. 7. Lansdorp PM. Immortal strands? Give me a break. Cell 2007 ; 129 : 1244-7. 8. Shinin V, Gayraud-Morel B, Gomès D, Tajbakhsh S. Asymmetric division and cosegregation of template DNA strands in adult muscle satellite cells. Nat Cell Biol 2006 ; 8 : 677-87. 9. Tajbakhsh S, Rocheteau P, Le Roux I. Asymmetric cell divisions and asymmetric cell fates. Annu Rev Cell Dev Biol 2009 ; 25 : 671-99. 10. Klar AJ. Support for the selective chromatid segregation hypothesis advanced for the mechanism of left-right body axis development in mice. Breast Dis 2008 ; 29 : 47-56. 11. Armakolas A, Klar AJ. Cell type regulates selective segregation of mouse chromosome 7 DNA strands in mitosis. Science 2006 ; 311 : 1146-9. 12. Conboy MJ, Karasov AO, Rando TA. High incidence of non-random template strand segregation and asymmetric fate determination in dividing stem cells and their progeny. PLoS Biol 2007 ; 5 : e102. 13. Li L, Clevers H. Coexistence of quiescent and active adult stem cells in mammals. Science 2010 ; 327 : 542-5. 14. Yamashita YM. A new member of the spindle orientation club: mammalian intestinal stem cells. Cell Stem Cell 2010 ; 6 : 91-2. |