| |
| Med Sci (Paris). 2010 August; 26(8-9): 694–695. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9694.Looping angiogenesis Angiogenèse d’un troisième type contrôlée par les forces contractiles Vivianne Greenwood2 and Witold W. Kilarski1* 1Department of Medical Biochemistry and Microbiology, Biomedical Center University of Uppsala, Uppsala, Suède 2École polytechnique fédérale de Lausanne, Lausanne, Suisse MeSH keywords: Animaux, Vaisseaux sanguins, croissance et développement, Matrice extracellulaire, physiologie, ultrastructure, Humains, Souris, Néovascularisation pathologique, anatomopathologie, physiopathologie, Néovascularisation physiologique |
Comment vasculariser le tissu de granulation lors de la cicatrisation d’une plaie Le processus de guérison d’une plaie cutanée met en jeu des mécanismes cellulaires et moléculaires destinés à reconstruire les tissus lésés et à les revasculariser. Plusieurs séquences se succèdent : le caillot de fibrine initial est d’abord colonisé, outre par les cellules immunitaires et les « éboueurs » professionnels, par des fibroblastes activés (myofibroblastes) qui forment le tissu dit de granulation et synthétisent une matrice extracellulaire [
1]. Ce tissu est progressivement vascularisé et remplace la matrice de fibrine qui colmatait la brèche initiale [
2]. Cette néovascularisation doit être rapidement mise en place pour assurer l’efficacité de la cicatrisation : classiquement, la revascularisation des tissus met en jeu des mécanismes à la fois de type angiogénique, c’est-à-dire la croissance des capillaires veineux via le bourgeonnement et l’intussusception, et de type vasculogenèse [2–
6]. La vasculogenèse est un processus presque exclusivement embryonnaire et rarement décrit chez les organismes adultes ; il résulte de la formation de nouveaux vaisseaux via le recrutement et l’assemblage de précurseurs de cellules endothéliales présents dans l’environnement, et fait donc intervenir des mécanismes de prolifération et de migration cellulaires. L’angiogenèse est un processus physiologique au cours de l’organogenèse embryonnaire et, chez l’adulte, il est activé dans des conditions pathologiques. La formation de nouveaux tubes capillaires se fait soit par un processus de bourgeonnement (sprouting) à partir des extrémités et des parois latérales des vaisseaux préexistants, soit par invagination (intussusception). Le premier est contrôlé par des facteurs de croissance, par exemple le vascular endothelial growth factor (VEGF), mais aussi par des structures et molécules guidant la direction de la croissance des nouveaux vaisseaux [
7]. L’intussusception consiste en une prolifération de cellules endothéliales matures à l’intérieur du vaisseau, généralement induite par la poussée qu’exercent sur la paroi vasculaire les cellules musculaires lisses externes. Des ponts traversant le vaisseau se forment et se remodèlent en deux ou plus nouveaux vaisseaux [6]. Or, aucun de ces mécanismes ne paraît adapté à la formation rapide d’un réseau vasculaire que requiert la réponse à un traumatisme des tissus cutanés, ni ne peut expliquer l’observation, dès 24 heures après la plaie, des premiers vaisseaux. |
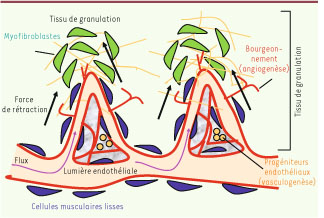
Angiogenèse d’un troisième type : l’étirement mécanique des vaisseaux préexistants Nous décrivons dans ce travail un troisième mécanisme de néovascularisation qui repose entièrement sur des forces mécaniques et semble fonctionner indépendamment des mécanismes traditionnels de vasculogenèse et d’angiogenèse [
8]. Ces forces émanent de la tension que crée la présence de fibroblastes contractiles différenciés dans la matrice extracellulaire et induiraient la translocation de vaisseaux préexistants de l’environnement. Les myofibroblastes compriment le tissu autour et à l’intérieur de la plaie ainsi que dans le tissu de granulation, exerçant une force qui allonge les tubes capillaires et veinules et les entraîne vers la plaie et profondément dans le tissu de granulation (Figure 1). Il n’y a pas de rupture de continuité avec les réseaux préexistants et le flux sanguin ne s’interrompt pas pendant ce processus de translocation vasculaire. À partir de cette boucle vasculaire formée par les forces contractiles, le réseau capillaire se construit et se perfectionne dans la zone cicatricielle via les mécanismes habituels d’angiogenèse, bourgeonnement et intussusception. Outre qu’il est rapide et donc adapté à la demande locale, ce mécanisme de « looping » est aussi beaucoup moins gourmand en énergie que l’angiogenèse classique. Pour le mettre en évidence et comprendre l’importance des forces de tension et de compression dans sa formation, nous avons utilisé deux modèles expérimentaux : le premier est une modification du modèle de la vascularisation de la membrane chorioallantoïde du poulet, une membrane embryonnaire impliquée dans les échanges gazeux; le second modèle, dans la cornée de souris, analyse l’importance relative des facteurs de croissance (VEGF [vascular endothelial growth factor] et son récepteur VEGFR) dans ce processus.  | Figure 1
Mécanisme de vascularisation du tissu de granulation par contraction de la matrice.
|
L’expérience utilisant la chorioallantoïde modifie le système classique : une matrice composée d’un mélange de collagène (type I) et de fibrine est déposée sur la membrane chorioallantoïde de l’embryon de poulet (jour 12) dont elle est séparée par une membrane de nylon, et mime le caillot de fibrine initial. Le gel de collagène se contracte sous l’effet de l’ajout de FGF2 (fibroblast growth factor), et se peuple de myofibroblastes et protomyofibroblastes qui y sécrètent une matrice contractile, mimant l’étape initiale du processus cicatriciel. Sa transparence facilite l’observation du mécanisme et de la cinétique d’installation des nouveaux vaisseaux. Ceux-ci sont issus de protubérances tissulaires vasculaires dont la structure reste complète (accompagnées des cellules musculaires lisses et des péricytes) issues du conjonctif de la membrane et qui pénètrent le gel sous l’effet des forces physiques. Pendant ce processus, les nouveaux vaisseaux restent connectés au réseau préexistant et sont fonctionnels, comme le prouve la circulation de colorant. Une angiogenèse plus classique (par bourgeonnement et intussusception) est également observée sur ces vaisseaux et affine l’établissement du réseau. L’intérêt de ce système expérimental est de pouvoir faire varier la composition du gel et donc définir les paramètres requis pour ce « looping ». Nous avons ainsi montré que le recrutement des vaisseaux sanguins vers le tissu de granulation formé dans le gel est complètement dépendant de l’existence de forces contractiles [
9], et qu’en leur absence le réseau vasculaire ne se forme pas, alors même qu’il y a colonisation du gel par les fibroblastes ou les cellules endothéliales. Les cellules endothéliales elles-mêmes ne sont d’ailleurs responsables ni des premières étapes de contraction ni du développement des caractéristiques élastiques de la matrice, qui sont contrôlés par l’interaction entre les fibroblastes activés et la matrice extracellulaire. Les forces physiques ne peuvent pas non plus être remplacées par des facteurs produits et libérés par les cellules qui migrent dans le tissu de granulation. Le second modèle permet d’analyser l’importance des facteurs de croissance angiogéniques lors de la cicatrisation d’une lésion de la cornée chez la souris, et notamment l’influence d’un blocage du récepteur de type 2 du VEGF. Jusqu’au jour 3, la néovascularisation n’est pas modifiée par l’absence de VEGF, en dépit d’une diminution importante de la prolifération des cellules vasculaires et du processus de bourgeonnement; elle n’est que partiellement réduite au jour 6. Cela confirme la prédominance des processus physiques dans l’initiation de la néovascularisation dans ce modèle. |
Nos résultats proposent un nouveau mécanisme d’angiogenèse, purement mécanique et susceptible de répondre rapidement à la demande de néovascularisation dans le cadre d’un processus cicatriciel. Nous ne savons pas si ces observations peuvent être extrapolées aux modèles de la croissance des vaisseaux lymphatiques ou à la néoangiogenèse tumorale. La capacité d’adaptation et de remodelage du système vasculaire en réponse aux signaux physiques de son environnement, par exemple aux forces de cisaillement du flux sanguin, est bien connue. Reste à comprendre ici la traduction moléculaire des forces contractiles à l’origine de ce processus de looping qui semble essentiel à la vascularisation initiale de la cicatrice fibreuse. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Singer AJ, Clark RA. Cutaneous wound healing. N Engl J Med 1999 ; 341 : 738-46. 2. Tonnesen MG, Feng X, Clark RA. Angiogenesis in wound healing. J Investig Dermatol Symp Proc 2000 ; 5 : 40-6. 3. Risau W. Mechanisms of angiogenesis. Nature 1997 ; 386 : 671-4. 4. Ausprunk DH, Folkman J. Migration and proliferation of endothelial cells in preformed and newly formed blood vessels during tumor angiogenesis. Microvasc Res 1977 ; 14 : 53-65. 5. Djonov V, Schmid M, Tschanz SA, Burri PH. Intussusceptive angiogenesis: its role in embryonic vascular network formation. Circ Res 2000 ; 86 : 286-92. 6. Conway EM, Collen D, Carmeliet P. Molecular mechanisms of blood vessel growth. Cardiovasc Res 2001 ; 49 : 507-21. 7. Eichmann A, Makinen T, Alitalo K. Neural guidance molecules regulate vascular remodeling and vessel navigation. Genes Dev 2005 ; 19 : 1013-21. 8. Kilarski WW, Samolov B, Petersson L, et al. Biomechanical regulation of blood vessel growth during tissue vascularization. Nat Med 2009 ; 15 : 657-64. 9. Tomasek JJ, Gabbiani G, Hinz B, et al. Myofibroblasts and mechano-regulation of connective tissue remodelling. Nat Rev Mol Cell Biol 2002 ; 3 : 349-63. |