| |
| Med Sci (Paris). 2010 August; 26(8-9): 688–689. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9688.Asthénozoospermie humaine et anomalies de l’annulus Pierre Lhuillier,1* Denise Escalier,2 Gérard Gacon,1 Emmanuel Dulioust,3 and Aminata Touré1 1Institut Cochin, Inserm U1016-CNRS UMR8104, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France 2Département d’andrologie, Université Paris 11, CHU Kremlin-Bicêtre, Le Kremlin-Bicêtre F-94275, France 3AP-HP, Université Paris Descartes, France MeSH keywords: Animaux, Asthénozoospermie, diagnostic, étiologie, Fécondité, Humains, Infertilité masculine, Mâle, Souris, Motilité des spermatozoïdes |
L’infertilité au sein d’un couple est évoquée si aucune grossesse ne survient après au moins 1 an de rapports réguliers, non protégés et pratiqués en période ovulatoire. Dans les pays occidentaux, près de 15 % des couples consultent pour des problèmes d’infertilité. Dans environ la moitié des cas, des facteurs d’infertilité sont diagnostiqués du côté masculin. L’asthénozoospermie, fréquemment retrouvée parmi ces facteurs, désigne une diminution ou une absence de la mobilité des spermatozoïdes (avec un taux de spermatozoïdes mobiles inférieur à 50 % moins d’une heure après I ‘éjaculation, selon les normes OMS) [
1]. Il est vraisemblable qu’une composante génétique soit fréquemment en cause dans les infertilités masculines. Cependant, très peu de gènes ont pu être individuellement identifiés comme étant la cible de mutations altérant la fertilité chez l’homme. Ces dernières années, la connaissance des déterminants génétiques de la fertilité mâle a néanmoins connu une avancée considérable grâce au développement de modèles murins d’infertilité. |
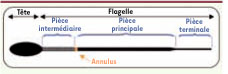
Infertilité des souris mâles par asthénozoospermie et anomalies de l’annulus L’annulus est une structure fibrillaire sous-membranaire, en forme d’anneau et située à la jonction des pièces intermédiaire (PI) et principale (PP) du flagelle des spermatozoïdes (Figure 1). Bien que l’annulus soit décrit depuis plusieurs dizaines d’années, sa fonction reste encore indéterminée.  | Figure 1
Structure du spermatozoïde. On distingue au niveau du flagelle du spermatozoïde des mammifères : la pièce intermédiaire (PI), la pièce princi pale (PP) et la pièce terminale. La PI est constituée d’une gaine de mitochondries. L’annulus se situe à la jonction PI/PP. |
Les protéines TAT1 (testis anion transporter 1) et septine 4 (SEPT4) ont récemment été décrites comme des protéines flagellaires localisées, chez l’homme et chez la souris, au niveau de l’annulus des spermatozoïdes [
2-
4,
7]. L’inactivation chez la souris des gènes Tat1 ou Sept4 conduit à deux modèles d’asthénozoospermie très similaires. Ainsi, les mâles Tat1
-/-
et Sept4
-/-
sont totalement stériles. Leurs spermatozoïdes sont immobiles et présentent, au niveau de la région de l’annulus, un amincissement du flagelle et une plicature à 180°. L’annulus est atrophié et détaché de la membrane dans les spermatozoïdes Tat1
-/-
; il est totalement absent dans les spermatozoïdes Sept4
-/-
[2–4]. L’ensemble de ces données suggère fortement un rôle de l’annulus dans la mobilité des spermatozoïdes et la fertilité chez la souris. |
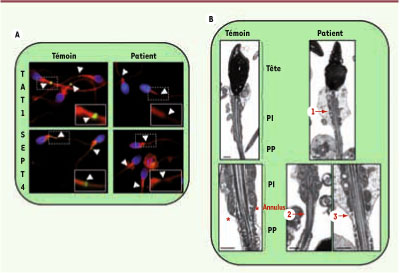
Un cas inédit d’asthénozoopermie humaine associée à une absence d’annulus Nous avons recherché des défauts de l’annulus chez des patients asthénozoospermiques en analysant l’expression de la protéine TAT1 qui, comme la protéine SEPT4, constitue un marqueur de l’annulus. L’étude de 75 sujets asthénozoospermiques a été réalisée par immunofluorescence sur frottis de sperme brut. Ce crible a permis d’isoler un sujet asthénozoospermique présentant une absence de marquage de la protéine TAT1 à l’annulus dans 97 % des spermatozoïdes observés (Figure 2A) [
5].  | Figure 2 Analyse des spermatozoïdes du patient. A. Les protéines TAT 1 (haut) et SEPT 4 (bas) sont détectées par immunofluorescence sur frottis de sperme brut provenant d’un sujet témoin sans asthénozoospermie (gauche) ou du patient (droite). Les protéines d’intérêt sont marquées en vert, les mitochondries de la PI en rouge et l’ADN de la tête des spermatozoïdes en bleu. Dans chaque cas, la région de l’annulus d’un spermatozoïde est agrandie. Aucune des protéines étudiées n’est détectée à l’annulus dans 97 % des spermatozoïdes du patient. B. L’ultrastruture est analysée par observation en microscopie électronique d’un culot de spermatozoïdes provenant d’un sujet témoin sans asthénozoospermie (gauche) ou du patient (droite). Les différentes parties du spermatozoïde sont indiquées pour le témoin : tête ; pièce intermédiaire (PI) ; pièce princi pale (PP) ; annulus (structure dense aux électrons, triangulaire, accolée à la membrane et signalée par un astérisque). Les anomalies des spermatozoïdes du patient sont signalées par des flèches : défaut de la gaine de mitochondries (1), disjonction PI/PP (2), absence d’annulus (3). Chaque barre d’échelle représente 0,5 μm. |
Le patient était âgé de 31 ans et marié depuis plus de 3 ans. Le couple a consulté pour suspicion d’infertilité après 10 mois de rapports réguliers non féconds. Le patient présentait une asthénozoospermie modérée mise en évidence par trois spermogrammes distincts qui indiquaient respectivement 35 %, 30 % et 25 % de spermatozoïdes mobiles (valeurs inférieures à la norme de 50 % fixée par l’OMS). Les spermatozoïdes du patient présentent, en plus de l’absence de protéine TAT1, une absence de protéine SEPT4 à l’annulus, suggérant une absence complète de cette structure (Figure 2A). L’analyse ultrastructurale des spermatozoïdes par microscopie électronique confirme l’absence d’annulus et indique également une disjonction PI/PP du flagelle et des anomalies de la gaine mitochondriale (Figure 2B).
Les anomalies de structure des spermatozoïdes chez ce patient (absence de l’annulus et disjonction PI/PP du flagelle) sont similaires à celles observées chez les souris invalidées pour le gène Sept4, démontrant que chez l’homme, comme chez la souris, l’intégrité de l’annulus est nécessaire à la mobilité des spermatozoïdes [5]. Ces anomalies conduisent néanmoins à des degrés d’asthénozoospermie très différents ; ainsi l’athénozoospermie est modérée chez le patient alors qu’elle est totale chez la souris Sept4
-/-
. Ceci pourrait être lié à des différences de maturation des spermatozoïdes et/ou à une fragilité particulière du flagelle des spermatozoïdes de souris. |
Les résultats de notre étude suggèrent une association entre l’absence d’annulus et les asthénozoospermies humaines. Une étude concomitante réalisée sur une cohorte de 33 patients d’origine japonaise a également mis en évidence cette association avec, cependant, une fréquence beaucoup plus élevée (30 %) [
6]. Dans les deux cas, la taille des cohortes analysées reste relativement faible. L’analyse d’un nombre plus important de patients asthénozoospermiques sera donc nécessaire pour fournir une meilleure estimation de cette association. Si celle-ci est confirmée et si sa fréquence s’avère non négligeable, l’absence d’annulus pourrait, à terme, servir de marqueur diagnostique d’une catégorie d’asthénozoospermies. Par ailleurs, il est possible que les anomalies de l’annulus mises en évidence chez ce patient résultent de mutations dans un ou plusieurs gènes codant pour des composants de cette structure. À ce jour, sept protéines (dont les protéines TAT1 et SEPT 4) ont été localisées au niveau de l’annulus. Ainsi, les gènes codant pour ces protéines constituent des candidats de premier choix pour rechercher d’éventuelles mutations. L’annulus a été observé en microscopie électronique par Holstein dès 1975, mais garde encore tous ses mystères. Nos travaux chez l’homme et la souris apportent les toutes premières pistes pour comprendre son rôle dans la physiologie du spermatozoïde et sa contribution dans la fonction de reproduction. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. World Health Organization. Laboratory manual of the WHO for the examination of human semen and sperm-cervical mucus interaction. Ann 1st Super Sanita 2001 ; 37 (I-XII) : 1-123. 2. Toure A, Lhuillier P, Gossen JA, et al. The testis anion transporter 1 (Slc26a8) is required for sperm terminal differentiation and male fertility in the mouse. Hum Mol Genet 2007 ; 16 : 1783-93. 3. Kissel H, Georgescu MM, Larisch S, et al. The Sept4 septin locus is required for sperm terminal differentiation in mice. Dev Cell 2005 ; 8 : 353-64. 4. Ihara M, Kinoshita A, Yamada S, et al. Cortical organization by the septin cytoskeleton is essential for structural and mechanical integrity of mammalian spermatozoa. Dev Cell 2005 ; 8 : 343-52. 5. Lhuillier P, Rode B, Escalier D, et al. Absence of annulus in human asthenozoospermia: case report. Hum Reprod 2009 ; 24 : 1296-303. 6. Sugino Y, Ichioka K, Soda T, et al. Septins as diagnostic markers for a subset of human asthenozoospermia. J Urol 2008 ; 180 : 2706-9. 7. Lhuillier P, Escalier D, Gacon G, Touré A. Un transporteur d’anions est essentiel à la mobilité des spermatozoïdes. Med Sci (Paris) 2008 ; 24 : 226-8. |