| |
| Med Sci (Paris). 2010 August; 26(8-9): 678–680. Published online 2010 August 15. doi: 10.1051/medsci/2010268-9678.mGluR5 : un récepteur à la croisée des chemins thérapeutiques ? Marc Flajolet,1* Hong Wang,1 and Paul Greengard1 1Rockefeller University, Laboratory of molecular and cellular neuroscience, 1230 York Avenue, New York, NY 10065, États-Unis MeSH keywords: Anxiété, physiopathologie, Agrégation cellulaire, Dépression, Desmosomes, physiologie, Syndrome du chromosome X fragile, génétique, Humains, Syndrome de Netherton, Neuropeptides, Récepteur-5 métabotropique du glutamate, Récepteurs métabotropes au glutamate, Schizophrénie |
Les récepteurs couplés aux protéines G : l’Eldorado des psychiatres ? Les récepteurs couplés aux protéines G (RCPG) représentent une très large famille de récepteurs (plus de 1 000 exemplaires dans le génome humain) dont l’activation, via la liaison à un ligand spécifique extracellulaire, transmet un signal intracellulaire. Environ 50 % des drogues modernes ciblent les récepteurs métabotropes. Une proportion importante de ces drogues (agonistes et antagonistes) ciblent des maladies et des troubles du système nerveux central qui impliquent par exemple les récepteurs adrénergiques, dopaminergiques, sérotoninergiques, histaminergiques, muscariniques, opioïdes, etc. Ils sont impliqués dans les dysfonctionnements physiologiques, les maladies neurodégénératives, ainsi que dans les troubles neuropsychiatriques. |
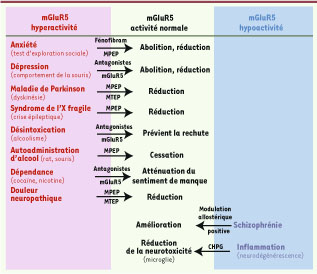
mGluR5 : une déesse aux bras multiples mGluR5 (mGluR : metabotropic glutamate receptor) est abondamment exprimé au niveau du système nerveux central et en particulier au niveau du cortex cérébral, de l’hippocampe, du septum latéral, du striatum dorsal et du noyau accumbens, des régions impliquées dans la cognition, le contrôle moteur et l’émotivité. mGluR5 appartient à un sous-groupe de huit récepteurs, le groupe des récepteurs métabotropes répondant à l’acide glutamique, le principal neurotransmetteur excitateur du système nerveux central. En réponse au glutamate, les récepteurs du groupe 1 (mGluR1 et mGluR5), actifs sous forme de dimères, régulent principalement les réserves intracellulaires de calcium ainsi que l’activité PKC (protéine kinase C) via la formation d’IP3 (inositol trisphosphate) et de DAG (diacylglycérol). L’intervention pharmacologique sur ces récepteurs, et en particulier le blocage de mGluR5, est en cours d’évaluation dans diverses applications thérapeutiques comme l’anxiété, la dépression, la schizophrénie, les désordres neuropsychiatriques, la douleur, la maladie de Parkinson, les problèmes cognitifs et l’addiction (Figure 1).  | Figure 1
Impact médical de la modulation de l’activité mGluR5. Certains symptômes associés a des troubles ou maladies présentant une modification de l’activité m GluR5 (hype ractivité en rouge et hypoactivité en bleu) peuvent être partiellement ou totalement corrigés grâce à des antagonistes (exemple : MPEP, MTEP, fénofibram) ou a des agonistes (exemple : CHPG [(RS)-2-chloro-5-hydroxyphénylglycine]) ou des modulateur allostériques positifs. Les flèches indiquent un retour à la normale d’un symptôme particulier (colonne rose ou bleue) après traitement à l’aide de la molécule associée à la flèche, et ainsi que son efficacité (colonne verte). |
Le rôle de mGluR5 dans la dépression et l’anxiété Ces deux troubles, étroitement associés à des niveaux élevés de stress, coexistent très souvent et il n’est pas rare de trouver qu’une drogue affectant l’un de ces deux troubles aura des conséquences significatives sur l’autre. Dans les années 1990 et au début des années 2000, période d’engouement pour le ciblage thérapeutique du récepteur mGluR5, qui bénéficiait d’échecs répétés du ciblage des récepteurs ionotropiques, certaines études comportementales chez la souris et le rat ont conduit à la découverte presque fortuite d’un rôle du récepteur mGluR5 dans la dépression et l’anxiété (pour une revue récente voir [
1]). En effet, les propriétés anxiolytique du fenobam, un antagoniste de mGluR5 pourtant découvert dans les années 1970, n’ont été clairement associées au récepteur mGluR5 que plus récemment [
2]. Dans la foulée, l’action d’un autre antagoniste de mGluR5, MPEP (2-méthyl-6 [phényléthynyl] - pyridine), dans différents tests d’anxiété dont le test d’exploration sociale, a confirmé l’implication de ce récepteur dans la dépression et l’anxiété. De tels antagonistes se sont également révélé être bénéfiques dans au moins deux tests classiquement utilisés chez la souris pour mesurer l’activité anti-dépressive d’une molécule : le test de suspension par la queue (tail suspension test) et le test de la nage forcée (forced swim test). Par ailleurs, ces caractéristiques comportementales ont été observées chez la souris dont le gène codant pour mGluR5 a été invalidé, éliminant toute action non spécifique de ces molécules dans les tests utilisés. mGluR5 et maladie de Parkinson La maladie de Parkinson, la seconde maladie neurodégénérative la plus répandue (1 % de la population) [
3], pourrait aussi bénéficier du développement d’antagonistes de mGluR5. Cette maladie décrite par James Parkinson en 1817, ne bénéficie aujourd’hui, malgré des décennies de recherches, que d’un seul traitement, la L-DOPA, un précurseur de la dopamine transformée localement au niveau du striatum en dopamine. Bien que le traitement soit efficace, il engendre malheureusement, après des années d’utilisation, des effets secondaires très importants tels qu’une dyskinésie [
4]. Les neurones du striatum répondant à la dopamine reçoivent essentiellement leurs informations de neurones excitateurs de type glutamatergiques du cortex et du thalamus. Lorsque la quantité de dopamine délivrée au niveau du striatum est significativement amoindrie en raison de la dégénérescence des neurones dopaminergiques, le déséquilibre dopamine/glutamate favorise la progression de la maladie et le développement de la dyskinésie. Cette dernière peut être réduite, voire presque totalement abolie, si l’on bloque l’activité excessive du glutamate, ce qui peut être obtenu en modulant mGluR5. Les résultats obtenus dans des modèles murins et plus encore chez le primate sont extrêmement convaincants [
5]. mGluR5 et schizophrénie Selon la théorie de l’excitotoxicité du glutamate dans l’étiopathogénie de la schizophrénie, la balance dopamine/ glutamate doit être modifiée en faveur du glutamate. Cela peut être obtenu en activant mGluR5 tout en évitant de toucher au système dopaminergique, ce qui engendrerait des effets secondaires importants (pour revue, voir [
6]). Selon l’hypothèse glutamatergique, la fonction du récepteur N-méthyl-D-aspartate (NMDA), un récepteur largement impliqué dans différent types de comportements complexes, est altérée. Parce qu’il a été montré que la modulation positive allostérique du récepteur mGluR5 pouvait annuler la réponse « schizophrénique- like » induite chez l’animal a l’aide d’antagonistes du NMDA, l’utilisation bénéfique de tels modulateurs a été suggérée ce d’autant qu’ils seraient sans risque d’interférence avec le système dopaminergique. mGluR5 et le syndrome de l’X fragile Le syndrome de l’X fragile, première cause de retard mental héréditaire et deuxième cause de retard mental d’origine génétique après la trisomie 21, a récemment été associé à un dysfonctionnement glutamatergique. En effet, plusieurs hypothèses sont actuellement à l’étude et l’une d’entre elles postule qu’un certain nombre de symptômes associés au syndrome de l’X fragile pourraient s’expliquer par une trop forte activité du récepteur mGluR5 [
7,
8]. Chez l’animal, l’administration d’un antagoniste du récepteur mGluR5 (MPEP) réduit significativement les crises de type épileptiques [
9,
10]. Actuellement, quatre essais cliniques utilisant différents antagonistes du récepteur mGluR5 et visant a améliorer la symptomatologie du syndrome de l’X fragile sont en cours (Laboratoires Roche, Novartis, Seaside, Neuropharm). |
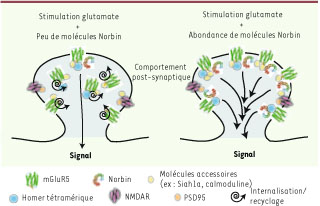
Norbin et Homer, partenaires de mGluR5 Dans le but de mieux comprendre le couplage du récepteur mGluR5 aux différentes voies de transduction du signal évoquées ci-dessus, plusieurs groupes, dont le nôtre, ont entrepris d’identifier les partenaires cellulaires du récepteur mGluR5. À ce jour seulement deux protéines interagissant avec mGluR5 ont un fort impact sur la biologie du récepteur : Norbin [
11] et Homer [
12]. Nous avons récemment identifié Norbin comme un important régulateur du récepteur mGluR5. Un crible dans la levure utilisant la technique du double hybride a permis d’identifier cette protéine, relativement peu étudiée jusqu’alors, comme interagissant physiquement avec la partie carboxy-terminale du récepteur utilisé comme appât [11]. Cette interaction a été confirmée par différentes méthodes biochimiques telles que l’immunoprécipitation. Les territoires d’expression de Norbin au niveau du système nerveux central se superposent remarquablement bien avec ceux du récepteur mGluR5. Dans un modèle cellulaire, la modulation de l’expression de Norbin affecte significativement la réponse calcique induite par l’activation de mGluR5 a l’aide d’un agoniste sélectif. D’un point vu mécanistique, il semblerait que Norbin participe a l’adressage du récepteur a la surface cellulaire [11] (Figure 2). Cependant, on ne sait pas encore si Norbin facilite l’adressage de nouvelles molécules de mGluR5 vers la membrane ou au contraire aide a maintenir le pool de récepteurs membranaires a la surface cellulaire. Enfin, des déficits de plasticité synaptique (diminution de la LTD [long-term depression] et de la LTP [long-term potentiation]) ont été observés chez les souris knock-out pour le gène norbin, et la réponse comportementale de ces souris dans le contexte de la schizophrénie est similaire, voire plus prononcée, que celle qui est observée chez les souris mGluR5
-/-
[11]. Homer influence également l’adressage du récepteur mGluR5 vers les sites dendritiques. Le phénotype des souris invalidées pour le gène homer mime certaines des caractéristiques observées chez les souris mGluR5
-/-
comme l’addiction et la plasticité synaptique. Enfin, les protéines Siah-1a et calmoduline interagissent également avec mGluR5, cependant la relevance physiologique de ces interactions demeure incertaine.  | Figure 2
Voie de signalisation de Norbin. Représentation schématique de l’activation des voies de transduction du signal en présence de faibles (gauche) ou fortes (droite) quantités de la protéine Norbin. En présence de fortes concentrations de Norbin, le récepteur mGluR5 demeure a la surface cellulaire et l’intensité du signal en aval du récepteur mGluR5 est accrue proportionnellement. |
|
Il est évident que le récepteur mGluR5 joue un rôle important dans différents aspects du fonctionnement du système nerveux central et que sa régulation est finement contrôlée, qu’il s’agisse de son activité ou de sa localisation cellulaire (surface versus intracellulaire, zones actives versus non actives). Plusieurs régulateurs-clés, dont Norbin et Homer, semblent contrôler activement la distribution cellulaire du récepteur. Et même si les mécanismes moléculaires impliqués ne sont pas connus a ce jour, ces protéines pourraient offrir de nouvelles possibilités de manipuler l’activité de mGluR5 a des fins thérapeutiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Palucha A, Pilc A. Metabotropic glutamate receptor ligands as possible anxiolytic and antidepressant drugs. Pharmacol Ther 2007 ; 115 : 116-47. 2. Porter RH, Jaeschke G, Spooren W, et al. Fenobam: a clinically validated nonbenzodiazepine anxiolytic is a potent, selective, and noncompetitive mGlu5 receptor antagonist with inverse agonist activity. J Pharmacol Exp Ther 2005 ; 315 : 711-21. 3. Nussbaum RL, Ellis CE. Alzheimer’s disease and Parkinson’s disease. N Engl J Med 2003 ; 348 : 1356-64. 4. Fahn S. Parkinson disease, the effect of levodopa, and the ELLDOPA trial. Earlier versus Later L-DOPA. Arch Neurol 1999 ; 56 : 529-35. 5. Morin N, Grégoire L, Gomez-Mancilla B, et al. Effect of the metabotropic glutamate receptor type 5 antagonists MPEP and MTEP in parkinsonian monkeys. Neuropharmacology 2010 ; 58 : 981-6. 6. Lisman JE, Coyle JT, Green RW, et al. Circuit-based framework for understanding neurotransmitter and risk gene interactions in schizophrenia. Trends Neurosci 2008 ; 31 : 234-42. 7. Bear MF, Huber KM, Warren ST. The mGluR theory of fragile X mental retardation. Trends Neurosci 2004 ; 27 : 370-7. 8. Dolen G, Osterweil E, Rao BS, et al. Correction of fragile X syndrome in mice. Neuron 2007 ; 56 : 955-62. 9. Chapman AG, Nanan K, Williams M, et al. Anticonvulsant activity of two metabotropic glutamate group I antagonists selective for the mGlu5 receptor: 2-methyl-6-(phenylethynyl)-pyridine (MPEP), and (E)-6-methyl-2-styryl-pyridine (SIB 1893). Neuropharmacology 2000 ; 39 : 1567-74. 10. Yan QJ, Rammal M, Tranfaglia M, et al. Suppression of two major Fragile X Syndrome mouse model phenotypes by the mGluR5 antagonist MPEP. Neuropharmacology 2005 ; 49 : 1053-66. 11. Wang H, Westin L, Nong Y, et al. Norbin is an endogenous regulator of metabotropic glutamate receptor 5 signaling. Science 2010 ; 326 : 1554-7. 12. Brakeman PR, Lanahan AA, O’Brien R, et al. Homer: a protein that selectively binds metabotropic glutamate receptors. Nature 1997 ; 386 : 284-8. |