| |
| Med Sci (Paris). 2010 June; 26(6-7): 647–651. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7647.Un rôle pour la voie de signalisation Akt/GSK3 dans l’action des médicaments psychotropes et les maladies mentales Thomas Del’Guidice and Jean-Martin Beaulieu* Département de Psychiatrie et Neuroscience, Faculté de Médecine, Université Laval/CRULRG, 2601, chemin de la Canardière, Bureau F-6500, Beauport (Québec), G1J 2G3 Canada |
Plus de 50 ans après la découverte des effets cliniques de la chlorpromazine et du lithium, les mécanismes moléculaires par lesquels les médicaments psychotropes exercent leurs actions thérapeutiques dans des pathologies comme la dépression, la schizophrénie ou encore les troubles bipolaires, restent mal compris. La découverte des récepteurs et des transporteurs des neurotransmetteurs de la famille des monoamines (dopamine, sérotonine et noradrénaline) a permis d’identifier les cibles pharmacologiques primaires de plusieurs de ces drogues, ce qui a favorisé la mise au point de nouveaux composés. Les monoamines activent principalement des récepteurs à sept domaines transmembranaires couplés à des protéines G (RCPG). Des études récentes ont révélé que ces récepteurs régulent des mécanismes cellulaires d’une grande complexité où interviennent non seulement les protéines G mais aussi des protéines de signalisation comme les bêta-arrestines (βArr) qui peuvent agir indépendamment [
1-
4]. De plus, certains récepteurs régulent des cibles communes, ouvrant ainsi la porte à des mécanismes d’intégration des voies de signalisation subcellulaires [
5,
6]. Il apparaît donc important d’examiner le rôle de ces différents mécanismes de signalisation sur les effets comportementaux que produisent des médicaments psychotropes, de manière à augmenter leur efficacité thérapeutique tout en réduisant leurs effets secondaires. Parmi les molécules de signalisation affectées par les médicaments psychotropes, la voie constituée par les protéine kinases Akt et glycogen synthase kinase 3 (GSK3) semble jouer un rôle important dans la régulation du comportement par la dopamine et la sérotonine [5]. Akt, aussi appelée protéine kinase B (PKB), est une sérine/thréonine kinase activée en réponse à la stimulation de la voie des phosphatidylinositol phosphates. À la suite de son activation (Figure 1), Akt va phosphoryler les deux isoformes, alpha et bêta, de GSK3 dans leur domaine aminoterminal, menant ainsi à leur inactivation [
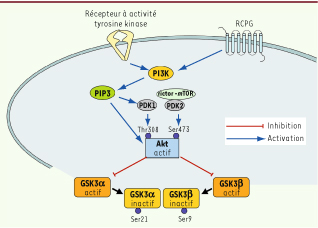
7]. Dans cette courte synthèse, nous ferons un survol des mécanismes par lesquels la dopamine et la sérotonine régulent la voie Akt/GSK3, nous considérerons également la contribution de la voie Akt/GSK3 dans l’action qu’exercent plusieurs catégories de médicaments employés en psychiatrie.  | Figure 1
Représentation schématique de la voie de signalisation Akt/GSK3. L’activation de récepteurs à activité tyrosine kinase et de certains RCPG provoque une activation de la phosphoinositide 3-kinase (Pi3K) qui mène à la production de phosphatidylinositol (3,4,5)-trisphosphate (PIP3). L’augmentation des niveaux de PIP3 conduit au recrutement d’Akt et de la kinase dépendante du 3-phospho-inositide (PDK1) à la membrane. PDK1 phosphoryle/active Akt sur son résidu aminé thréonine 308. Akt est aussi phosphorylée à son résidu sérine 473 par une autre kinase, PDK2. Une fois activée, Akt inhibe GSK3 α et β en phosphorylant respectivement leurs résidus sérine 21 et 9. |
|
Régulation d’Akt et de GSK3 par la dopamine Des résultats obtenus chez la souris montrent que la voie de signalisation Akt/GSK3 est régulée par la dopamine via les récepteurs dopaminergiques de type D2 (D2R) [
2,
8]. Une stimulation prolongée de ces récepteurs par des concentrations élevées de dopamine en réponse aux amphétamines in vivo provoque l’inhibition d’Akt et entraîne une augmentation de l’activité de GSK3 chez des souris de type sauvage (Figure 2), mais pas chez des souris n’exprimant pas le D2R [2, 8]. Une activation de GSK3 a aussi été observée chez des souris déficientes pour le transporteur de la dopamine (DAT-KO) chez lesquelles les concentrations de dopamine extracellulaire sont augmentées de cinq fois [8,
9]. L’augmentation de l’activité de GSK3 en réponse à la dopamine se traduit par une augmentation de l’activité locomotrice et par le développement de comportements stéréotypiques qui sont deux paradigmes utilisés pour modéliser les comportements de type psychotique chez la souris. En effet, une inhibition de GSK3 antagonise les comportements hyperactifs et stéréotypiques chez les souris DAT-KO, ainsi que chez les souris de type sauvage traitées avec des amphétamines [8]. De plus, des souris qui surexpriment une forme active de GSK3 présentent des comportements hyperactifs qui rappellent ceux induits par la dopamine [
10]. La nature des cibles de GSK3 en cause dans la régulation de l’hyperactivité locomotrice chez la souris est encore inconnue. Il est cependant intéressant de remarquer que la surexpression de la β-caténine, une protéine multifonctionnelle dont l’activité est en partie régulée négativement par GSK3, réduit l’hyperactivité locomotrice dépendante de la dopamine dans des tests comportementaux chez le rongeur [
11]. 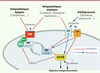 | Figure 2
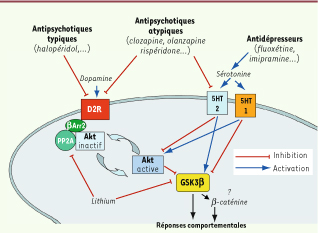
Régulation de la voie de signalisation Akt/GSK3 par des composés pharmacologiques thérapeutiques affectant les systèmes monoaminergiques. La dopamine et la sérotonine engendrent communément et/ou séparément des variations de l’activité de GSK3 via différentes voies de signalisation. La stimulation des récepteurs dopaminergiques se traduit par la modulation de la voie de signalisation Akt/GSK3 qui entraîne une inhibition d’Akt et une activation de GSK3. L’inactivation d’Akt par la dopamine est régie dans le striatum par la stimulation des récepteurs de type 2 (D2). L’activation du récepteur permet le recrutement de la β-arrestine 2, de la protéine phosphatase 2A (PP2A) et d’Akt. Ces trois protéines forment un complexe de signalisation lié au récepteur qui déphosphoryle/inactive Akt. La stimulation des récepteurs sérotoninergiques exerce une double action menant soit à une activation, soit à une inhibition de GSK3 via des mécanismes qui sont encore à définir. De nombreux médicaments psychotropes affectent aussi la régulation de cette voie de signalisation en agissant soit sur les récepteurs de la dopamine et/ou de la sérotonine, soit en interférant avec les mécanismes intracellulaires associés à cette voie de signalisation. |
La régulation de la voie Akt/GSK3 par la dopamine passe par un nouveau mécanisme de signalisation des RCPG où interviennent les βArr [1,
12]. Les bêta-arrestines (βArrl et βArr2) sont des protéines d’échafaudage multifonctionnelles connues pour leur action dans la désensibilisation et l’internalisation des RCPG [
13,
14]. Cependant, les βArr peuvent aussi participer directement à la signalisation cellulaire en facilitant l’interaction entre des molécules telles que des kinases et des phosphatases [4,
15]. Des expériences sur des souris déficientes en βArr2 (βArr2-KO) ont permis de montrer que cette protéine joue un rôle dans la régulation de la voie Akt/GSK3 par les D2R [1]. En réponse à la stimulation de ces récepteurs chez la souris normale, la βArr2 forme un complexe protéique composé de Akt, βArr2 et de la protéine phosphatase PP2A [1, 2]. La formation de ce complexe mène à la déphosphorylation-inactivation d’Akt (Figure 2), ce qui conduit à l’activation de GSK3. Chez les souris βArr2-KO, les niveaux de phosphorylation d’Akt et de GSK3 sont élevés en raison d’une absence de régulation de cette voie par la dopamine ; en revanche, l’administration de composés agissant sur le système dopaminergique, comme l’apomorphine et les amphétamines, n’affecte plus l’activité de ces deux kinases en l’absence de βArr2. De plus, les souris βArr2-KO présentent une réduction (plus de 75 %) de leur réponse comportementale à l’apomorphine ou aux amphétamines [1]. |
Régulation d’Akt et de GSK3 par la sérotonine et les antidépresseurs GSK3 est également régulée par un autre neurotransmetteur principalement connu pour son rôle possible dans les troubles dépressifs : la sérotonine (5 - HT). Chez le rongeur, les composés ciblant la neurotransmission sérotoninergique comme les antidépresseurs tricycliques, les inhibiteurs de monoamines oxydases (IMAO) et les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) inhibent GSK3 dans différentes régions cérébrales telles que le striatum, l’hippocampe et le cortex frontal. Deux types de récepteur à sérotonine, 5-HT1A et 5-HT2A, jouent des rôles opposés dans la régulation de l’activité de GSK3β [
16,
17]. La stimulation de 5-HT1A et de 5-HT2A entraîne respectivement l’inhibition et l’activation de cette kinase. Les mécanismes par lesquels la sérotonine module l’activité de GSK3β ne sont pas encore clairs mais pourraient mettre en jeu une modulation de l’activité d’Akt [
18] (Figure 2). Une étude récente montre que des souris génétiquement modifiées présentant une baisse de 80 % du taux de synthèse de la sérotonine ont une activité deux fois plus élevée de GSK3 dans le cortex frontal [
19]. Ces souris (tph2-Kl) sont porteuses d’une mutation (R439H) du gène de la tryptophane hydroxylase-2 (tph2), une enzyme participant à la synthèse de la sérotonine dans les neurones du noyau raphé. Cette modification génétique est similaire à une mutation identifiée chez des patients dépressifs résistant aux traitements courants. L’administration d’un inhibiteur direct de GSK3 conduit à un rétablissement phénotypique chez ces animaux mutants dans des tests de comportement évaluant l’anxiété et la dépression [5, 19]. De plus, le croisement des souris tph2-KI avec des souris GSK3β mutantes a montré que la perte d’une seule copie du gène codant pour GSK3β est suffisante pour faire disparaître les phénotypes comportementaux observés chez les souris tph2-KI. Ces données mettent en évidence le rôle majeur de GSK3β dans les effets comportementaux de la sérotonine associés au cortex frontal. |
Modulation de la voie Akt/GSK3 par les antipsychotiques Les antipsychotiques sont utilisés pour traiter des troubles mentaux accompagnés de comportements de type psychotique comme ceux observés dans la schizophrénie. Les antipsychotiques typiques (AT), également appelés « de première génération », tels que l’halopéridol, sont principalement des antagonistes des récepteurs de classe D2 (Figure 2). Les antipsychotiques atypiques (AA) ou de seconde génération, comme la clozapine, présentent moins d’affinité pour les récepteurs D2 que les AT et agissent aussi sur les récepteurs 5-HT2A avec une forte affinité. Cette double activité entraîne une réduction de la prévalence des effets secondaires extrapyramidaux (dyskinésie, dystonie, rigidité musculaire) et suggère qu’une probable synergie existe entre la dopamine et la sérotonine dans leur action thérapeutique (Figure 2). Ce double effet se démarque des modes d’action des AT et des ISRS pour lesquels les neurotransmissions dopaminergique et sérotoninergique sont affectées séparément l’une de l’autre. Il a été démontré que les AT administrés chroniquement activent Akt et inhibent GSK3 en interférant avec la stimulation des récepteurs D2 par la dopamine [8,
20]. Plusieurs AA comme la clozapine et l’olanzapine induisent aussi une inhibition de GSK3 dans différentes régions du cerveau chez la souris [16,
21,
22]. Puisque La dopamine et la sérotonine peuvent affecter l’activité de GSK3, il est difficile d’établir si une perturbation de la réponse à seulement l’un de ces deux neurotransmetteurs est responsable de la régulation de GSK3 par les AA. Il a aussi été montré que l’action couplée d’antipsychotiques atypiques, comme le rispéridone, avec des antidépresseurs comme l’imipramine et la fluoxétine augmente la phosphorylation de GSK3 avec plus d’efficacité que ces agents administrés séparément [16, 22]. Cette combinaison de médicaments est parfois utilisée en clinique pour le traitement de sujets souffrant de dépression majeure résistante à une monothérapie. Il est donc possible qu’une régulation convergente de la voie Akt/GSK3 par ces différents composés puisse contribuer à leurs effets bénéfiques lorsqu’ils sont administrés en combinaison. |
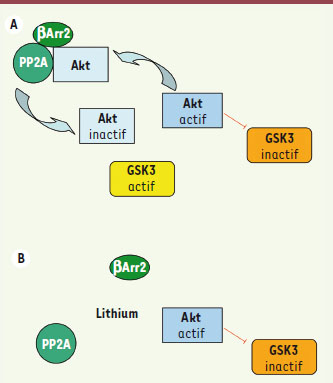
Rôle de βArr2, Akt et GSK3 dans l’action du lithium D’autres travaux, portant sur le lithium, suggèrent que la voie Akt/GSK3 contribuerait aux effets thérapeutiques de cet agent. Le lithium est un thymorégulateur utilisé dans le traitement des troubles bipolaires : il est parfois prescrit en complément de composés ciblant la neurotransmission monoaminergique. Bien que le lithium ait de multiples cibles intracellulaires connues [
23,
24], la façon dont il exerce ses effets thérapeutiques demeure obscure. Le lithium est un inhibiteur direct de l’activité de GSK3. De plus, il peut aussi inactiver cette kinase indirectement en provoquant une activation d’Akt. L’inhibition indirecte de GSK3 résulte d’une déstabilisation du complexe protéique formé par βArr2, Akt et PP2A (Figure 3) [24,
25]. Cette déstabilisation a été observée in vivo chez la souris à des concentrations thérapeutiques comprises entre 0,5 et 1,5 mM. Le lithium antagonise les variations comportementales motrices dépendantes de la dopamine chez les rongeurs via la voie de signalisation Akt/GSK3 de la même manière qu’une inhibition pharmacologique ou génétique de GSK3 [8, 25]. Les souris βArr2-KO ne répondent pas au lithium dans plusieurs tests comportementaux évaluant les effets antidépresseurs et antimaniaques de ce composé pharmacologique [25]. De plus, qu’il soit ponctuel ou chronique, un traitement au lithium administré à des souris βArr2-KO ne provoque pas l’activation d’Akt comme il le fait chez des souris normales. La déficience en βArr2 chez ces souris empêche la formation du complexe βArr2/Akt/PP2A [1, 25], ce qui expliquerait l’absence d’effet du lithium chez ces dernières. Cependant, il est probable que le lithium n’ait pas un mode d’action unique et qu’il agisse également via d’autres mécanismes [23, 24]. 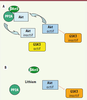 | Figure 3
Interactions entre le complexe Akt/β-arrestine et le lithium. La déstabilisation du complexe Akt/β-arrestine 2/PP2A par le lithium se traduit par une inactivation réduite d’Akt par PP2A et une inhibition plus grande de GSK3 par Akt. A : absence de lithium et B : présence de lithium à une concentration supérieure à 0,5mM. |
|
Rôle d’Akt et de GSK3 dans l’étiologie des maladies mentales Plusieurs études récentes suggèrent qu’Akt et GSK3 sont en cause dans les processus biologiques sous-jacents aux maladies mentales. Par exemple, plusieurs études ont montré une possible association entre le gène aktl et la schizophrénie dans diverses populations humaines [5, 20]. De plus, une réduction de l’expression d’Akt, qui se manifeste par une baisse de son activité similaire à celle que provoque la dopamine, a aussi été rapportée dans le cerveau de sujets atteints de schizophrénie [20]. Des modifications de l’activité de GSK3 ont aussi été observées en association avec le suicide chez l’humain [5, 24,
26]. Finalement, une augmentation de l’activité de GSK3 similaire à celle survenant en réponse à la dopamine a été observée chez des souris déficientes en une protéine appelée « disrupted in schizophrenia 1 » (disc-1). Des mutations affectant cette protéine ont été classées comme un facteur de risque susceptible de provoquer la schizophrénie. Une participation de disc-1 à la régulation de l’activité de GSK3 suggère donc un lien possible entre une protéine associée au développement de maladies mentales et un mécanisme de signalisation cellulaire affecté par les médicaments utilisés pour leur traitement [
27]. |
Conclusion et perspectives d’étude La caractérisation d’un rôle pour la voie de signalisation Akt/GSK3 en réponse à la dopamine, à la sérotonine et aux médicaments psychotropes in vivo a conduit à l’identification et la validation de diverses molécules de signalisation comme modulateurs du comportement. De nouvelles pistes de recherche prometteuses en génétique ont aussi permis d’associer les gènes codant pour des protéines régulant l’activité de cette voie de signalisation (ex. : akt1, disc-1) avec le risque de provoquer une schizophrénie [20, 27]. Comprendre la complexité des mécanismes de signalisation moléculaire dans différentes régions cérébrales représente un objectif essentiel et stratégique pour la mise au point de nouveaux traitements thérapeutiques plus efficaces diminuant le risque d’effets secondaires et ciblant des sous-ensembles fonctionnels impliqués dans les réponses neuronales aux monoamines. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Ces travaux ont été soutenus par une chaire de recherche du Canada en psychiatrie moléculaire et un Human Frontier Science Program Career Development Award (Jean-Martin Beaulieu) et par la bourse de recherche au doctorat de la Fondation Robert-Giffard (Thomas Del’Guidice). Nous remercions Danielle Beaulieu et Nathalie Bouchard pour leur patience dans la relecture de ce document.
|
1. Beaulieu JM, Sotnikova TD, Marion S. An Akt/beta-arrestin 2/PP2A signaling complex mediates dopaminergic neurotransmission and behavior. Cell 2005 ; 122 : 261-73. 2. Beaulieu JM, Tirotta E, Sotnikova TD, et al. Regulation of Akt signaling by D2 and D3 dopamine receptors in vivo.
J Neurosci 2007 ; 27 : 881-5. 3. Galandrin S, Oligny-Longpré G, Bouvier M. The evasive nature of drug efficacy: implications for drug discovery. Trends Pharmacol Sci 2007 ; 28 : 423-30. 4. Luttrell LM, Ferguson SS, Daaka Y, et al. Beta-arrestin-dependent formation of beta2 adrenergic receptor-Src protein kinase complexes. Science 1999 ; 283 : 655-61. 5. Beaulieu JM, Gainetdinov RR, Caron MG. Akt/GSK3 signaling in the action of psychotropic drugs. Annu Rev Pharmacol Toxicol 2009 ; 49 : 327-47. 6. Svenningsson P, Nishi A, Fisone G, et al. DARPP-32: an integrator of neurotransmission. Annu Rev Pharmacol Toxicol 2004 ; 44 : 269-96. 7. Woodgett JR. Judging a protein by more than its name: GSK-3. Sci STKE 2001 ; 2001 : RE12. 8. Beaulieu JM, Sotnikova TD, Yao WD, et al. Lithium antagonizes dopaminedependent behaviors mediated by an AKT/glycogen synthase kinase 3 signaling cascade. Proc Natl Acad Sci USA 2004 ; 101 : 5099-104. 9. Gainetdinov RR, Wetsel WC, Jones SR, et al. Role of serotonin in the paradoxical calming effect of psychostimulants on hyperactivity. Science 1999 ; 283 : 397-401. 10. Prickaerts J, Moechars D, Cryns K, et al. Transgenic mice overexpressing glycogen synthase kinase 3beta: a putative model of hyperactivity and mania. J Neurosci 2006 ; 26 : 9022-9. 11. Gould TD, Einat H, O’Donnell KC, et al. Beta-catenin overexpression in the mouse brain phenocopies lithium-sensitive behaviors. Neuropsychopharmacology 2007 ; 32 : 2173-83. 12. Beaulieu JM, Gainetdinov RR, Caron MG. The Akt-GSK-3 signaling cascade in the actions of dopamine. Trends Pharmacol Sci 2007 ; 28 : 166-72. 13. Ferguson SS, Downey WE 3rd, Colapietro AM, et al. Role of beta-arrestin in mediating agonist-promoted G protein-coupled receptor internalization. Science 1996 ; 271 : 363-6. 14. Lohse MJ, Benovic JL, Codina J, et al. beta-Arrestin: a protein that regulates beta-adrenergic receptor function. Science 1990 ; 248 : 1547-50. 15. Lefkowitz RJ, Shenoy SK. Transduction of receptor signals by beta-arrestins. Science 2005 ; 308 : 512-7. 16. Li X, Rosborough KM, Friedman AB, et al. Regulation of mouse brain glycogen synthase kinase-3 by atypical antipsychotics. Int J Neuropsychopharmacol 2007 ; 10 : 7-19. 17. Li X, Zhu W, Roh MS, et al. In vivo regulation of glycogen synthase kinase-3beta (GSK3beta) by serotonergic activity in mouse brain. Neuropsychopharmacology 2004 ; 29 : 1426-31. 18. Polter A, Yang S, Zmijewska AA, et al. Forkhead box, class O transcription factors in brain: regulation and behavioral manifestation. Biol Psychiatry 2009 ; 65 : 150-9. 19. Beaulieu JM, Zhang X, Rodriguiz RM, et al. Role of GSK3beta in behavioral abnormalities induced by serotonin deficiency. Proc Natl Acad Sci USA 2008 ; 105 : 1333-8. 20. Emamian ES, Hall D, Birnbaum MJ, et al. Convergent evidence for impaired AKTL-GSK3beta signaling in schizophrenia. Nat Genet 2004 ; 36 : 131-7. 21. Alimohamad H, Rajakumar N, Seah YH, Rushlow W. Antipsychotics alter the protein expression levels of beta-catenin and GSK-3 in the rat medial prefrontal cortex and striatum. Biol Psychiatry 2005 ; 57 : 533-42. 22. Beaulieu JM. Not only lithium: regulation of glycogen synthase kinase-3 by antipsychotics and serotonergic drugs. Int J Neuropsychopharmacol 2007 ; 10 : 3-6. 23. Phiel CJ, Klein PS. Molecular targets of lithium action. Annu Rev Pharmacol Toxicol 2001 ; 41 : 789-813. 24. Beaulieu JM, Caron MG. Looking at lithium: molecular moods and complex behaviour. Mol Interv 2008 ; 8 : 230-41. 25. Beaulieu JM, Marion S, Rodriguiz RM, et al. A beta-arrestin 2 signaling complex mediates lithium action on behavior. Cell 2008 ; 132 : 125-36. 26. Kovacsics CE, Gottesman II, Gould TD. Lithium’s antisuicidal efficacy: elucidation of neurobiological targets using endophenotype strategies. Annu Rev Pharmacol Toxicol 2009 ; 49 : 175-98. 27. Mao Y, Ge X, Frank CL, et al. Disrupted in schizophrenia 1 regulates neuronal progenitor proliferation via modulation of GSK3beta/beta-catenin signaling. Cell 2009 ; 136 : 1017-31. |