| |
| Med Sci (Paris). 2010 June; 26(6-7): 615–620. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7615.Maladies à prions Quel rôle pour les cellules dendritiques dans la pathogenèse des formes transmises ? Véronique Bachy and Pierre Aucouturier* Inserm UMR S 938 Université Pierre et Marie Curie, Paris 6, 184, rue du faubourg Saint-Antoine, 75012 Paris, France |
Les dernières décennies du XXe siècle ont vu l’identification d’un nouveau type d’agent infectieux, baptisé « prion » (protein infectious only) car sa seule conformation protéique semble porter l’ensemble des informations de son caractère pathogène [
29]. La protéine prion (PrP) est exprimée naturellement sous une forme physiologique (PrPc) chez les vertébrés, et c’est sa transconformation en une isoforme pathologique qui est à l’origine des « encéphalopathies spongiformes transmissibles » (EST). Cet événement moléculaire pathogène peut être lié à des mutations du gène codant la PrP dans les formes familiales à transmission autosomique dominante, ou survenir sans raison connue dans les formes sporadiques de la maladie de Creutzfeldt - Jakob, de loin les plus fréquentes chez l’homme. Mais de façon remarquable par rapport aux autres maladies conformationnelles, l’isoforme pathologique de la PrP (PrPsc, du nom « scrapie »> de l’EST du mouton) est capable d’induire in vivo la transconformation de la PrPc, ce qui lui confère les propriétés infectieuses du prion [
1]. La transmissibilité des EST est à l’origine de formes épidémiques touchant de nombreuses espèces animales domestiques et sauvages, ainsi que l’homme lorsque des pratiques particulières l’exposent à la contamination. Notre article ne concerne que ces formes transmises où la propagation des prions se fait à partir d’une inoculation périphérique. À côté des interrogations sur la contagiosité de différentes souches de prions chez une espèce donnée et parfois d’une espèce à une autre, plusieurs aspects de la pathogenèse des EST restent mal compris. Une grande partie de ces difficultés s’explique par des propriétés différentes des souches de prions et des espèces naturellement infectées, ainsi que par les incohérences entre les résultats observés dans des modèles expérimentaux multiples. Cependant, certains caractères génériques apparaissent clairement : infectiosité bien inférieure par la voie orale qu’après inoculation transcutanée ; périodes d’incubation remarquablement longues relativement à la durée des phases cliniques ; dès le début de l’incubation, accumulation, propagation et amplification cliniquement silencieuses des prions dans l’ensemble des tissus lymphoïdes, rapidement relayées par l’infection des structures nerveuses périphériques. C’est sur ce dernier aspect que nous essayerons ici d’analyser l’état actuel des connaissances. |
Sites anatomiques de l’accumulation des prions Les structures lymphoïdes en première ligne Les sites où s’accumule l’agent des EST ont été identifiés il y a plus de quarante ans dans le modèle de la tremblante murine, par la mesure des titres d’infectiosité 1 et de leur évolution, depuis l’inoculation jusqu’à la phase symptomatique [
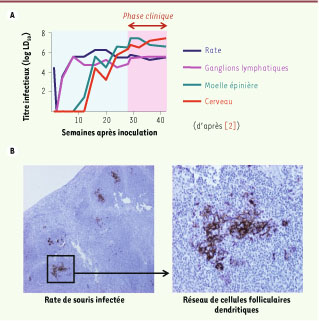
2], puis dans la plupart des EST naturelles et expérimentales : l’isoforme pathologique de la protéine prion (PrPsc) est d’abord détectée dans les follicules lymphoïdes des tissus muqueux les plus proches et dans les ganglions lymphatiques drainant le site d’inoculation (Figure 1). Dans les formes naturelles animales comme la tremblante du mouton ou le dépérissement chronique des cervidés, la voie d’infection est le tube digestif, et les premières structures lymphoïdes accumulant les prions sont donc les plaques de Peyer du tissu muqueux intestinal puis les ganglions lymphatiques mésentériques ; dans d’autres cas, comme chez l’homme les formes iatrogènes de maladie de Creutzfeldt-Jakob, la pénétration est transcutanée et les prions infectent d’abord les ganglions lymphatiques drainant le site correspondant. L’envahissement du tissu lymphoïde s’accompagne de modifications histologiques discrètes mais n’a pas de répercussion évidente sur les fonctions immunitaires. Cependant, dans les modèles expérimentaux étudiés, cette étape asymptomatique de lympho-invasion générale est déterminante pour la neuro-invasion : ainsi l’absence de la rate, par exemple, induit un retard de l’apparition de la phase clinique.  | Figure 1
Accumulation de la protéine prion pathologique (PrPsc) dans les organes lymphoïdes. A. Après inoculation par voie souscutanée d’une souche de prion (Chandler) adaptée à la souris, les organes lymphoïdes secondaires sont les premiers tissus où se multiplie l’agent infectieux, bien avant l’atteinte du système nerveux central et les premiers signes cliniques. B. Dans ces organes, un marquage immunohistochimique de la PrPsc montre que les prions s’accumulent principalement dans les cellules folliculaires dendritiques des centres germinatifs. |
Stockage de la PrPsc par les cellules folliculaires dendritiques À l’échelle cellulaire, c’est au niveau des cellules folliculaires dendritiques (FDC) des centres germinatifs qu’on détecte le mieux la PrPsc (Figure 1). Les FDC (qu’il ne faut pas confondre avec les cellules dendritiques classiques dont il est question plus loin) se différencient sur place à partir de précurseurs non hématopoïétiques sous l’influence de signaux fournis par les lymphocytes B qui se multiplient dans le centre germinatif. Chargées de présenter des antigènes aux cellules B, elles n’ont aucune capacité de migration hors du centre germinatif. Les FDC accumulent les prions, surtout à leur surface et d’une façon qui ressemble à leur mode de présentation des antigènes [
3]. Autre analogie avec la présentation des antigènes aux lymphocytes B, le système du complément favorise cette accumulation [
4,
5]. La forte expression de la forme cellulaire normale de la protéine prion (PrPc) par les FDC suggère que ces cellules sont un site important de la réplication des prions. Cependant il n’existe aujourd’hui, à notre connaissance, aucune preuve directe que la PrPsc accumulée provient d’une néosynthèse par les FDC elles-mêmes. Ces sites de stockage progressif dans les premières semaines de l’infection semblent faciliter la neuro-invasion, sans doute en permettant aux prions d’atteindre une concentration critique. Une dédifférenciation2 des FDC, obtenue en injectant une forme recombinante soluble du récepteur de la lymphotoxine-β, a pour conséquence un allongement significatif des périodes d’incubation de la tremblante expérimentale murine [
6,
7]. La PrPsc peut cependant être détectée dans d’autres cellules immunitaires que les FDC, et des études utilisant d’autres souches de prions suggèrent que l’accumulation dans les FDC n’est pas indispensable à la progression vers le système nerveux [
8,
9]. Il faut aussi noter que pour des quantités de prions 100 à 1 000 fois supérieures aux doses usuelles, l’étape de réplication dans les organes lymphoïdes périphériques n’est pas requise pour envahir le cerveau, comme l’ont montré des expériences d’inoculation d’animaux immunodéficients (souris SCID, severe combined immunodeficient, ou invalidées pour un des gènes RAG, recombination activating gene) [
10]. On peut donc penser que l’amplification lymphoïde des prions n’est nécessaire que pour atteindre un titre infectieux local suffisant pour assurer la neuro-invasion. La lympho-invasion commence peu avant l’envahissement du système nerveux périphérique local, comme cela a été montré en particulier lors d’infections par voie digestive dans de nombreux modèles expérimentaux et naturels. Dans certains de ces modèles, comme l’encéphalopathie spongiforme bovine, seule une partie des tissus lymphoïdes muqueux est infectée, alors que les mêmes prions chez l’homme s’y accumulent abondamment [
11]. De nombreux scientifiques considèrent que « la » voie empruntée par les prions à partir des tissus lymphoïdes pour atteindre le cerveau passe par les nerfs et la moelle épinière (voie nerveuse rétrograde). Finalement, les nombreux travaux qui visent à évaluer l’importance de l’accumulation des prions en périphérie pendant la période d’incubation suggèrent que leurs voies de propagation sont multiples. Les expériences de suppression des FDC ou du système nerveux périphérique ralentissent l’envahissement du système nerveux central mais ne l’empêchent pas tout à fait. L’implication de ces sites d’accumulation dans la pathogenèse semble donc partielle et une autre question essentielle se pose : comment les prions se propagent-ils dans l’organisme pour atteindre des sites de neuro-invasion efficaces ? |
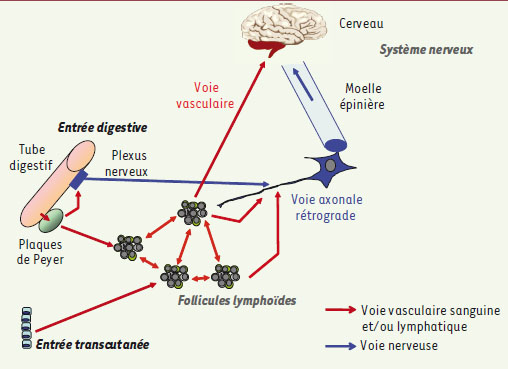
Propagation des prions depuis le site de pénétration Quelle que soit l’importance de la voie nerveuse rétrograde dans la pathogenèse, l’invasion rapide de l’ensemble des organes lymphoïdes secondaires et en particulier de la rate - témoigne d’une forte propagation par voie vasculaire. De multiples arguments suggèrent que la neuro-invasion commence par le tissu nerveux périphérique proche du lieu d’inoculation, où la PrPsc s’accumule et progresse lentement le long des fibres nerveuses selon un mécanisme encore obscur [
12]. Cependant, l’envahissement de l’ensemble du tissu lymphoïde ne peut que favoriser la progression de la maladie en multipliant les sites d’amplification des prions et les contacts avec des terminaisons nerveuses (Figure 2). Il apparaît donc essentiel de comprendre comment ces agents migrent dans l’organisme, au sein des tissus et dans les vaisseaux sanguins et lymphatiques. 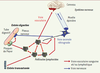 | Figure 2
Voies périphériques de la propagation des prions. La propagation progressive à l’ensemble du tissu lymphoïde par voie vasculaire (flèches rouges) multiplie les sites potentiels de neuro-invasion. |
Le rôle des cellules dendritiques comme potentiel vecteur des prions n’a été évoqué qu’assez récemment. On sait pourtant que certains virus exploitent les fonctions de ces cellules immunitaires pour leur dissémination dans l’organisme [
13]. Les cellules dendritiques (différentes des cellules folliculaires évoquées précédemment) sont issues d’un précurseur hématopoïétique de la moelle osseuse et incluent une grande variété de sous-populations : certaines résident dans les tissus, d’autres sont recrutées à partir des monocytes circulants [
14]. Elles expriment la PrP surtout dans leur forme mature activée, a l’exception d’une sous-population, les cellules dendritiques plasmacytoïdes [
15]. Leurs capacités fonctionnelles en font un candidat idéal pour capturer et transporter les prions puisqu’elles sont les sentinelles du système immunitaire, présentes dans la plupart des organes et en particulier la peau et les muqueuses où elles peuvent endocyter les agents étrangers, être activées par des signaux « de danger » puis migrer via les vaisseaux lymphatiques vers les tissus lymphoïdes où elles déclenchent les réponses immunitaires adaptatives. D’autres cellules très présentes dans les tissus périphériques et d’un lignage apparenté, les macrophages, ont aussi de fortes capacités d’endocytose mais ne migrent pas depuis leur site de maturation ; au cours des infections à prions, les macrophages pourraient plutôt participer à l’élimination de l’agent [
16]. Beaucoup de travaux un peu anciens s’appuyant sur des analyses histo I ogiques ont pu confondre les cellules dendritiques et les macrophages, dont la morphologie et le phénotype sont proches. Des travaux analysant in vitro le comportement de cellules dendritiques différenciées vis-a-vis de lignées de neuroblastomes infectées par des prions ont montré qu’au moins dans ces conditions expérimentales, elles peuvent dégrader la PrPsc endocytée [
17]. Ce n’est que plus récemment que des études in vivo ont permis de mieux appréhender les rôles des cellules dendritiques dans la pénétration et les différentes étapes de la dissémination des prions. |
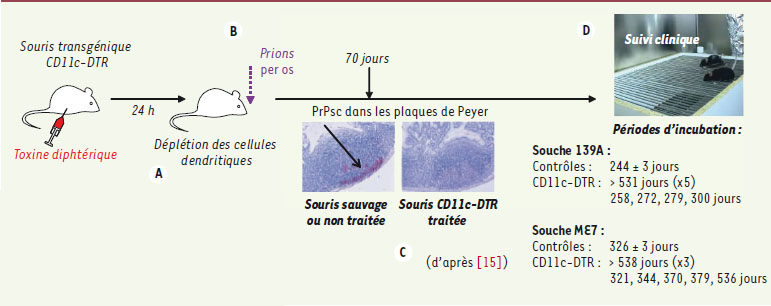
La barrière épithéliale du tube digestif explique que l’infectiosité du prion soit nettement plus faible par cette voie que par inoculation transcutanée. La voie orale est pourtant responsable de la dissémination de la plupart des formes épidémiques, telles la tremblante du mouton, la maladie du dépérissement chronique des cervidés d’Amérique du Nord, l’encéphalopathie spongiforme bovine et la nouvelle variante de la maladie de Creutzfeldt-Jakob. Les cellules dendritiques sont abondantes aussi bien dans la lamina propria de l’épithélium villeux, où elles peuvent capturer des pathogènes présents dans la lumière intestinale par des projections cytoplasmiques qui disjoignent les jonctions serrées de l’épithélium, que dans le dôme sous-épithélial des plaques de Peyer où elles peuvent endocyter les particules passant par les cellules M (cellules épithéliales spécialisées). L’implication des cellules dendritiques dans le passage des prions vers la muqueuse a été montrée par les expériences de Raymond et al. [
18] (Figure 3) : dans deux modèles de tremblante expérimentale murine (souches ME7 et 139A), la suppression temporaire et partielle des cellules dendritiques au moment de l’inoculation par alimentation empêche l’accumulation des prions dans les plaques de Peyer et les ganglions lymphatiques mésentériques ; elle retarde la survenue de la maladie, et l’empêche même totalement dans près de la moitié des cas. Notons cependant que ces résultats n’ont pas été reproduits lors d’une expérience ayant utilisé chez des souris l’inoculation par gavage d’une autre lignée [
19]. Enfin, un travail récent montre que la fraction C1 du complément et la calréticuline participent à la capture des prions par les cellules dendritiques : la calréticuline exprimée par les cellules dendritiques faciliterait l’endocytose d’agrégats de PrPsc recouverts de C1 [5].  | Figure 3
Cellules dendritiques et pénétration intestinale des prions. Chez la souris transgénique CD11c-DTR, l’injection detoxine diphtérique entraîne une déplétion rapide et transitoire des cellules dendritiques
(A)
. Les souris sont alors nourries avec une dose infectante de prions
(B)
, et à 10 semaines l’analyse immunohistochimique des plaques de Peyer en comparaison avec des souris sauvages traitées ou des souris transgéniques non déplétées montre un défaut d’accumulation dela PrPsc lorsque les cellules dendritiques ont été déplétées
(C)
. Le suivi clinique met en évidence un retard variable de l’apparition des signes neurologiques, et près de la moitié des souris CD11c-DTR traitées restent indemnes
(D)
. |
|
Migration vers les tissus lymphoïdes Quelques heures après inoculation par voie orale, une proportion notable des cellules dendritiques de la lymphe mésentérique est chargée de PrPsc [
20]. Plusieurs études suggèrent cependant que d’autres modes de transfert sont utilisés par les prions. Ainsi, l’inoculation sous-cutanée de souris avec des cellules dendritiques vivantes infectées par une souche de tremblante ne raccourcit que de 10 % environ la période d’incubation par rapport à une inoculation identique avec les mêmes cellules tuées [
21]. Chez les souris portant la mutation plt, le déficit en chimiokines CCL19 et CCL21 qui en résulte et affecte la migration des cellules dendritiques activées vers les tissus lymphoïdes n’entrave que très peu la propagation des prions et de façon variable selon les voies d’inoculation [21]. Enfin les cellules de Langerhans, cellules dendritiques résidentes de la peau, ne semblent pas impliquées dans le transport des prions après une inoculation cutanée mais pourraient au contraire participer à leur dégradation [
22]. Au total, il existe vraisemblablement de multiples systèmes qui permettent aux prions d’atteindre les sites de réplication que représentent les organes lymphoïdes périphériques. Les cellules dendritiques y participent de façon claire mais sans doute assez marginale. Parmi les cellules qui recirculent et pourraient aussi participer à la dissémination, les lymphocytes B et T sont bien sûr des candidats majeurs, en raison de leurs titres infectieux importants dans la rate au cours de l’incubation de la tremblante murine. Cependant leurs titres infectieux sont bien moindres dans le sang [
23]. |
Atteindre les sites de neuro-invasion Les cellules dendritiques immatures ayant une forte capacité d’endocytose sont abondantes dans les tissus lymphoïdes et dans la rate de souris infectées elles accumulent les prions qu’elles sont ensuite capables de conduire à des sites de neuro-invasion, comme nous l’avons montré par le transfert de cellules dendritiques infectées à des souris invalidées pour un gène RAG [
24]. À ce jour il est difficile de dire l’impact réel, dans l’histoire naturelle de la maladie, de ce rôle des cellules dendritiques dans les étapes ultimes de l’infection du système nerveux. Les cellules dendritiques ont de nombreuses propriétés qui peuvent leur conférer le potentiel de propager les prions vers des cellules nerveuses, comme la sécrétion d’exosomes [
25] ou la production de « nanotubes tunnels » qui peuvent entrer en contact avec les axones [
26]. Il est difficile d’identifier précisément les sites de neuro-invasion. L’article de G. Dorban et al. publié conjointement dans ce numéro de M/S (→) [
30] montre comment des cellules dendritiques pourraient faire le pont entre les sites d’accumulation dans le tissu lymphoïde et les terminaisons nerveuses adjacentes. Cependant il faut aussi noter que des cellules dendritiques peuvent pénétrer dans le parenchyme cérébral de souris infectées par des prions [
27], comme cela est observé au cours d’autres maladies neuro-inflammatoires. Une infection directe du système nerveux central via des cellules dendritiques traversant la barrière hématoencéphalique ne peut donc pas être exclue.
(→) page 610 de ce numéro
Les implications multiples des cellules dendritiques dans la pathogenèse des EST doivent donc encore être précisées, et les divergences entre les données actuelles suggèrent que ces rôles diffèrent selon la nature de l’hôte et la souche de prion. Il est possible, comme le présente une étude utilisant un modèle de souris transgénique déficiente en cellules dendritiques CD8+, que seules certaines sous-populations soient réellement impliquées [
28]. Quoiqu’il en soit, si leur rôle peut être important, elles n’apparaissent cependant pas comme une cible thérapeutique pertinente en raison de la diversité et de la complexité des voies de la neuroinvasion. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Cohen FE, Prusiner SB. Pathologic conformations of prion proteins. Annu Rev Biochem 1998 ; 67 : 793-819. 2. Eklund CM, Kennedy RC, Hadlow WJ. Pathogenesis of scrapie virus infection in the mouse. J Infect Dis 1967 ; 117 : 15-22. 3. Jeffrey M, McGovern G, Goodsir CM, et al. Sites of prion protein accumulation in scrapie-infected mouse spleen revealed by immune-electron microscopy. J Pathol 2000 ; 191 : 323-32. 4. Mabbott NA. The complement system in prion diseases. Curr Opin Immunol 2004 ; 16 : 587-93. 5. Flores-Langarica A, Sebti Y, Mitchell DA, et al. Scrapie pathogenesis: the role of complement C1q in scrapie agent uptake by conventional dendritic cells. J Immunol 2009 ; 182 : 1305-13. 6. Mabbott NA, Mackay F, Minns F, Bruce ME. Temporary inactivation of follicular dendritic cells delays neuroinvasion of scrapie. Nat Med 2000 ; 6 : 719-20. 7. Montrasio F, Frigg R, Glatzel M, et al. Impaired prion replication in spleens of mice lacking functional follicular dendritic cells. Science 2000 ; 288 : 1257-9. 8. Prinz M, Montrasio F, Klein MA, et al. Lymph nodal prion replication and neuroinvasion in mice devoid of follicular dendritic cells. Proc Natl Acad Sci USA 2002 ; 99 : 919-24. 9. Manuelidis L, Zaitsev I, Koni P, et al. Follicular dendritic cells and dissemination of Creutzfeldt-Jakob disease. J Virol 2000 ; 74 : 8614-22. 10. Klein MA, Frigg R, Raeber AJ, et al. PrP expression in B lymphocytes is not required for prion neuroinvasion. Nat Med 1998 ; 4 : 1429-33. 11. Hilton DA. Pathogenesis and prevalence of variant Creutzfeldt-Jakob disease. J Pathol 2006 ; 208 : 134-41. 12. Heikenwalder M, Julius C, Aguzzi A. Prions and peripheral nerves: a deadly rendez-vous. J Neurosci Res 2007 ; 85 : 2714-25. 13. Rinaldo CR Jr, Piazza P. Virus infection of dendritic cells: portal for host invasion and host defense. Trends Microbiol 2004 ; 12 : 337-45. 14. Buckwalter MR, Albert ML. Orchestration of the immune response by dendritic cells. Curr Biol 2009 ; 19 : R355-61. 15. Martinez del Hoyo, Lopez-Bravo M, Metharom P, et al. Prion protein expression by mouse dendritic cells is restricted to the nonplasmacytoid subsets and correlates with the maturation state. J Immunol 2006 ; 177 : 6137-42. 16. Beringue V, Demoy M, Lasmezas CI, et al. Role of spleen macrophages in the clearance of scrapie agent early in pathogenesis. J Pathol 2000 ; 190 : 495-502. 17. Luhr KM, Wallin RPA, Ljunggren HG, et al. Processing and degradation of exogenous prion protein by CD11c+ myeloid dendritic cells in vitro.J Virol 2002 ; 76 : 12259-64. 18. Raymond CR, Aucouturier P, Mabbott NA. In vivo depletion of CD11c+ cells impairs scrapie agent neuroinvasion from the intestine. J Immunol 2007 ; 179 : 7758-66. 19. Cordier-Dirikoc S, Chabry J. Temporary depletion of CD11c+ dendritic cells delays lymphoinvasion after intraperitonal scrapie infection. J Virol 2008 ; 82 : 8933-6. 20. Huang FP, Farquhar CF, Mabbott NA, et al. Migrating intestinal dendritic cells transport PrPsc from the gut. J Gen Virol 2002 ; 83 : 267-71. 21. Levavasseur E, Metharom P, Dorban G, et al. Experimental scrapie in « plt » mice: an assessment of the role of dendritic-cell migration in the pathogenesis of prion diseases. J Gen Virol 2007 ; 88 : 2353-60. 22. Mohan J, Bruce ME, Mabbott NA. Neuroinvasion by scrapie following inoculation via the skin is independent of migratory Langerhans cells. J Virol 2005 ; 79 : 1888-97. 23. Raeber AJ, Klein MA, Frigg R, et al. PrP-dependent association of prions with splenic but not circulating lymphocytes of scrapie-infected mice. EMBO J 1999 ; 18 : 2702-6. 24. Aucouturier P, Geissmann F, Damotte D, et al. Infected splenic dendritic cells are sufficient for prion transmission to the CNS in mouse scrapie.J Clin Invest 2001 ; 108 : 703-8. 25. Février B, Laude H, Raposo G, Vilette D. Les exosomes : des convoyeurs de prions ? MedSci (Parb) 2005 ; 21 : 132-3. 26. Gousset K, Schiff E, Langevin C, et al. Prions hijack tunnelling nanotubes for intercellular spread. Nat Cell Biol 2009 ; 11 : 328-36. 27. Rosicarelli B, Serafini B, Sbriccoli M, et al. Migration of dendritic cells into the brain in a mouse model of prion disease. J Neuroimmunol 2005 ; 165 : 114-20. 28. Sethi S, Kerksiek KM, Brocker T, Kretzschmar H. Role of the CD8+ dendritic cell subset in transmission of prions. J Virol 2007 ; 81 : 4877-80. 29. Crozet C, Lehmann S. Les prions : état des lieux 20 ans après l’apparition de l’encéphalopathie spongiforme bovine. MedSci (Paris) 2007 ; 23 : 1148-57. 30. Dorban G, Antoine N, Defaweux V. Les prions exploitent les communications neuro-immunitaires. Med Sci (Paris) 2010 ; 26 : 610-4. |