| |
| Med Sci (Paris). 2010 June; 26(6-7): 592–596. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7592.Mécanismes moléculaires du syndrome néphrotique idiopathique à rechutes Rôle de c-mip dans les dysfonctions podocytaires Shao-Yu Zhang, Vincent Audard, Philippe Lang, and Dil Sahali* Inserm U955, Institut Mondor de recherche biomédicale, Équipe 21 et service de néphrologie, Hôpital Henri Mondor, 8, avenue du Général Sarrail, 94010 Créteil, France MeSH keywords: Humains, Protéines membranaires, immunologie, physiologie, Syndrome néphrotique, anatomopathologie, physiopathologie, Podocytes |
Le syndrome néphrotique idiopathique (SNI) est une entité anatomo-clinique définie par une protéinurie sélective massive (> 3 g/24 heures) et une hypoalbuminémie (< 30 g/l) sans lésions glomérulaires visibles en microscopie optique et sans dépôts de complexes immuns en immunofluorescence. L’atteinte glomérulaire n’est pas associée à une infiltration de cellules sanguines ni à une prolifération de cellules résidantes. Le SNI comprend essentiellement deux formes, le syndrome néphrotique à lésions glomérulaires minimes (SNLGM ou néphrose lipoïdique) et la hyalinose segmentaire et focale primitive (HSFP). Le SNI représente 85 % des néphropathies d’origine glomérulaire de l’enfant et 25 à 30 % de celles de l’adulte. |
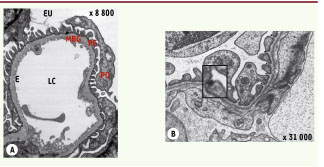
Physiopathologie moléculaire du SNI La fuite massive de protéines dans les urines résulte d’une hyperperméabilité de la barrière de filtration glomérulaire. Celui-ci est composé de trois types d’éléments : l’endothélium fenêtré du capillaire glomérulaire, la membrane basale glomérulaire et les cellules épithéliales viscérales très différenciées, appelées podocytes. Les podocytes sont des cellules polarisées baignant dans l’urine primitive de l’espace de Bowman et ancrées à la membrane basale par des expansions membrano-cytoplasmiques appelées pédicelles (Figure 1). 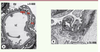 | Figure 1
Images en microscopie électronique de la barrière de filtration glomérulaire. A. Anse capillaire dans laquelle on voit de dedans en dehors la lumière du capillaire (LC) glomérulaire, l’endothélium fenestré (E), la membrane basale glomérulaire (MBG), le podocyte (Po) baignant dans l’urine primitive de l’espace urinaire (EU) et les expansions cytoplasmiques du podocyte ou pédicelles (pe) (grossissement x 8 800). B. Image d’une barrière de filtration à plus fort agrandissement. *Indique la localisation du diaphragme de fente entre deux pédicelles (grossissement x 31 000). |
Les altérations podocytaires, structurales et/ou fonctionnelles, sont réunies sous le terme de podocytopathies. Elles peuvent être à l’origine d’une protéinurie massive quel que soit le mécanisme lésionnel initial. Elles aboutissent à une perte de l’intégrité fonctionnelle de la barrière de filtration glomérulaire qui est réversible dans les formes sensibles au traitement et irréversible dans les formes résistantes. Une avancée importante dans la compréhension de l’architecture moléculaire du podocyte a été accomplie au cours de cette décennie grâce à l’identification de plusieurs gènes dont les mutations sont associées à la survenue d’un syndrome néphrotique corticorésistant [
1–
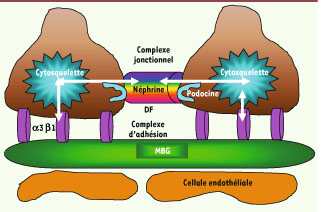
6]. L’étude de ces gènes a permis d’esquisser un modèle de fonctionnement du podocyte : le cytosquelette podocytaire y joue un rôle central en interagissant d’une part avec le diaphragme de fente1 et d’autre part avec le domaine basal, lequel permet l’ancrage de la cellule à la membrane basale glomérulaire (Figure 2). Tout processus qui interfère avec cette interconnexion dynamique est susceptible d’altérer le fonctionnement de la barrière de filtration et d’induire une protéinurie. 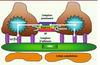 | Figure 2
Vue schématique de la barrière de filtration. Le cytosquelette podocytaire interagit d’une part avec le diaphragme de fente (DF) et d’autre part avec le domaine basal lequel permet l’ancrage de la cellule à la membrane basale glomérulaire (MBG). L’interaction entre les trois structures est dynamique et non statique. |
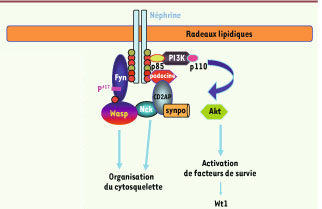
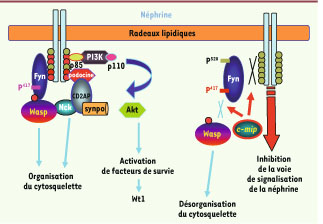
La néphrine, un constituant clé du diaphragme de fente, jouerait le rôle d’un récepteur transmembranaire qui, en réponse à sa liaison avec son ligand, non encore identifié, va déclencher une cascade d’activations. Ce processus présente des similitudes avec celui qui met en jeu le récepteur clonotypique du lymphocyte T, mais beaucoup d’acteurs moléculaires qui interviennent dans le lymphocyte ne sont pas exprimés dans le podocyte ou bien ne sont pas identifiés. La liaison de la néphrine à son ligand entraîne un regroupement des complexes dans des microdomaines lipidiques (lipid rafts). Cet événement va activer la protéine Fyn, un membre de la famille Src kinase, qui phosphoryle plusieurs résidus tyrosine situés à l’extrémité carboxy-terminale de la néphrine ; à ce niveau, des protéines kinases et des protéines adaptatrices sont recrutées qui se lient ensuite à la néphrine via leurs domaines SH2 [
7–
10]. La phosphorylation de la néphrine par Fyn a deux conséquences essentielles (Figure 3) : (1) elle active la PI3K via l’interaction du domaine SH2 de la sous-unité régulatrice p85 de cette dernière avec le domaine cytoplasmique de la néphrine tandis que la sous-unité catalytique p 110 génère des phosphoinositides capables de recruter et d’activer la sérine thréonine kinase Akt, qui joue un rôle clé dans les processus de survie du podocyte. (2) Elle stabilise le complexe fonctionnel néphrinepodocine [10]. En effet, la déphosphorylation de la néphrine provoque le détachement de la podocine et la liaison de la β-arrestine-2 à la néphrine qui subit alors une endocytose suivie d’une dégradation, interrompant ainsi la voie de signalisation [
11]. 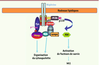 | Figure 3
Voies de signalisation impliquant la néphrine. La liaison de la néphrine à son ligand entraîne un regroupement des complexes dans des radeaux lipidiques, ce qui active la protéine Fyn. Fyn phosphoryle plusieurs résidus tyrosine carboxy-terminaux de la néphrine, recrutant des protéines kinases et des protéines adaptatrices qui se lient ensuite à la néphrine via leurs domaines SH2. La phosphorylation de la néphrine par Fyn active la PI3K : la sous-unité régulatrice p85 de cette dernière interagit avec le domaine cytoplasmique de la néphrine tandis que la sous-unité catalytique p110 via des phosphoinositides active la sérine thréonine kinase Akt. Fyn phosphoryle aussi N-WASP (Wiskott Aldrich syndrome protein) entraînant le recrutement et l’ancrage de NCK aux microdomaines lipidiques. |
Outre son rôle sur l’activation de la néphrine, Fyn interagit avec N-WASP (Wiskott Aldrich syndrome protein) qu’elle phosphoryle, entraînant le recrutement et l’ancrage de NCK aux microdomaines lipidiques [7,
8]. La famille des protéines adaptatrices Nck comprend Nck1 (Nckα) et Nck2 (Nckβ ou GRB4). Chacune possède trois domaines SH3 et un domaine SH2 carboxy-terminal [
12]. Nck se lie, via ses domaines SH3, à différentes protéines impliquées dans la régulation de l’actine tels que WASP et le complexe ARP2/3 [8] ; via ses domaines SH2, Nck se lie aux phosphotyrosines de la néphrine, ce qui permet une connexion étroite entre la plate-forme de signalisation et l’organisation du cytosquelette d’actine. |
Nos connaissances de la physiopathologie du syndrome néphrotique idiopathique à rechutes sont très préliminaires. Bien que l’origine dysimmunitaire reste largement admise du fait de l’efficacité des traitements corticoïdes et immunosuppresseurs, les mécanismes moléculaires responsables de la protéinurie massive, qui impliquent nécessairement un dysfonctionnement réversible du podocyte, restent inconnus. Pour tenter de comprendre ces mécanismes et identifier les gènes potentiellement en cause, nous avons réalisé un clonage soustractif et différentiel à partir de lymphocytes de patients atteints de syndrome néphrotique, prélevés en phase de poussée et en rémission. Ce travail a permis l’identification d’un nouveau gène appelé c-mip parce qu’il peut induire in vitro le facteur de transcription c-maf [
13,
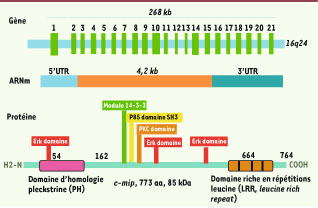
14]. Le gène c-mip s’étend sur 268 kpb et est localisé sur le chromosome 16 en position q23. L’analyse de la séquence primaire de la protéine c-mip (773 acides aminés) a mis en évidence l’existence d’un domaine pleckstrine (qui s’étend de la position 55 à 162) et d’une région riche en leucine (LRR, position 664-736). Plusieurs autres sites d’interaction protéique sont également identifiés, impliquant les protéines ERK1/2, la sous-unité régulatrice de la PI3 kinase (p85), la protéine 14-3-3, la protéine kinase C et une kinase à ADN (Figure 4). 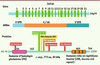 | Figure 4
Structure du gène c-mip. Voir explications dans le texte. |
Les premières investigations ont permis de montrer que ce gène était également coexprimé par le podocyte au cours des poussées. Fait intéressant, l’étude des formes cliniques de lymphome de Hodgkin compliquées de SNI ont révélé que le gène c-mip était coexprimé par la cellule tumorale de Reed-Sternberg2 et par le podocyte alors que l’expression de c-mip n’est pas détectée dans les formes cliniques de la maladie de Hodgkin qui ne s’accompagnent pas de syndrome néphrotique [
15]. Ces résultats préliminaires nous ont amené à étudier en profondeur le rôle de c-mip dans la physiopathologie du syndrome néphrotique. |
L’induction de c-mip dans le podocyte est associée à une protéinurie massive Dans un premier temps, pour comprendre si la surexpression de c-mip était intimement liée à la survenue du syndrome néphrotique, nous avons généré des souris génétiquement modifiées qui expriment sélectivement la forme humaine de c-mip dans le podocyte. Les souris ont été étudiées pendant plusieurs générations (jusqu’à la 16e) et développent régulièrement une protéinurie massive. Les études histologiques ont montré que le tissu rénal ne présentait pas de lésions inflammatoires ni d’infiltration cellulaire et que les glomérules avaient un aspect optiquement normal. L’étude en microscopie électronique mettait en évidence une fusion des pieds des podocytes que l’on observe généralement dans les syndromes néphrotiques. Pour éliminer un possible biais lié à la surexpression de la forme humaine de c-mip chez la souris, nous avons recherché si dans les modèles classiques de SN expérimental, la survenue de la protéinurie était associée à l’induction de c-mip. Nous avons étudié deux modèles de SN déclenchés respectivement par le LPS (lipopolysaccharide) et l’adriamycine (une anthracycline utilisée en chimiothérapie anticancéreuse). Dans les deux conditions expérimentales, l’induction de c-mip précédait le développement de la protéinurie massive [
16]. Ce résultat n’est pas surprenant compte tenu de l’homologie de séquence entre les formes murine et humaine de c-mip (> 98 %) mais il confirme la relation étroite entre l’expression de c-mip dans le podocyte et la survenue d’une protéinurie. |
C-mip empêche Fyn de phosphoryler la néphrine et désorganise le cytosquelette du podocyte Pour comprendre les conséquences fonctionnelles de la surexpression de c-mip dans le podocyte, nous avons cherché à identifier les protéines avec lesquelles c-mip interagissait en réalisant des expériences de double-hybride. Nous avons confirmé par des expériences de co-immunoprécipitation croisée que Fyn est un partenaire de c-mip [16], et démontré que c-mip interagissait in vitro avec Fyn et que cette interaction physique pouvait être directe [16]. La liaison de c-mip avec Fyn empêche celle-ci de se lier à la néphrine qui ne peut plus être phosphorylée. Ce mécanisme a pu être vérifié in vivo dans le modèle murin de souris transgénique exprimant c-mip humaine ainsi que dans les modèles expérimentaux de syndrome néphrotique. Ce résultat est corroboré par l’analyse des biopsies de malades atteints de SNI où nous avons pu montrer que la surexpression de c-mip était associée à une inhibition importante de la phosphorylation de la néphrine [16]. La liaison de c-mip avec Fyn a deux autres conséquences fonctionnelles sur le remaniement normal du cytosquelette. (1) Le recrutement de Nck dans le compartiment proximal du podocyte et sa liaison au domaine cytoplasmique de la néphrine, qui requiert la phosphorylation dépendante de Fyn, sont bloqués. La protéine N-WASP, qui joue un rôle clé dans la réorganisation du cytosquelette podocytaire et qui est naturellement phosphorylée par Fyn, est inactivée en présence de c-mip (Figure 5). Ces événements ont été démontrés in vitro et in vivo dans des modèles murins [16]. Ces résultats indiquent que la surexpression de c-mip dérégule des voies de signalisation critiques pour les fonctions podocytaires et permettent d’expliquer la protéinurie massive et la fusion des pieds des pédicelles, conséquence de la désorganisation du cytosquelette. 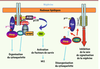 | Figure 5
Effets de c-mip sur la signalisation proximale relayée par la néphrine. A. voie de signalisation de la néphrine en l’absence de c-mip (voir Figure 3). B. Conséquences de l’expression de c-mip sur la signalisation de la néphrine. Fyn est un partenaire de c-mip, et c-mip interagit in vitro avec Fyn. La liaison de c-mip avec Fyn empêche Fyn de se lier à la néphrine qui ne peut plus être phosphorylée. La liaison de NCK au domaine cytoplasmique de la néphrine est bloquée, et la protéine N-WASP est inactivée. |
|
Extinction thérapeutique du gène c-mip
La découverte du rôle de c-mip dans les modèles murins de SNI et les données des biopsies rénales de patients atteints de SNI nous ont amenés à étudier si l’extinction du gène c-mip in vivo empêchait la survenue de la protéinurie dans un modèle expérimental de SNI. Nous avons choisi la technique d’extinction par ARN interférence en utilisant un nouvel agent permettant une meilleure pénétration cellulaire (Invivofectamine®). Des expériences préalables in vitro ont permis de sélectionner les siARN capables d’inhiber plus de 80 % de l’expression de c-mip. Nous avons utilisé le modèle murin de protéinurie induite par le LPS. Dans ce modèle, l’injection de LPS entraîne 24 heures plus tard une protéinurie importante [
17], concomitante de l’induction de c-mip [16]. Pour vérifier que le siARN était efficacement incorporé dans le podocyte, nous l’avons couplé à un fluorochrome. Les souris ont reçu les siARN par voie veineuse 30 minutes avant l’injection de LPS, puis elles ont été mises dans des cages métaboliques pour recueillir la protéinurie des 24 heures. Les souris ayant reçu le LPS seul ou le LPS avec Invivofectamine® développaient une protéinurie massive ; au contraire, la protéinurie des souris ayant reçu du LPS plus des siARN c-mip était réduite de plus de 80 % [16]. Les analyses par microscopie confocale ont montré qu’une quantité significative de siARN était incorporée dans les podocytes. Les études immunohistochimiques et immunochimiques quantitatives ont montré que le taux d’expression de c-mip était considérablement réduit dans les glomérules, comparativement aux contrôles [16]. |
Multiples rôles fonctionnels de c-mip
Nous avons récemment confirmé que c-mip interagit in vitro et in vivo avec la sous-unité régulatrice p85 de la PI3 kinase [
18]. La liaison de c-mip à p85 maintient p85 et la sous-unité catalytique p110 sous forme d’un complexe inactif. En effet, les expériences d’immunoprécipitation ont montré qu’en présence de c-mip, p110 est incapable de se dissocier de p85, ce qui est requis pour son activité catalytique. Cet effet est indépendant du type cellulaire puisqu’il a été observé dans les lymphocytes, les podocytes et plusieurs lignées cellulaires. Ce résultat permet d’expliquer pourquoi la surexpression de c-mip induit une inactivation de Akt qui est un substrat naturel de la PI3 kinase dont elle reflète l’activité. Par ailleurs, nous avons montré que c-mip inhibait l’activation de la voie NF-κB en séquestrant dans le compartiment cytosolique Rel A [
19]. D’autres partenaires potentiels sont en cours d’étude. |
Les résultats obtenus dans ce travail offrent un éclairage inédit sur les mécanismes moléculaires du syndrome néphrotique idiopathique à rechutes. Cet aspect de régulation négative de la signalisation podocytaire n’avait jamais été abordé jusqu’à maintenant. Ce travail ouvre donc un champ d’investigations passionnant sur le rôle des molécules inhibitrices dans les dysfonctions podocytaires. L’inhibition de c-mip in vivo par ARN interférence empêche le développement de la protéinurie, ce qui permet d’envisager des stratégies thérapeutiques chez l’homme. Beaucoup reste à faire compte tenu des multiples interactions de c-mip avec des protéines-clés de la signalisation, et il serait notamment important d’explorer le rôle de c-mip dans le système immunitaire. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Kestila M, Lenkkeri U, Mannikko M, et al. Positionally cloned gene for a novel glomerular protein-nephrin-is mutated in congenital nephrotic syndrome. Mol Cell 1998 ; 1 : 575-82. 2. Boute N, Gribouval O, Roselli S, et al. NPHS2, encoding the glomerular protein podocin, is mutated in autosomal recessive steroid-resistant nephrotic syndrome. Nat Genet 2000 ; 24 : 349-54. 3. Kim JM, Wu H, Green G, et al. CD2-associated protein haploinsufficiency is linked to glomerular disease susceptibility. Science 2003 ; 300 : 1298-300. 4. Kaplan JM, Kim SH, North KN, et al. Mutations in ACTN4, encoding alpha-actinin-4, cause familial focal segmental glomerulosclerosis. Nat Genet 2000 ; 24 : 251-6. 5. Reiser J, Polu KR, Moller CC, et al. TRPC6 is a glomerular slit diaphragm-associated channel required for normal renal function. Nat Genet 2005 ; 37 : 739-44. 6. Hinkes B, Wiggins RC, Gbadegesin R, et al. Positional cloning uncovers mutations in PLCE1 responsible for a nephrotic syndrome variant that may be reversible. Nat Genet 2006 ; 38 : 1397-405. 7. Jones N, Blasutig IM, Eremina V, et al. Nck adaptor proteins link nephrin to the actin cytoskeleton of kidney podocytes. Nature 2006 ; 440 : 818-23. 8. Verma R, Kovari I, Soofi A, et al. Nephrin ectodomain engagement results in Src kinase activation, nephrin phosphorylation, Nck recruitment, and actin polymerization. J Clin Invest 2006 ; 116 : 1346-59. 9. Verma R, Wharram B, Kovari I, et al. Fyn binds to and phosphorylates the kidney slit diaphragm component Nephrin. J Biol Chem 2003 ; 278 : 20716-23. 10. Li H, Lemay S, Aoudjit L, et al. SRC-family kinase Fyn phosphorylates the cytoplasmic domain of nephrin and modulates its interaction with podocin. J Am Soc Nephrol 2004 ; 15 : 3006-15. 11. Quack I, Rump LC, Gerke P, et al. beta-Arrestin2 mediates nephrin endocytosis and impairs slit diaphragm integrity. Proc Natl Acad Sci USA 2006 ; 103 : 14110-5. 12. Chen M, She H, Davis EM, et al. Identification of Nck family genes, chromosomal localization, expression, and signaling specificity. J Biol Chem 1998 ; 273 : 25171-8. 13. Sahali D, Pawlak A, Valanciute A, et al. A novel approach to investigation of the pathogenesis of active minimal : change nephrotic syndrome using subtracted cDNA library screening. J Am Soc Nephrol 2002 ; 13 : 1238-47. 14. Grimbert P, Valanciute A, Audard V, et al. Truncation of C-mip (Tc-mip), a new proximal signaling protein, induces c-maf Th2 transcription factor and cytoskeleton reorganization. J Exp Med 2003 ; 198 : 797-807. 15. Audard V, Zhang SY, Copie-Bergman C, et al. Occurrence of minimal change nephrotic syndrome in classical Hodgkin’s lymphoma is closely related to the induction of c-mip in Hodgkin-Reed Sternberg cells and podocytes. Blood 2010 (sous presse). 16. Zhang SY, Kamal M, Dahan K, et al. C-mip impairs podocyte proximal signaling and induces heavy proteinuria. Science Signaling 2010 (sous presse). 17. Reiser J, von Gersdorff G, Loos M, et al. Induction of B7-1 in podocytes is associated with nephrotic syndrome. J Clin Invest 2004 ; 113 : 1390-7. 18. Kamal M, Pawlak A, Mohamed FB, et al. C-mip interacts with the p85 subunit of PI3 kinase and exerts a dual effect on ERK signaling via the recruitment of Dip1 and DAP kinase. FEBS Lett 2010 (sous presse). 19. Kamal, M., A. Valanciute, K. Dahan, et al. C-mip interacts physically with RelA and inhibits nuclear factor kappa B activity. Mol Immunol 2009 ; 46 : 991-8. 20. Ronco P, Debiec H, Guigonis V. Allo-immunisation fœto-maternelle anti-CD10. Med Sci (Paris) 2009 ; 25 : 69-76. |