| |
| Med Sci (Paris). 2010 June; 26(6-7): 585–588. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7585.L’épiderme et les astrocytes influencent la réponse systémique à l’hypoxie et la sécrétion d’érythropoïétine Dominique Labie1 and Laure Coulombel2 1Inserm U567, CNRS UMR 8104, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France 2Médecine/Sciences, ADR Inserm, 2, rue d’Alésia, 75014 Paris, France MeSH keywords: Astrocytes, physiologie, Épiderme, Érythropoïétine, Humains, Hypoxie, physiopathologie, Rein, Consommation d'oxygène, Phénomènes physiologiques de la peau |
Une réponse adaptative essentielle à un environnement hypoxique est l’augmentation de la synthèse rénale de l’érythropoïétine (EPO) qui entraîne à son tour toute une série de réactions systémiques - dont la production accrue de réticulocytes et de globules rouges - mais également extrahématopoïétiques [
1]. L’induction du gène epo est contrôlée par la fixation du facteur de transcription HIF (hypoxia inducible factor) en 3’ du gène sur un élément HRE (hypoxia responsive elemen t). HIF est un dimère des sous-unités alpha et bêta dont il existe 3 isoformes. Si HIF-1 est la plus étudiée, on sait maintenant que le contrôle de HIF-2 se distingue de celui de HIF-1. En conditions normoxiques, les sous-unités alpha sont extrêmement instables et sont hydroxylées (par la prolylhydroxylase qui est le senseur tissulaire de l’oxygène). Elles interagissent alors avec la protéine VHL (von Hippel Lindau) qui provoque leur ubiquitinylation et leur dégradation [
2]. Chez les mammifères, il est couramment admis que la réponse systémique à l’hypoxie est avant tout le fait d’une réponse rénale [
3]. Les observations d’une synthèse d’EPO par les astrocytes [
4], ou encore d’une sensibilité directe des kératinocytes à la concentration en oxygène de l’air ambiant (par analogie avec le modèle des amphibiens) sont restées marginales ou considérées comme des processus de régulation purement locaux. L’équipe de Randall S. Johnson, de l’UCSD (University of California San Diego), remet en question ce dogme dans deux articles publiés dans Cell en 2008 [
5] et J Clin Invest en 2009 [
6] en démontrant que la peau et les cellules gliales du système nerveux prennent une part active à la réponse systémique à l’hypoxie et notamment dans le contrôle de la synthèse d’EPO. La stratégie expérimentale utilisée est la même dans les deux articles : analyse de la réaction à l’hypoxie de souris dont les gènes hif et vhl sont sélectivement inactivés dans la peau ou les astrocytes. |
L’épiderme dans la réponse à l’hypoxie La peau semble se comporter comme un organe hypoxique [
7] : en effet, les kératinocytes fixent le nitroimidazole EF5, un marqueur spécifique des zones hypoxiques, et expriment un taux élevé de transcrits HIF-1. Pour analyser cette question plus précisément, les auteurs ont construit un mutant K14cre+ HIF-1
+f/+f
que caractérise une inhibition spécifique de l’expression de HIF-1 dans les kératinocytes (l’expression de cre étant contrôlée par le promoteur de la kératine 14), ce qui ne compromet pas la survie des animaux et ne modifie pas, à l’état normoxique basal (20 % O2), leurs paramètres hématologiques. En revanche, la réponse des mutants à une atmosphère hypoxique (9 % O2) est anormale : le taux plasmatique d’EPO, qui s’élève de 30 fois chez les souris sauvages, n’atteint que 30 % de cette valeur chez les mutants et s’accompagne d’un défaut de réponse transcriptionnelle du gène epo dans le rein, ce qui prouve l’intervention de la réaction cutanée à l’hypoxie dans la régulation rénale de l’EPO. Ce défaut ne se voit pas chez les mutants K14cre+/HIF-2
+f/+f
qui réagissent normalement suggérant donc très fortement un rôle déterminant de HIF-1α dans l’induction de l’EPO au niveau de l’épiderme. De même, les mutants dépourvus d’expression de VHL dans l’épiderme (K14cre+/VHL
+f/
+
f
), ce qui stabilise ainsi l’expression des HIF-1α et -2α, ont un hématocrite élevé et des taux élevés de réticulocytes et d’EPO. Cette surexpression d’EPO est majoritairement hépatique et non rénale. Les auteurs ont dupliqué ces résultats dans un modèle de déplétion conditionnelle de VHL chez l’adulte, éliminant un possible retentissement de l’absence de VHL et de la surexpression de HIF-1/2 dans la peau au cours du développement. L’utilisation de doubles et triples mutants par croisement de souris knockout conditionnelles HIF-1
+f/+f
et/ou HIF-2
+f/+f
avec les animaux chez lesquels vhl est inactivé dans les kératinocytes a permis de démontrer l’action prédominante de HIF-2 dans le phénotype du mutant k14cre-VHL : son invalidation rétablit le taux d’EPO, à un niveau équivalent à celui du témoin, alors que la délétion épidermique de HIF-1 dans ces mutants K14creVHL
+f/+f
n’est pas suffisante pour contrebalancer ce dernier effet. Cette observation met en évidence un rôle différentiel net des deux sousunités HIF-1α et HIF-2 α selon que VHL est fonctionnel ou non [
8]. La voie NO/iNOS est un intermédiaire essentiel de l’action de HIF dans l’épiderme On sait qu’un des signaux déclenchant la réponse hypoxique dans le rein et le foie est le flux sanguin. Or, chez les mutants K14creVHL
+f/+f
, le flux sanguin est dévié vers l’épiderme aux dépens du rein et du foie. Il en résulte une diminution de la pression sanguine et une hypoxie dans ces deux organes. Or, l’oxyde nitrique (NO) - un régulateur majeur du tonus vasculaire et notamment un vasodilatateur - est élevé chez les mutants. En effet, inos ( inducible oxide nitric synthase) est un gène cible de la réponse transcriptionnelle de HIF à l’hypoxie. Il était donc légitime d’analyser l’implication de la voie NO/iNOS dans cette déviation du flux sanguin vers la peau. Les auteurs ont vérifié chez des souris normales une observation faite chez des rats : l’inhibition générale de synthèse de NO par le L-NAME (N(G)-nitro-Larginine méthyl ester) chez un animal témoin se traduit par une augmentation systémique de la production d’EPO (20 %). Chez le mutant K14creVHL
+f/+f
, l’administration de L-NAME aboutit, elle, à une diminution de la vasodilatation cutanée et donc à une diminution du taux d’EPO systémique qui rejoint celui des animaux non mutants traités. La signalisation NO s’avère donc un intermédiaire essentiel par lequel la modification de HIF au niveau cutané module la stimulation de la synthèse d’EPO. L’implication de cette voie est confirmée par l’action d’un donneur de NO (nitroglycérine) : sans effet s’il est administré par voie générale, il induit une synthèse rénale d’EPO (× 7) s’il est délivré sous forme d’un timbre cutané. Il existe donc une régulation très spécifique du flux sanguin dans l’épiderme qui peut détourner le flux des territoires splanchniques vers la peau, induisant un signal hypoxique dans ces territoires qui sont aussi les principaux pourvoyeurs d’EPO. La peau « respire »-t-elle ? L’EPO intervient surtout dans l’adaptation à une hypoxie chronique, et on peut se demander quel serait le rôle de la peau en cas d’hypoxie aiguë. Dans cette situation, la réponse cardiorespiratoire prédomine et, via une vasoconstriction pulmonaire indépendante de HIF, elle dérive immédiatement l’intensité du flux sanguin vers le cerveau et le foie. Pour tester le rôle de la peau, des souris normales ont été placées de telle façon que la concentration en oxygène soit différente au niveau de la tête (air respiré) et du corps (reflétant l’oxygénation de la peau). Si l’air inspiré est hypoxique (10 % O 2) et que la souris est exposée entièrement à une atmosphère hypoxique (10 % O 2), on observe (au bout de 5 heures) une élévation importante du taux d’EPO (et des transcrits epo rénaux) ; celle-ci est plus que doublée si la peau est exposée à des conditions normoxiques (21 % O 2). Cette adaptation du taux d’EPO à une modification de l’oxygénation cutanée est abolie chez les mutants K14creHIF-1α
+f/+f
, confirmant qu’elle fait intervenir HIF-1. Si l’on mesure au bout d’une heure directement la réponse vasculaire immédiate (grâce a des microbilles fluorescentes) chez ces souris en hypoxie respiratoire, on constate qu’une hypoxie cutanée entraîne une vasoconstriction, mais que si le reste du corps est placé en normoxie, il y a une dérivation massive (x 10) du flux vers la peau, ce qui diminue le flux rénal et hépatique et stimule la réponse hypoxique systémique. Cette réaction immédiate ferait intervenir le même canal potassium Kv1.5 qui contrôle la vasoconstriction pulmonaire et confirme que la peau intervient aussi dans la régulation de la réponse du tonus vasculaire a une hypoxie aiguë [
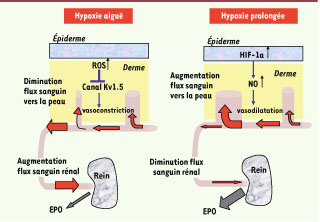
9].  | Figure 1
Réponse de la peau à l’hypoxie. À gauche, la réponse immédiate (< 1 heure) a une hypoxie aiguë met peut-être en jeu des mécanismes identiques a ceux qui entraînent une vasoconstriction pulmonaire via le canal potassique Kv1.5. À droite, l’adaptation a une hypoxie plus prolongée (> 5 heures) fait intervenir les facteurs HIF-1 et une modulation du flux sanguin. L’intensité du flux sanguin est illustrée par la largeur des flèches rouges, et la vasodilatation ou la vasoconstriction cutanée par la largeur des vaisseaux (inspiré de [ 5]). |
|
Les astrocytes : source d’EPO lors d’une hypoxie aiguë On sait que des sources alternatives d’EPO existent, dont le foie et le cerveau, mais elles ne compensent pas la défaillance de la production rénale, par exemple chez les patients atteints d’insuffisance rénale [
10]. Dans le cerveau, l’EPO est produite par les neurones et les astrocytes (la population majoritaire des cellules gliales), mais les doutes sur sa capacité a traverser la barrière hémato-encéphalique expliquent qu’on lui ait attribué majoritairement un rôle paracrine local, notamment de neuroprotection [
11]. Suivant la même logique que précédemment et la même stratégie expérimentale, le groupe de Randall Johnson démontre que l’EPO d’origine astrocytaire joue un rôle non négligeable dans la régulation de l’érythropoïèse, et ce via la voie HIF-. Les trois gènes hif-1α, hif-2α et vhl sont inactivés sélectivement dans les astrocytes via le système cre-lox, l’expression de la recombinase étant placée sous contrôle du promoteur GFAP (glial fibrillary acidic protein) spécifique de la lignée astrocytaire. Les animaux transgéniques recombinants sont tous viables a la naissance mais, alors que l’inactivation de hif-1 ou hif-2 seule dans les astrocytes n’a pas de conséquences pathologiques, celle de vhl (GFAPcre+VHL
+f/+f
) entrave la croissance de l’animal et abrège sa durée de vie. On constate en particulier des déficits neurologiques, troubles locomoteurs et hydrocéphalie témoignant d’une perméabilité de la barrière hématoencéphalique, mais ce qui est frappant, c’est l’élévation extrême de l’hématocrite (environ 80 % dès 5 semaines) du nombre de réticulocytes et du taux d’EPO plasmatique (x 5). Chez ces mutants GFAPcre+VHL
+f/+f
, l’augmentation des transcrits d’EPO atteint 2 000 fois le taux normal dans les astrocytes, alors que la sécrétion rénale d’EPO est effondrée, témoignant d’un rétrocontrôle négatif fonctionnel qui confirme la responsabilité de l’EPO astrocytaire dans les altérations systémiques observées. Curieusement la synthèse hépatique d’EPO persiste. Le croisement de ces souris avec des animaux knock-out pour les gènes hif-α a permis d’incriminer HIF-2 dont la délétion rétablit un hématocrite et une survie normaux chez les souris GFAPcre+VHL
+f/+f
alors que celle de HIF-1 semble plutôt aggraver le phénotype. En même temps qu’elle induit la production d’EPO, la délétion de Vhl stimule aussi la production du VEGF (vascular endothelial growth factor) qui est une cible de VHL [
12]. Toutefois, la délétion de vegf, si elle réduit les conséquences non hématologiques du phénotype mutant GFAPcre+VHL
+f/+f
, n’en corrige pas les altérations hématologiques. L’EPO astrocytaire s’élève rapidement chez des souris normales exposées a une atmosphère hypoxique, et la délétion de hif-2 dans les astrocytes minimise cette réponse qui est complètement abolie chez les doubles mutants hif-1 et hif-2. Curieusement, en l’absence de HIF-2 astrocytaire, les taux d’EPO plasmatiques restent bas dans ces premières heures, indiquant que ni le rein ni le foie ne compensent cette diminution d’EPO astrocytaire. Logiquement, l’augmentation du nombre d’érythroblastes médullaires et donc de réticulocytes est moindre chez les souris GFAPcre+HIF-2
+f/+f
. Ces mêmes défauts sont observés chez ces animaux GFAPcre+HIF
+f/+f
après une saignée, autre stimulus puissant de la synthèse d’EPO rénale. Mais dans les deux cas, une correction intervient au-delà de 72 heures. La normalisation tardive des paramètres suggère que l’EPO cérébrale est impliquée dans la réponse aiguë à l’hypoxie, et qu’elle précède la réponse rénale, comme un garde-fou préservant l’oxygénation du cerveau dans l’urgence. Il semble donc que le rôle de l’EPO du cerveau soit moins confidentiel qu’on ne le pense et contribue à la régulation systémique de la réponse à l’hypoxie. Il faut alors admettre que l’hormone traverse la barrière hémato-méningée [
13]. Reste à comprendre pourquoi la réponse rénale ne pourrait intervenir aussi précocément que la réponse astrocytaire. |
Ces deux articles montrent à l’évidence que l’explication simpliste de la production d’EPO quasi exclusive par le rein en réponse à une baisse de la teneur en oxygène du sang doit évoluer. La production astrocytaire d’EPO s’avère être un élément essentiel à la préservation de l’oxygénation cérébrale face au danger d’une hypoxie aiguë, et les réactions du tonus vasculaire, souvent immédiates dans un organe très exposé comme la peau, s’avèrent être des acteurs incontournables qui modulent l’apport de sang aux organes synthétisant l’EPO. Mais le plus grand mérite de Randall Johnson est peut-être d’avoir donné une explication moléculaire aux très anciennes observations de nos collègues français... P. Carnot et C. Deflandre proposaient en 1906 l’idée d’une « hémopoïétine » cérébrale ; C. Durand observait en 1969 une vasoconstriction cutanée chez les voyageurs séjournant en haute altitude, réaction que ne provoquait pas l’inhalation seule d’une atmosphère hypoxique ; d’autres auteurs encore induisaient une érythropoïèse après stimulation cérébrale chez le chat, ou la constataient chez un patient ayant une occlusion d’une artère cérébrale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Les auteurs remercient Nathalie Mazure (CNRS, UMR 6543, Université de Nice) pour la relecture critique de ce texte.
|
1. Semenza GL. Involvement of oxygen-sensing pathways in physiologic and pathologic erythropoiesis. Blood 2009; 114 : 2015-9. 2. Weidemann A, Johnson RS. Biology of HIF-1. Cell Death Differ 2008; 15 : 621-7 3. Semenza GL. O2-regulated gene expression : transcriptional control of cardiorespiratory physiology. J Appl Physiol 2004; 96 : 1173-7. 4. Chavez JC, Baranova O, Lin J, Pichiule P. The transcriptional activator hypoxia inducible factor 2 (HIF-2/EPAS-1) regulates the oxygen-dependent expression of erythropoietin in cortical astrocyte. J Neurosci 2006; 26 : 9471-81. 5. Boutin AT, Weidemann A, Fu Z, et al. Epidermal sensing of oxygen is essential for systemic hypoxic response. Cell 2008; 133 : 223-34. 6. Weidemann A, Kerdiles YM, Knaup KX, et al. The glial cell response is an essential component of hypoxiainduced eryythropoiesis in mice. J Clin Invest 2009; 119 : 3373-8. 7. Minson CT. Hypoxic regulation of blood flow in humans. Skin blood flow and temperature regulation. Adv Exp Med Biol 2003; 543 : 249-62. 8. Rankin EB, Biju MP, Unger TL, et al. Hypoxia-inducible factor 2 (HIF-2) regulates hepatic erythropoietin in vivo. J Clin Invest 2007; 117 : 1068-77. 9. Moudgil R, Michelakis ED, Archer SL. The role of K+ channels in determining pulmonary vascular tone, oxygen sensing, cell proliferation, and apoptosis: implications in hypoxic pulmonary vasoconstriction and pulmonary arterial hypertension. Microcirculation 2006; 13 : 615-32. 10. Weidemann A, Johnson RS. Nonrenal regulation of EPO synthesis. Kidney Int 2009; 75 : 682-8. 11. Dame C, Juul SE, Christensen RD. The biology of erythropoietin in the central nervous system and its neurotrophic and neuroprotective potential. Biol Neonate 2001; 79 : 228-35. 12. Gerber HP, Hillan KJ, Ryan AM, et al. VEGF is required for growth and survival in neonatal mice. Development 1999; 126 : 1149-59. 13. Banks WA, Jumbe NL, Farrell CL, et al. Passage of erythropoietic agents across the blood-brain barrier : a comparison of human and murine erythropoietin and the analog darpoetin alfa. Eur J Pharmacol 2004; 505 : 93-101. |