| |
| Med Sci (Paris). 2010 June; 26(6-7): 568–571. Published online 2010 June 15. doi: 10.1051/medsci/2010266-7568.La drogue : une histoire d’histone ? Denis Hervé* Inserm UMR-S839, Institut du Fer à Moulin, Université Pierre et Marie Curie, 17, rue du Fer à Moulin, 75005 Paris, France MeSH keywords: Encéphale, physiologie, physiopathologie, Chromatine, génétique, métabolisme, Histone, Humains, Méthylation, Noyau accumbens, Troubles liés à une substance |
Pourquoi certains individus ne peuventils s’empêcher de se droguer en dépit de tous les problèmes que cela leur pose ? Il existe tout un champ des neurosciences dont l’objectif est d’expliquer ce comportement d’addiction aux drogues en termes de mécanismes cérébraux. C’est en effet un comportement qui se prête relativement bien à l’étude expérimentale dans la mesure où les animaux s’auto-administrent à peu près toutes les drogues dont l’homme abuse. Les points de vue développés par les différentes équipes sont loin d’avoir abouti à un consensus général et ne permettent pas encore de proposer un modèle unique des mécanismes neuronaux soustendant l’addiction aux drogues. L’une des approches dominantes est soutenue par les travaux du laboratoire d’Eric Nestler depuis plus d’une quinzaine d’années [
1]. Le travail de ce laboratoire, mais aussi de beaucoup d’autres groupes à travers le monde, se fonde sur l’idée que la prise de drogue entraîne certaines altérations spécifiques dans le système nerveux qui vont permettre l’apparition des symptômes de l’addiction. Ces altérations touchent principalement le réseau de la récompense, un vaste ensemble de structures cérébrales interconnectées qui jouent un rôle primordial dans l’adaptation du comportement aux besoins. Parmi les différentes connexions qui constituent le réseau de la récompense, les neurones qui utilisent la dopamine comme neurotransmetteur (neurones dopaminergiques) jouent un rôle de premier plan. Ces neurones s’activent lorsque l’animal, mais aussi l’homme, reçoit une récompense inattendue ou qu’il perçoit un signal annonciateur d’une récompense. Le réseau de la récompense se sert de cette activité pour mémoriser les événements associés et fixer les comportements permettant d’obtenir à nouveau la récompense [
2]. Toutes les drogues sont capables de stimuler la transmission dopaminergique dans le cerveau et deviennent ainsi des récompenses pour le cerveau [2,
3]. |
Rôle des altérations de l’expression de gènes dans l’addiction Le laboratoire d’Eric Nestler a émis l’hypothèse d’une modification de l’expression de gènes comme un mécanisme plausible de l’addiction à la drogue étant donné la stabilité des perturbations comportementales qui définissent cet état. Depuis presque vingt ans, les travaux de ce laboratoire apportent des arguments en faveur de cette hypothèse en examinant comment des traitements chroniques par les drogues, principalement la cocaïne et la morphine, modifient l’expression de gènes dans le noyau accumbens, une petite structure cérébrale du réseau de la récompense qui est richement innervée par les neurones dopaminergiques et dont le rôle dans l’addiction aux drogues est bien démontré [
4]. Cette équipe a réussi à démontrer que des changements de l’expression de gènes sont en partie responsables de certaines altérations associées à l’état d’addiction, comme des modifications de la transmission dopaminergique ou glutamatergique, ou le remodelage morphologique de certains types neuronaux. L’idée sous-jacente est que ces altérations changent l’état fonctionnel du noyau accumbens et déclenchent la pathologie. Cette équipe a montré le rôle prédominant du facteur de transcription delta-FosB qui s’accumule dans le noyau accumbens des animaux traités de façon chronique avec la plupart des drogues d’abus (opiacés, cocaïne, nicotine, éthanol, cannabinoïdes, etc.) [4]. Ce facteur de transcription résulte d’un épissage alternatif des ARNm du gène fosB et présente la propriété d’être beaucoup plus stable que les autres isoformes de cette protéine. Un traitement journalier de cocaïne administrée par l’expérimentateur ou une autoadministration répétée par l’animal entraîne une accumulation progressive de delta-FosB qui se prolongerait quelques semaines après l’arrêt de la drogue. Cette accumulation expliquerait certains symptômes de l’addiction, puisque des souris surexprimant delta-FosB dans le noyau accumbens présentent certains traits comportementaux ressemblant à ceux que l’on rencontre au cours de l’état d’addiction. |
Rôle des modifications de la chromatine Depuis quelques années le laboratoire d’Eric Nestler et d’autres ont montré que des modifications épigénétiques dans le noyau accumbens jouent un rôle important dans la régulation de l’expression de gènes qu’induisent les drogues [
5,
6]. Historiquement, le terme d’épigenèse décrit des mécanismes par lesquels certains traits peuvent être hérités sans changement de la séquence d’ADN [
7]. Cette équipe et d’autres dans le domaine élargissent son sens et désignent sous ce terme des modifications de la chromatine ou de l’ADN (sans modification de séquence) qui sont provoquées par certains signaux externes et qui maintiennent dans le temps certains états d’activité altérée sans qu’il y ait une nécessité de passage d’une génération à une autre. En particulier, nous savons que des modifications covalentes (phosphorylation, acétylation, méthylation) des histones contrôlent l’expression des gènes. Dans le noyau, l’ADN s’enroule autour d’octamères composés de deux copies des histones H2A, H2B, H3 et H4, le tout formant un nucléosome [
8]. Les histones ont une structure globulaire à l’exception de leur extrémité amino-terminale qui peut subir des modifications posttraductionnelles complexes. Celles-ci modulent l’interaction des histones avec l’ADN et peuvent réguler la capacité de l’ADN à être transcrit dans un sens positif ou négatif. La combinatoire de ces modifications peut donc ajuster très finement la transcription de gènes situés à proximité en modulant l’activité de la machinerie transcriptionnelle. |
Diminution de l’histone méthyltransférase G9a par la cocaïne administrée de façon chronique On a montré au cours des dernières années que le traitement d’animaux par les drogues affectait la machinerie responsable des modifications post-traductionnelles de la chromatine avec notamment des effets sur la phosphorylation et l’acétylation d’histones spécifiques [
9–
11]. Dans un article récent, l’équipe d’Eric Nestler a étendu encore cette notion en montrant que les traitements chroniques affectaient l’état de méthylation d’histones, ce qui interviendrait dans l’addiction aux drogues [
12]. Cet article fait suite à un précédent publié par le même groupe en 2009 [
13] qui montrait, entre autres, un profil altéré de méthylation de l’histone H3 sur ses résidus lysine 9 (K9) et lysine 27 (K27) au niveau de certains gènes spécifiques dans le noyau accumbens après une administration répétée de cocaïne. La méthylation des histones est un processus complexe : elle affecte les résidus lysine et arginine et se présente sous forme d’une monoou diméthylation ou même triméthylation sur le résidu lysine. Ses effets de proximité sur la transcription des gènes sont complexes puisque l’effet est positif ou négatif suivant la nature de l’histone touchée, le résidu modifié ou le niveau de méthylation [
14]. Dans l’article de Maze et al. [12], les auteurs montrent que le traitement chronique par la cocaïne entraîne une diminution globale de la diméthylation de l’histone H3 sur K9 (H3K9me2) sans affecter la méthylation sur le résidu K27. L’article explore essentiellement les mécanismes responsables de ces effets ainsi que leurs conséquences sur l’expression des gènes et les réponses comportementales à la cocaïne. La diminution globale de H3K9me2 s’explique très bien par une réduction de deux histones méthyltransférases, G9a et G9a-like protein (GLP) qui peuvent sélectivement catalyser la méthylation de K9 de l’histone H3. La découverte assez stupéfiante est que la réduction des taux de G9a résulte d’une régulation négative du gène codant G9a par le facteur de transcription delta-FosB dont l’équipe d’Eric Nestler avait précédemment montré l’importance dans des processus associés à l’addiction. En effet, en intégrant des approches utilisant des souris transgéniques et des micro-injections de vecteurs viraux recombinants, il a été possible de montrer que la surexpression de delta-FosB dans les neurones du noyau accumbens y réduit l’expression de G9a et, par voie de conséquence, y diminue les taux de H3K9me. À l’inverse, G9a est capable d’interagir avec le gène fosB et de méthyler probablement les histones H3 dans son voisinage. La réduction des taux de G9a après un traitement chronique par la cocaïne pourrait permettre, en diminuant la méthylation des histones H3, une dérépression du gène fosB. Il se dessine donc une boucle de rétroaction positive dans laquelle l’accumulation de delta-FosB inhibe l’expression de G9a, un effet qui ne fait que faciliter l’expression de delta-FosB (Figure 1). 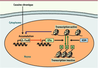 | Figure 1
La régulation réciproque du facteur de transcription delta-FosB et de la méthyltransférase G9a lors d’une exposition répétée à la cocaïne. Un traitement chronique à la cocaïne induit l’accumulation d’une isoforme stable de FosB, delta-FosB (Δ-FosB). L’augmentation de ce facteur de transcription régule négativement le gène codant la méthyltransférase G9a, un enzyme capable de méthyler la lysine 9 de l’histone 3. Cet effet réduit la méthylation d’histone H3 dans de nombreux gènes dont le gène codant pour delta-FosB et rend leur transcription plus active. On voit ainsi que l’accumulation de delta-FosB, en inhibant l’expression de G9a, facilite encore plus sa propre production. KDM : lysine déméthylase. |
|
Conséquences de la diminution des méthylations sur l’histone H3 Quelles sont les conséquences de la diminution de H3K9me2 dans le noyau accumbens ? On constate tout d’abord qu’après une administration chronique de cocaïne, le nombre de gènes activés par cette drogue augmente, puisque 277 gènes ont un niveau d’expression accru et seulement 94 une expression moindre. Ces altérations se prolongent jusqu’à une semaine après l’arrêt du traitement. Il est possible que, pour au moins une partie de ces gènes, la réduction de H3K9me2 explique leur surexpression. Pour l’équipe d’Eric Nestler, cette augmentation de l’activité transcriptionnelle de nombreux gènes est un facteur important de l’addiction aux drogues. Comme précédemment, l’association de modèles génétiques chez la souris et de micro-injections localisées de vecteurs viraux a permis aux auteurs de montrer que la réduction de l’activité de G9a dans le noyau accumbens facilite certaines réponses comportementales à la cocaïne; c’est le cas des propriétés de récompense de la cocaïne qui sont spécifiquement renforcées. Au contraire, la surexpression de G9a et l’augmentation de H3K9me2 qui en résulte sont associées à une moindre efficacité de la cocaïne. L’administration répétée et prolongée de cocaïne augmente la densité de petites expansions des dendrites, appelés épines dendritiques, dans les neurones du noyau accumbens [
15]. Comme ces épines sont le lieu de terminaisons des axones glutamatergiques, ce processus est associé à des changements fonctionnels des synapses glutamatergiques excitatrices sur les neurones et, pour certains, à une sensibilisation des réponses comportementales à la drogue [
16]. Des manipulations expérimentales dans le noyau accumbens de l’expression de G9a ou de delta-FosB montrent d’une part que la surexpression de delta-FosB est capable de mimer les effets de remodelage dendritique induit par la cocaïne, et d’autre part que la surexpression de G9a est capable de les bloquer. Par ailleurs G9a contrôle plusieurs gènes associés à la pousse des épines dendritiques. Ces études concourent à asseoir l’idée qu’à la suite d’une administration chronique de cocaïne, la répression de G9a et de H3K9me2, mais aussi l’accumulation de delta-FosB, favorisent l’appétence pour la cocaïne en partie via l’activation transcriptionnelle de nombreux gènes connus pour intervenir dans la pousse des épines dendritiques. |
Quelques remarques de conclusion Ces études montrent très clairement que l’exposition prolongée à la cocaïne modifie l’état de méthylation des histones dans une région du cerveau cruciale pour le développement de l’addiction. Il existe cependant encore une grande distance à parcourir pour comprendre le lien entre ces altérations moléculaires et leur traduction dans le comportement. On ignore encore largement comment cette mécanique moléculaire modifie le traitement de l’information dans le noyau accumbens et comment cela affecte les réactions comportementales vis-à-vis de la drogue. De plus, dans ce type d’études, il est toujours difficile de faire la part entre des processus d’adaptation des neurones à la drogue et ceux qui sont impliqués véritablement dans l’appétence aux drogues. Le temps pendant lequel ces altérations perdurent dans le cerveau n’est jamais non plus explicitement précisé. On sait que l’un des grands problèmes de l’addiction est la rémanence du désir de drogue, qui explique la fréquence des rechutes même après de longues périodes d’abstinence. On peut se demander si, comme le désir de drogue, les altérations épigénétiques rapportées dans l’étude de Maze et al. peuvent durer des mois voire des années. Malgré toutes ces incertitudes, ces études démontrent l’implication d’une méthyltransférase précise dans certains effets de la cocaïne. Cela fournit une cible thérapeutique intéressante qui serait susceptible d’au moins aider le toxicomane à gérer son addiction. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Chao J, Nestler EJ. Molecular neurobiology of drug addiction. Annu Rev Med 2004 ; 55 : 113-32. 2. Schultz W. Getting formal with dopamine and reward. Neuron 2002 ; 36 : 241-63. 3. Di Chiara G, Imperato A. Drugs abused by humans preferentially increase synaptic dopamine concentrations in the mesolimbic system of freely moving rats. Proc Natl Acad Sci USA 1988 ; 85 : 5274-8. 4. Nestler EJ. Transcriptional mechanisms of addiction: role of DeltaFosB. Philos Trans R Soc Lond B Biol Sci 2008 ; 363 : 3245-55. 5. Brami-Cherrier K, Roze E, Girault JA, et al. Role of the ERK/MSK1 signalling pathway in chromatin remodelling and brain responses to drugs of abuse. J Neurochem 2009 ; 108 : 1323-35. 6. Renthal W, Nestler EJ. Epigenetic mechanisms in drug addiction. Trends Mol Med 2008 ; 14 : 341-50. 7. Morange M. Quelle place pour l’épigénétique ? Med Sci (Paris) 2005 ; 21 : 367-9. 8. Bertin A, Mangenot S. Structure et dynamique de la particule cœur de nucléosome. Med Sci (Parb) 200 8; 24 : 715-9. 9. Brami-Cherrier K, Valjent E, Herve D, et al. Parsing molecular and behavioral effects of cocaine in mitogenand stress-activated protein kinase-1-deficient mice. J Neurosci 2005 ; 25 : 11444-54. 10. Kumar A, Choi KH, Renthal W, et al. Chromatin remodeling is a key mechanism underlying cocaineinduced plasticity in striatum. Neuron 2005 ; 48 : 303-14. 11. Stipanovich A, Valjent E, Matamales M, et al. A phosphatase cascade by which rewarding stimuli control nucleosomal response. Nature 2008 ; 453 : 879-84 12. Maze I, Covington HE 3rd, Dietz DM, et al. Essential role of the histone methyltransferase G9a in cocaineinduced plasticity. Science 2010 ; 327 : 213-6. 13. Renthal W, Kumar A, Xiao G, et al. Genome-wide analysis of chromatin regulation by cocaine reveals a role for sirtuins. Neuron 2009 ; 62 : 335-48. 14. Borrelli E, Nestler EJ, Allis CD, Sassone-Corsi P. Decoding the epigenetic language of neuronal plasticity. Neuron 2008 ; 60 : 961-74. 15. Robinson TE, Kolb B. Structural plasticity associated with exposure to drugs of abuse, Neuropharmacology 2004 ; 47 (suppl 1) : 33-46. 16. Russo SJ, Mazei-Robison MS, Ables JL, Nestler EJ. Neurotrophic factors and structural plasticity in addiction. Neuropharmacology 2009 ; 56 (suppl 1) : 73-82. |


