| |
| Med Sci (Paris). 2010 May; 26(5): 545–547. Published online 2010 May 15. doi: 10.1051/medsci/2010265545.
Listeria en lutte avec SUMO David Ribet* and Pascale Cossart* Institut Pasteur, Unité des interactions bactéries-cellules, 25, rue du Docteur Roux, F-75015 Paris, France Inserm, U604, F-75015 Paris, France INRA, USC2020, F-75015 Paris, France MeSH keywords: Adulte, Protéines bactériennes, physiologie, Toxines bactériennes, Perméabilité de la membrane cellulaire, Clostridium perfringens, Femelle, Protéines du choc thermique, Hémolysines, Interactions hôte-pathogène, Humains, Nouveau-né, Listeria monocytogenes, pathogénicité, Infections à Listeria, épidémiologie, microbiologie, physiopathologie, Mâle, Modèles biologiques, Grossesse, Complications de la grossesse et maladies infectieuses, Maturation post-traductionnelle des protéines, Protéine SUMO-1, Streptococcus pneumoniae, Streptolysines, Ubiquitin-activating enzymes, antagonistes et inhibiteurs , Virulence |
Les deux protagonistes : Listeria monocytogenes
Listeria monocytogenes est une bactérie présente naturellement dans l’environnement et dans certains aliments consommés par l’homme. Cette bactérie, de type Gram positif, est l’agent responsable de la listériose. L’ingestion d’aliments contaminés par Listeria monocytogenes entraîne des septicémies, des gastroentérites sévères et des infections du système nerveux central, plus particulièrement chez les personnes âgées et les sujets immunodéprimés. Chez les femmes enceintes, l’infection par Listeria peut aboutir à des avortements, des accouchements prématurés et des infections périnatales. En France, cette maladie se caractérise par une létalité élevée (20 à 30 % des cas) mais son incidence reste faible avec moins de cinq cas par million d’habitants recensés en 2007.
Listeria monocytogenes constitue un excellent modèle d’étude des relations hôtes-pathogènes [
6]. Cette bactérie a la capacité de franchir trois barrières de l’hôte : la barrière intestinale, la barrière placentaire et la barrière hémato-encéphalique. Elle peut, de plus, entrer et se répliquer dans différents types de cellules, en particulier dans des cellules non phagocytaires. Au cours de l’infection, L. monocytogenes manipule de nombreuses fonctions cellulaires afin de se répliquer, de se propager et d’échapper à la réponse immunitaire de l’hôte. L. monocytogenes est notamment capable de modifier l’activité de différentes protéines de l’hôte en régulant leurs modifications post-traductionnelles (par exemple leur phosphorylation ou leur ubiquitinylation [
3,
8,
12]). La régulation des modifications post-traductionnelles de protéines de l’hôte est un mécanisme couramment utilisé par les pathogènes. Il leur permet de modifier rapidement et localement l’activité de certains facteurs importants pour l’infection. Cependant, l’effet de ces pathogènes sur certaines modifications post-traductionnelles fondamentales comme la SUMOylation reste très mal connu. Au mois d’avril, Nature a publié un article dans lequel nous démontrons que L. monocytogenes est capable d’interférer avec la SUMOylation de la cellule hôte et que cette interférence joue un rôle important dans l’infection bactérienne [
9]. |
La SUMOylation est une modification post-traductionnelle réversible qui consiste en la fixation covalente d’un polypeptide d’environ 10 kDa, nommé SUMO (pour small ubiquitin modifier), sur une protéine cible [
7]. SUMO possède une structure similaire à celle de l’ubiquitine et, de fait, appartient à la famille des Ubiquitin-like proteins. La fixation de SUMO se fait sur un résidu lysine d’une protéine cible, via l’établissement d’une liaison isopeptidique. La formation de cette liaison nécessite l’intervention de trois classes d’enzymes analogues aux enzymes de l’ubiquitinylation. Chez l’homme, la machinerie de SUMOylation est composée d’une enzyme E1 d’activation (composée de l’hétérodimère SAE1/SAE2), d’une enzyme E2 de conjugaison (nommée Ubc9) et de différentes enzymes E3 ligases contrôlant l’efficacité et la spécificité de la fixation de SUMO sur une cible donnée. La SUMOylation d’une protéine cible est de plus finement régulée par des protéases spécifiques, nommées SUMOprotéases ou déSUMOylases, qui clivent la liaison isopeptidique entre SUMO et sa cible. La SUMOylation intervient dans de nombreuses fonctions cellulaires et plusieurs centaines de cibles de SUMO ont maintenant été caractérisées. Cette modification post-traductionnelle joue notamment un rôle important dans la régulation de la transcription, la réparation de l’ADN, le transport intracellulaire, la réponse au stress et la stabilité des protéines [7]. |
Listeria induit une diminution du niveau de SUMOylation des protéines de l’hôte Au cours de notre étude sur L. monocytogenes, nous avons montré que l’infection in vitro de cellules en culture entraînait une diminution de la SUMOylation de nombreuses protéines de l’hôte. De façon remarquable, cette diminution est spécifique de l’espèce pathogène L. monocytogenes et n’est pas observée avec L. innocua, une espèce non pathogène de Listeria. Cet effet contraste avec l’augmentation globale du niveau de SUMOylation observée dans des cellules soumises à différents stress environnementaux [
10]. Notre étude montre que la diminution du niveau de SUMOylation des protéines de l’hôte est induite par une toxine sécrétée par Listeria, nommée Listériolysine O (LLO). Cette toxine est un facteur de virulence très important de Listeria capable de s’insérer dans les membranes cellulaires et de former des pores d’environ 35 nm de diamètre. La LLO joue un rôle important dans la lyse de la vacuole d’internalisation de Listeria et permet la libération de la bactérie dans le cytoplasme des cellules infectées. Cette toxine est, de plus, capable d’interférer avec de nombreuses voies de signalisation de la cellule infectée [
11]. Nous avons montré que les pores formés par la LLO induisaient la dégradation d’Ubc9, l’unique enzyme E2 de la machinerie de SUMOylation chez les mammifères. Cette dégradation a été observée in vitro dans des cellules humaines en culture infectées par L. monocytogenes ou traitées avec de la toxine LLO purifiée, et in vivo dans le foie de souris infectées par Listeria. La dégradation d’Ubc9 entraîne un blocage de la SUMOylation et aboutit à une déSUMOylation massive des protéines de la cellule hôte. D’autre part, en parallèle de son effet sur Ubc9, la LLO induit également la dégradation de certaines protéines SUMOylées dans les cellules infectées. Nous avons testé l’effet d’autres toxines bactériennes sur la machinerie de SUMOylation des cellules hôtes. Nous nous sommes intéressés en particulier à deux toxines appartenant à la même famille que la LLO et formant également des pores dans les membranes des cellules hôtes : la Perfringolysine O (PFO), produite par Clostridium perfringens, et la Pneumolysine (PLY), produite par Streptococcus pneumoniae. Tout comme la LLO, ces deux toxines induisent une dégradation d’Ubc9. Ces résultats indiquent que d’autres pathogènes bactériens, et dans ce cas précis des pathogènes extracellulaires, peuvent également cibler la machinerie de SUMOylation de l’hôte. Nous avons enfin pu montrer qu’une augmentation de la SUMOylation était délétère pour l’infection bactérienne. En effet, l’infection par L. monocytogenes de cellules en culture surexprimant SUMO, et donc possédant des quantités plus importantes de protéines SUMOylées, était moins efficace que l’infection de cellules témoins. La diminution du niveau de protéines SUMOylées dans la cellule hôte induite par Listeria serait donc importante pour augmenter l’efficacité de l’infection bactérienne. |
Perturbation de la machinerie de SUMOylation de l’hôte : une stratégie générale utilisée par les pathogènes ? Notre étude nous a permis d’identifier une nouvelle stratégie utilisée par Listeria qui, en interférant avec la SUMOylation de la cellule hôte, régule l’activité de facteurs cellulaires importants pour l’infection (Figure 1). La caractérisation du mécanisme de dégradation d’Ubc9 ainsi que l’identification des protéines déSUMOylées ou dégradées au cours de l’infection permettront de mieux comprendre le rôle joué par la SUMOylation au cours de l’infection bactérienne. De façon intéressante, plusieurs études ont montré que certains virus utilisent une stratégie similaire et perturbent la machinerie de SUMOylation de l’hôte [
1,
2,
4,
5]. L’étude du contrôle de la SUMOylation par des pathogènes représente un domaine de recherche fascinant, qui n’en est encore qu’à ses débuts, et qui apportera probablement de précieuses informations sur une facette encore méconnue des relations hôtes-pathogènes.
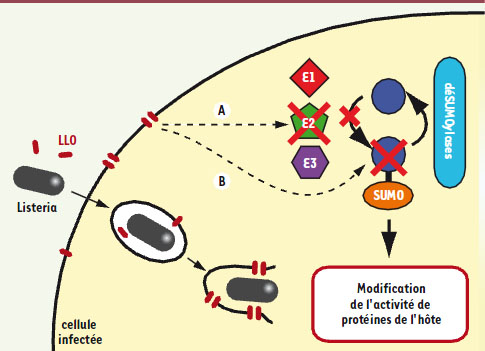
 | Figure 1.
Modèle d’action de la LLO sur la machinerie de SUMOylation de cellules infectées par Listeria monocytogenes. La listériolysine O (LLO) est une toxine sécrétée par Listeria monocytogenes qui forme des pores dans les membranes cellulaires. Parallèlement à son rôle dans la lyse de la vacuole d’internalisation de la bactérie, la LLO induit la dégradation de l’enzyme E2 de la machinerie de SUMOylation de la cellule infectée (A). Ceci aboutit à un blocage de la SUMOylation et à la déSUMOylation de nombreuses protéines de l’hôte. Par ailleurs, La LLO induit également une dégradation de certaines protéines SUMOylées (B). La diminution du niveau de protéines SUMOylées est associée à une modification de l’activité de protéines de l’hôte en cours d’identification et joue un rôle important dans l’efficacité de l’infection par Listeria. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Boggio R, Chiocca S. Viruses and sumoylation: recent highlights. Curr Opin Microbiol 2006; 9 : 430–6. 2. Boggio R, Colombo R, Hay RT, et al. A mechanism for inhibiting the SUMO pathway. Mol Cell 2004; 16 : 549–61. 3. Bonazzi M, Veiga E, Cerda JP, Cossart P. Successive post-translational modifications of E-cadherin are required for InlA-mediated internalisation of Listeria monocytogenes. Cell Microbiol 2008; 10 : 2208–22. 4. Chang PC, Izumiya Y, Wu CY, et al. 2010. Kaposi’s sarcoma-associated herpesvirus (KSHV) encodes a SUMO E3 ligase that is SIM-dependent and SUMO-2/3-specific. J Biol Chem 2010; 285 : 5266–73. 5. Chang TH, Kubota T, Matsuoka M, et al. Ebola Zaire virus blocks type I interferon production by exploiting the host SUMO modification machinery. PLoS Pathog 2009; 5 : e1000493. 6. Cossart P, Toledo-Arana A. Listeria monocytogenes, a unique model in infection biology: an overview. Microbes Infect 2008; 10 : 1041–50. 7. Geiss-Friedlander R, Melchior F. Concepts in sumoylation: a decade on. Nat Rev Mol Cell Biol 2007; 8 : 947–56. 8. Hamon MA, Batsche E, Regnault B, et al. Histone modifications induced by a family of bacterial toxins. Proc Natl Acad Sci USA 2007; 104 : 13467–72. 9. Ribet D, Hamon M, Gouin E, et al. Listeria monocytogenes impairs SUMOylation for efficient infection. Nature 2010; 464 : 1192–5. 10. Saitoh H, Hinchey J. Functional heterogeneity of small ubiquitin-related protein modifiers SUMO-1 versus SUMO-2/3. J Biol Chem 2000; 275 : 6252–8. 11. Schnupf P, Portnoy DA. Listeriolysin O: a phagosome-specific lysin. Microbes Infect 2007; 9 : 1176–87. 12. Veiga E, Cossart P. Listeria hijacks the clathrin-dependent endocytic machinery to invade mammalian cells. Nat Cell Biol 2005; 7 : 894–900. |