| |
| Med Sci (Paris). 2010 May; 26(5): 505–515. Published online 2010 May 15. doi: 10.1051/medsci/2010265509.Génétique de la dégénérescence maculaire liée à l’âge Nicolas Leveziel,2,3* Nathalie Puche,1 Jennyfer Zerbib,1 Pascale Benlian,3 Gabriel Coscas,1 Gisele Soubrane,1 and Eric Souied1 1Hôpital intercommunal de Créteil, 40, avenue de Verdun, 94000 Créteil, France 2Service d’ophtalmologie (Pr Souied), Hôpital intercommunal de Créteil, 40, avenue de Verdun, 94000 Créteil, France 3UPMC Université Paris 6, service de biochimie et de biologie moléculaire, faculté de médecine Pierre et Marie Curie, site Saint-Antoine, Paris, France |
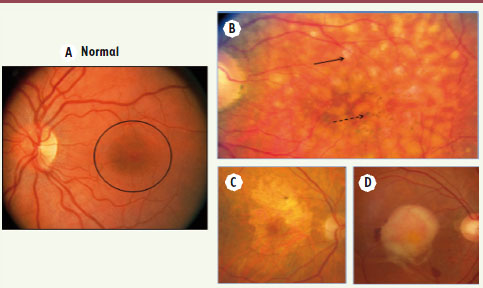
La dégénérescence maculaire liée à l’âge (DMLA) est la première cause de malvoyance après 50 ans dans les pays développés, devant le glaucome et la rétinopathie diabétique. À titre d’exemple, environ 1 million de personnes souffrent de cette maladie invalidante en France, dont 50 % des personnes de plus de 80 ans (selon un rapport de l’Agence nationale d’accréditation et d’évaluation en santé, ANAES, de 2001). Cette maladie touche la macula, la partie centrale de la rétine permettant la vision des détails (lecture) (Figure 1A). La DMLA a tout d’abord été considérée comme une maladie liée au vieillissement rétinien. Des facteurs de risques environnementaux (notamment le tabac) ont ensuite été incriminés dans la survenue de cette pathologie, suivis plus récemment des facteurs de risque génétiques. On distingue deux formes cliniques principales de DMLA : la forme exsudative, la plus sévère, et la forme atrophique, plus lentement évolutive (Figure 1C et D). La maculopathie liée à l’âge, caractérisée par la présence de drusen1 et d’altérations de l’épithélium pigmenté de la rétine, représente le premier stade de cette affection (voir Figure 1B). L’angiographie à la fluorescéine a permis de distinguer différentes formes cliniques de la forme exsudative de la maladie, de pronostic différent (Figure 2). La DMLA est une maladie multifactorielle dont la composante génétique polygénique est au premier plan des facteurs de susceptibilité, à laquelle s’ajoutent les facteurs environnementaux initialement décrits. L’identification progressive des gènes impliqués a été possible grâce à des études d’agrégation familiale, des analyses de ségrégation, des études de liaison génétique et des études cas-témoins. L’identification précise de ces facteurs de susceptibilité génétique ouvre la voie à de nouvelles hypothèses physiopathologiques, voire à de nouvelles perspectives thérapeutiques.
 | Figure 1. Différents aspects de la DMLA au fond d’œil. A. Fond d’œil normal : la macula est entourée d’un cercle noir. B. Maculopathie liée à l’âge. Il s’agit d’une forme débutante de la maladie associant la présence de drusen (flèche pleine) à la présence d’altérations de l’épithélium pigmenté (flèche en pointillé). C. Forme atrophique de la maladie. D. Forme exsudative évoluée de la maladie. |
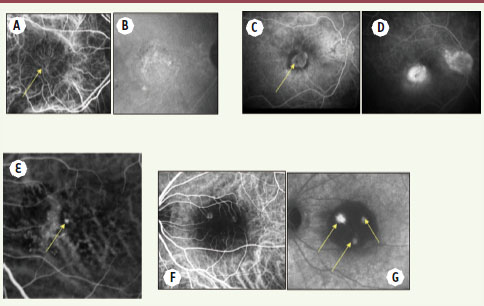
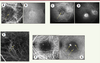 | Figure 2. Différents aspects cliniques de la DMLA exsudative à l’examen angiographique. A, B. Angiographie au vert d’indocyanine aux temps précoce et tardif mettant en évidence des néovaisseaux sous-épithéliaux ou occultes évolués (flèche jaune). C, D. Angiographie à la fluorescéine aux temps précoce et tardif mettant en évidence des néovaisseaux pré-épithéliaux ou visibles (flèche jaune). E. Angiographie au vert d’indocyanine au temps précoce montrant une vasculopathie polypoïdale (flèches jaunes).F, G. Angiographie au vert d’indocyanine aux temps précoce et tardif montrant trois anastomoses chorio-rétiniennes. |
|
Les différentes stratégies d’identification des facteurs génétiques Les études d’agrégation familiale comparent la fréquence des cas de DMLA parmi les apparentés de patients ayant une DMLA à la fréquence observée dans la population générale. Ces études ont suggéré que le risque relatif d’avoir une DMLA en cas d’antécédent familial varie entre 2 et 4 [1–5]. Les études de jumeaux comparent le phénotype observé chez les jumeaux monozygotes au phénotype observé chez les jumeaux dizygotes, ce qui permet de quantifier les impacts respectifs de l’hérédité et de l’environnement sur la maladie. Selon Seddon et al., les facteurs génétiques pourraient expliquer 46 à 71 % du phénotype et l’héritabilité serait d’autant plus élevée que la présentation clinique est sévère, avec un taux de 0,46 pour toutes les formes confondues, 0,67 pour les formes intermédiaires et 0,71 pour les formes évoluées atrophiques ou exsudatives [6]. Les études de liaison génétique qui recherchent la ségrégation conjointe d’un trait phénotypique avec des marqueurs polymorphes balisant régulièrement le génome sont particulièrement difficiles dans le contexte d’une maladie multifactorielle d’expression très tardive. Sept études ont néanmoins été menées avec succès dans la DMLA. Deux locus majeurs ont été associés à la maladie, l’un sur le chromosome 1q et l’autre sur le chromosome 10q. On sait maintenant que ces 2 locus contiennent des gènes majeurs de susceptibilité à la maladie. De très nombreuses études d’association cas-témoins ont été réalisées ces dernières années. Elles analysent la distribution des fréquences alléliques dans les groupes de patients non apparentés atteints de DMLA et la comparent à celle qui prévaut dans des groupes appariés d’individus indemnes et non apparentés. Ces études ont été soit réalisées au hasard dans l’immensité du génome à l’aide de puces SNP, soit ciblées sur des gènes candidats. Ces derniers ont été sélectionnés par leur localisation dans les régions pointées par les études de liaison génétique ou par les études d’association pangénomiques elles-mêmes, et/ou par leur fonction (gènes impliqués dans d’autres maculopathies, gènes sous ou surexprimés dans la rétine vieillissante, etc.). |
Les gènes de susceptibilité à la DMLA récemment identifiés Étude des gènes candidats par la fonction : l’ApoE La présence de l’apolipoprotéine E (ApoE) dans les drusen a été identifiée dans des études immuno-histochimiques réalisées sur les yeux de patients atteints de DMLA. L’ApoE joue un rôle important dans l’efflux du cholestérol de la rétine. C’est aussi une protéine chaperonne importante dans le cytoplasme des cellules. C’était donc un possible gène candidat et deux études respectivement menées par Souied et al. et Klaver et al. en 1998 ont conclu à son association à la DMLA [ 7, 8]. Dans ces deux études, l’isoforme e4 apparaît comme protectrice, avec des odds ratio respectifs de 0,34 et 0,43. Une méta-analyse a confirmé le rôle protecteur de l’Apoe4 dans la DMLA [ 9]. En regroupant dix études cas-témoins (3 288 cas avec DMLA et 6 908 contrôles sans DMLA), cette méta-analyse retrouve un odds ratio de 0,67 [IC95 %, 0,57-0,78] pour le génotype e3/e4. L’incapacité de l’isoforme e4 à former des dimères et la présence de deux charges positives permettraient à cette isoforme d’assurer une meilleure clairance du cholestérol au travers des membranes, ce qui pourrait expliquer partiellement son rôle protecteur dans la DMLA. La limitation principale de l’ensemble des études cas-témoins analysant l’impact de ce gène sur la DMLA est la fréquence faible des isoformes e2 et e4, ce qui nécessite des effectifs importants dans chaque groupe. Étude des gènes responsables de maculopathies héréditaires : l’exemple du gène ABCA4 L’analyse des gènes impliqués dans des dystrophies rétiniennes est restée négative, en dehors du gène ABCA4 ( ATP-binding cassette, sub-family A, member 4) dont l’association à la DMLA a suscité une vive controverse. Allikmets et al., dans une première étude cas-témoins comparant deux séries de 96 et 71 patients souffrant de DMLA à un groupe de 220 témoins, ont montré que la mutation D2177N du gène ABCA4 était préférentiellement observée chez des patients souffrant de DMLA (p = 0,023) [ 10]. La controverse était initialement alimentée par Edwin M. Stone qui reprochait à Allikmets la méthodologie statistique utilisée pour affirmer l’implication de ce gène dans la DMLA, l’imprécision des données concernant les témoins inclus dans l’étude et l’absence de stratification en fonction de l’origine ethnique [ 11]. Un consortium international s’est alors constitué associant 15 équipes issues de 8 pays [ 12]. Il a analysé un grand nombre de patients souffrant de différentes formes de DMLA (1 218 patients ayant une DMLA dont 533 une forme atrophique et 685 une forme exsudative) et 1 258 témoins indemnes de la maladie. La mutation G1961E était retrouvée chez 19 des 1 218 patients (1,56 %), et 4 témoins (sur 1 258 témoins, 0,32 %) (p = 0,0013). Le risque relatif de développer une DMLA pour les porteurs de cette mutation était de 5,2 (IC95 %, 1,7-22). De même, la mutation D2177N était retrouvée chez 21 sur 1 189 patients analysés (1,77 %) et 8 des 1 258 témoins (0,64 %) (p = 0,014). Le risque relatif de souffrir de DMLA pour les porteurs de cette mutation était de 2,6 (IC95 %, 1,1-7,0). Ce consortium international a donc permis de confirmer l’hypothèse selon laquelle certains variants du gène ABCA4 sont des facteurs de susceptibilité prédisposant à la DMLA. Étude des gènes candidats par la position Gène du facteur H du complément (CFH) Le facteur H du complément est un protagoniste majeur régulant la cascade du complément. Cette glycoprotéine sérique, formée de 20 séquences répétées de 60 acides aminés chacune, contrôle l’activation de la voie alterne du complément en phase liquide et à la surface des cellules. Cette voie de la cascade du complément se caractérise par un niveau basal d’activation. Le gène du facteur H est localisé en 1q32, dans une région retenue par plusieurs études de liaison génétique. Le polymorphisme génétique impliqué dans la DMLA se traduit par le remplacement d’une tyrosine par une histidine en position 402 (Y402H) de la protéine. Cette modification de structure de la protéine entraîne une moins forte affinité de celle-ci pour la CRP ( C reactive protein) fixée sur les membranes cytoplasmiques, avec pour conséquence une diminution de l’activité d’inhibition de la voie alterne du complément. Cette région fixe l’héparine et la CRP, il est donc probable que le changement d’acide aminé puisse modifier partiellement la régulation des processus inflammatoires dans la rétine. Un dysfonctionnement de la voie alterne du complément peut conduire à une libération des fragments C3a et C5a et à la formation du complexe C5b9 induisant l’activation des cellules endothéliales et la libération de facteurs de croissance tels le VEGF ( vascular endothelial growth factor) ou le bFGF ( basic fibroblast growth factor) La présence de ces fractions du complément dans les membranes néovasculaires choroïdiennes et dans les drusen plaide en faveur de ce mécanisme [ 13]. De plus, l’accumulation de lipides dans la membrane de Bruch crée un stimulus inflammatoire chronique et offre un substrat pour la formation des drusen [ 14]. La concentration de ce matériel pro-inflammatoire pourrait induire un effet chémotactique leucocytaire, via l’activation de la cascade du complément. Les premières études pangénomiques ou cas-témoins montrent une association entre le variant Y402H du gène du CFH et la DMLA [ 15]. D’autres études cas-témoins publiées depuis ont confirmé que ce variant du CFH est un facteur de susceptibilité dans diverses formes cliniques de DMLA et dans diverses populations [ 16]. En revanche, une telle association n’est pas retrouvée chez les patients japonais, probablement parce que la fréquence allélique du variant incriminé y est beaucoup plus rare [ 17]. La découverte de ce facteur de susceptibilité pourrait suggérer de nouvelles pistes thérapeutiques modulant les phénomènes inflammatoires pouvant constituer le substrat physiopathologique de la maladie. Une méta-analyse de l’implication du polymorphisme Y402H du gène du CFH a montré que les sujets hétérozygotes et les sujets homozygotes ont des odds ratio respectifs de 2,5 et de 6,32 de développer une DMLA [ 18]. À l’instar du CFH, d’autres facteurs impliqués dans la cascade du complément pourraient aussi être incriminés. Des études montrent en effet que des variants génétiques du facteur B ainsi que des composants C2 et C3 du complément sont associés à la DMLA. Les résultats de ces études sont présentés dans le Tableau I.
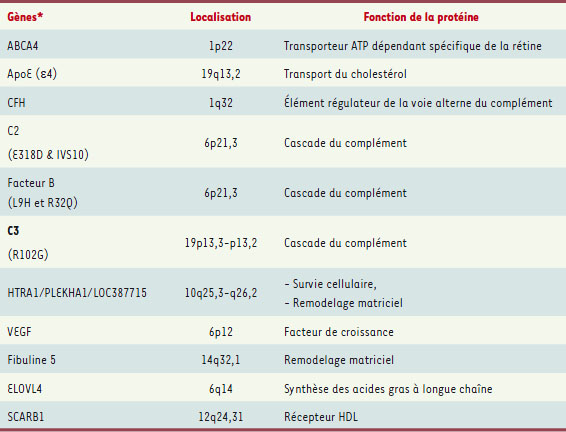
 | Tableau I. Principaux gènes candidats dans la DMLA. ABCA4 : ATP-binding cassette, sub-family A, member 4 ; CFH : complement factor H ; HTRA1 : HtrA serine peptidase 1 ; PLEKHA1 : Pleckstrin homology domain-containing family A member 1 ; VEGF : vascular endothelial growth factor ; ELOVL4 : Elongation of very long chain fatty acids protein 4 ; SCARB1 : Scavenger receptor class B, member 1. * L’association avec la DMLA des gènes cités dans ce tableau a été mise en évidence dans au moins une étude. |
Gènes LOC387715/HTRA1/PLEKHA1 Les gènes LOC387715, HTRA1 et PLEKHA1 sont localisés dans une région de 0,1 Mb en 10q26, identifiée dans plusieurs études d’association [ 19– 21]. Notre méconnaissance de la fonction des trois gènes de ce locus et l’existence de déséquilibres de liaisons expliquent qu’il soit difficile d’incriminer un gène plutôt qu’un autre.
- Le gène PLEKHA1 (Pleckstrin homology domain-containing family A member 1) code une protéine de 404 acides aminés dont la fonction est mal connue, qui contient deux domaines d’homologie (PH) à la pleckstrine. Il est probable que l’association entre ce gène et la DMLA ne soit pas directement causale mais plutôt liée à un déséquilibre de liaison avec d’autres gènes localisés dans cette région.
- Le gène HTRA1 (HtrA serine protease 1) code une protéine de 480 acides aminés. Si sa fonction dans la rétine est actuellement mal connue, le gène HTRA1 pourrait être un gène suppresseur de tumeur, induisant une mort cellulaire médiée par son activité de sérine protéase [22]. Il pourrait avoir également une action sur le remodelage de la matrice extracellulaire impliqué dans le mécanisme de néovascularisation. De nombreuses études ont souligné le rôle majeur de HTRA1 comme facteur de susceptibilité de la DMLA exsudative ou atrophique [23]. Une méta-analyse portant sur le polymorphisme rs11200638 de ce gène a montré que les sujets hétérozygotes et les sujets homozygotes ont des odds ratio respectivement de 2,13 et de 6,92 de développer une DMLA [24].
- LOC387715 ou ARMS2 (age-related maculopathy susceptibility protein 2) est localisé en 10q26.13. La protéine colocalise avec des protéines mitochondriales et est probablement associée à la membrane externe de la mitochondrie, organite très impliqué dans les processus apoptotiques et oxydatifs. Dans une étude cas-témoin portant sur 466 cas de DMLA et 280 témoins sans DMLA, les auteurs ont analysé 45 polymorphismes des gènes PLEKHA1, HTRA1 et LOC387715 [25]. Ils concluent qu’un polymorphisme du gène HTRA1 est un facteur de susceptibilité génétique indirect, en déséquilibre de liaison avec un polymorphisme du gène LOC387715, contrairement à ce qui avait été avancé dans les deux articles princeps [26, 27]. En outre, une délétion-insertion dans la région 3’UTR du gène LOC387715 (372_815del443ins54) a été identifiée et elle est associée aux DMLA et responsable d’une instabilité sévère du transcrit par la suppression du signal de polyadénylation et l’insertion d’une séquence de 54 paires de bases. C’est un argument supplémentaire en faveur de l’implication de ce gène [28]. Les variants de HTRA1 et LOC387715, par leurs rôles respectifs dans la survie cellulaire et le remodelage matriciel pour le premier et dans la membrane externe mitochondriale pour le second, pourraient constituer des facteurs indépendants de susceptibilité génétique à la DMLA. Une méta-analyse portant sur le polymorphisme A69S du gène LOC387715 a montré que les sujets hétérozygotes et les sujets homozygotes ont des odds ratio respectifs de 2,5 et de 7,3 de développer une DMLA [29].
Les découvertes de la contribution des gènes codant l’ApoE4 et le CFH suggèrent l’implication de deux voies physiopathologiques différentes dans la DMLA, l’une mettant en jeu l’homéostasie lipidique, l’autre la voie inflammatoire. D’autres gènes candidats intervenant dans ces deux voies ont été étudiés par la suite, ce qui a permis d’identifier d’autres facteurs de susceptibilité à la maladie : SCARB1 (Scavenger receptor class B, member 1) pour l’homéostasie lipidique, les facteurs C2, C3 et B du complément pour la voie inflammatoire (Tableau I). Facteurs génétiques et facteurs environnementaux L’importance considérable des odds ratio associés aux variants localisés en 1q31 et 10q26, comparativement aux facteurs environnementaux dont les odds ratio dépassent rarement 2 (par exemple pour le tabac dans l’étude AREDS 2,), démontre l’importance majeure des facteurs génétiques dans l’étiologie de la maladie et explique le nombre considérable d’études de liaison entreprises pour les identifier. À titre d’exemple, Rivera et al. estiment que les individus homozygotes porteurs des variants à risque de LOC387715 et Y402H du gène codant le CFH ont un odds ratio de 57,6 de développer une DMLA [ 21]. Il est étonnant dans ces conditions de constater que les variants majeurs de la maladie ont été découverts si tardivement. Le caractère multifactoriel ainsi que l’expression tardive de la maladie l’expliquent sans doute. Des études ont analysé l’interaction de ces marqueurs avec des facteurs de risque environnementaux comme le tabac et l’obésité. Dans une étude, Seddon et al. calculent le risque de progression de la DMLA atrophique ou exsudative en fonction du génotype et de facteurs environnementaux [ 30]. La présence de facteurs de risque environnementaux (tabac, indice de masse corporelle > 25) associés à ces deux variants majeurs augmente le risque de progression. Dans une étude réalisée chez des patients participant à l’étude AREDS, les auteurs ont analysé les rôles respectifs des facteurs de susceptibilité génétique et des facteurs environnementaux dans la progression de la DMLA. Dans cette étude, les allèles à risque des gènes CFH, LOC387715, C2 et C3 sont associés à un risque de progression vers un stade plus évolué de la maladie, avec des odds ratio variant respectivement de 3,5 − 25,4 − 0,3 et 3,6 [ 31]. D’autres études analysent l’association de ces facteurs génétiques aux différentes formes cliniques de la maladie et montrent que l’association est d’autant plus forte que la forme clinique est évoluée, avec un effet indépendant et multiplicateur de ces deux variants. |
Corrélations génotype-phénotype L’angiographie à la fluorescéine a permis de souligner la grande hétérogénéité de la maladie, avec une prédominance de néovaisseaux de type occulte ou occulte prédominant 3 dans les populations d’origine caucasienne [ 32, 33]. Dans la population d’origine japonaise, il est intéressant de noter que la vasculopathie polypoïdale 4 représente une majorité des formes cliniques exsudatives de DMLA (environ 55 %), alors que la prévalence de cette forme est rare dans la population européenne. Dans une cohorte de patients ayant une DMLA exsudative, nous avons analysé le type de néovascularisation initiale par angiographie à la fluorescéine après avoir effectué une analyse génotypique. Malgré le nombre limité de cas dans chaque sous-groupe défini par le génotype, l’analyse statistique met en évidence une corrélation génotype-phénotype significative. Il existe une association significative entre le variant à risque du CFH et les néovaisseaux de type occulte prédominant ou occulte (p < 0,007) et une tendance à l’association entre le variant à risque rs11200638 de HTRA1 et les néovaisseaux de type classique ou à prédominance classique (p = 0,18) [ 34]. D’autres études ont également tenté d’établir une corrélation entre génotype et phénotype dans la DMLA exsudative [ 35, 36]. Ces deux dernières études ne portent que sur l’analyse d’un seul variant, ce qui peut masquer des effets de codominance faussant en grande partie l’interprétation des résultats. Une étude plus récente semble confirmer ces résultats et l’association du gène ARMS2 (ou LOC387715) aux formes sévères de la maladie [ 37]. En outre, une étude japonaise menée sur une forme frontière de DMLA exsudative, la vasculopathie polypoïdale choroïdienne idiopathique, retrouve une association entre la taille des lésions néovasculaires et le polymorphisme à risque de ARMS2 [ 38]. Facteurs génétiques et réponse thérapeutique Une étude a analysé la progression à 5 ans de la maladie chez 876 patients inclus dans l’étude AREDS aux stades 3 ou 4, selon que les patients absorbaient ou non des suppléments nutritionnels de type antioxydant et/ou zinc, en fonction de leurs génotypes pour les variants à risque du CFH et du LOC387715 [ 39]. Il apparaît que les patients homozygotes pour l’allèle à risque du gène du CFH répondent moins bien à la supplémentation en antioxydants et zinc, et qu’un pourcentage plus important progresse vers les stades plus évolués de la maladie. Malgré les résultats encourageants des principales études prospectives multicentriques MARINA et ANCHOR 5 [ 40, 41], il est actuellement difficile de prédire la réponse au traitement chez un patient donné, en ne se basant que sur l’aspect angiographique des lésions, même si d’une façon générale on sait que certaines formes cliniques sont particulièrement réfractaires (les anastomoses choriorétiniennes par exemple). Il est possible que la réponse au traitement anti-angiogénique soit également influencée par le statut génétique. C’est ce que suggère une étude de Brantley et al. qui ont analysé la réponse au traitement par anticorps anti-angiogéniques (bévacizumab, ou anti-VEGF [ 43]) chez 86 patients souffrant de DMLA exsudative, en fonction du génotype pour les variants majeurs du CFH et de LOC387715 [ 42]. Malgré le faible effectif, l’étude met en évidence un moins bon pronostic visuel après traitement pour les patients homozygotes pour l’allèle à risque CFH (p = 0,004). Dans une autre étude portant sur 69 patients atteints d’une DMLA exsudative et traités par photothérapie dynamique, Brantley et al. montrent qu’au contraire, le pronostic visuel semble moins bon pour les homozygotes porteurs de l’allèle sauvage [ 44]. Un déséquilibre de liaison entre un polymorphisme du VEGF et le polymorphisme Y402H du gène du CFH pourrait en partie expliquer la corrélation entre la réponse au traitement anti-angiogénique et le génotype pour le CFH [ 45]. Une association entre deux autres polymorphismes du VEGF et la DMLA exsudative a par ailleurs déjà été rapportée [ 46, 47]. |
Le rôle des facteurs de susceptibilité génétique de la DMLA ne se cantonne pas à une simple modification du risque de développer la maladie. Il est probable que ceux-ci influencent également l’évolution vers certaines formes cliniques de la maladie, ainsi que la réponse aux différentes thérapeutiques préventives et curatives actuellement disponibles. Les découvertes en génétique pourraient conduire à proposer de nouvelles armes thérapeutiques ciblant divers mécanismes physiopathologiques : les matrices cellulaires, l’inflammation, le transport lipidique ou la résistance au stress oxydatif de la maladie. Ces découvertes pourront peut-être également modifier notre approche préventive de la maladie. Enfin se pose un problème d’ordre éthique difficile à résoudre, qu’il est probablement encore prématuré d’envisager : quels patients devraient bénéficier d’un dépistage des facteurs de susceptibilité génétique de la DMLA ? |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Seddon JM, Ajani UA, Mitchell BD. Familial aggregation of age-related maculopathy. Am J Ophthalmol 1997; 123 : 199–206. 2. Klaver CC, Wolfs RC, Assink JJ, et al. Genetic risk of age-related maculopathy. Population-based familial aggregation study. Arch Ophthalmol 1998; 116 : 1646–51. 3. Klein BE, Klein R, Lee KE, et al. Risk of incident age-related eye diseases in people with an affected sibling: The Beaver Dam Eye study. Am J Epidemiol 2001; 154 : 207–11. 4. Assink JJ, Klaver CC, Houwing-Duistermaat JJ, et al. Heterogeneity of the genetic risk in age-related macular disease: a population-based familial risk study. Ophthalmology 2005; 112 : 482–7. 5. Luo L, Harmon J, Yang X, et al. Familial aggregation of age-related macular degeneration in the Utah population. Vision Res 2008; 48 : 494–500. 6. Seddon JM, Cote J, Page WF, et al. The US twin study of age-related macular degeneration: relative roles of genetic and environmental influences. Arch Ophthalmol 2005; 123 : 321–7. 7. Souied EH, Benlian P, Amouyel P, et al. The epsilon4 allele of the apolipoprotein E gene as a potential protective factor for exudative age-related macular degeneration. Am J Ophthalmol 1998; 125 : 353–9. 8. Klaver CC, Kliffen M, van Duijn CM, et al. Genetic association of apolipoprotein E with age-related macular degeneration. Am J Hum Genet 1998; 63 : 200–6. 9. Thakkinstian A, Bowe S, McEvoy M, et al. Association between apolipoprotein E polymorphisms and age-related macular degeneration: A HuGE review and meta-analysis. Am J Epidemiol 2006; 164 : 813–22. 10. Allikmets R, Shroyer NF, Singh N, et al. Mutation of the Stargardt disease gene (ABCR) in age-related macular degeneration. Science 1997; 277 : 1805–7. 11. Stone EM, Webster AR, Vandenburgh K, et al. Allelic variation in ABCR associated with Stargardt disease but not age-related macular degeneration. Nat Genet 1998; 20 : 328–9. 12. Allikmets R. Further evidence for an association of ABCR alleles with age-related macular degeneration. The International ABCR Screening Consortium. Am J Hum Genet 2000; 67 : 487–91. 13. Baudouin C, Peyman GA, Fredj-Reygrobellet D, et al. Immunohistological study of subretinal membranes in age-related macular degeneration. Jpn J Ophthalmol 1992; 36 : 443–51. 14. Hageman GS, Luthert PJ, Victor Chong NH, et al. An integrated hypothesis that considers drusen as biomarkers of immune-mediated processes at the RPE-Bruch’s membrane interface in aging and age-related macular degeneration. Prog Retin Eye Res 2001; 20 : 705–32. 15. Klein RJ, Zeiss C, Chew EY, et al. Complement factor H polymorphism in age-related macular degeneration. Science 2005; 308 : 385–9. 16. Souied EH, Leveziel N, Richard F, et al. Y402H complement factor H polymorphism associated with exudative age-related macular degeneration in the French population. Mol Vis 2005; 11 : 1135–40. 17. Gotoh N, Yamada R, Hiratani H, et al. No association between complement factor H gene polymorphism and exudative age-related macular degeneration in Japanese. Hum Genet 2006; 120 : 139–43. 18. Thakkinstian A, Han P, McEvoy M, et al. Systematic review and meta-analysis of the association between complement factor H Y402H polymorphisms and age-related macular degeneration. Hum Mol Genet 2006; 15 : 2784–90. 19. Seddon JM, Santangelo SL, Book K, et al. A genomewide scan for age-related macular degeneration provides evidence for linkage to several chromosomal regions. Am J Hum Genet 2003; 73 : 780–90. 20. Jakobsdottir J, Conley YP, Weeks DE, et al. Susceptibility genes for age-related maculopathy on chromosome 10q26. Am J Hum Genet 2005; 77 : 389–407. 21. Rivera A, Fisher SA, Fritsche LG, et al. Hypothetical LOC387715 is a second major susceptibility gene for age-related macular degeneration, contributing independently of complement factor H to disease risk. Hum Mol Genet 2005; 14 : 3227–36. 22. Chien J, Staub J, Hu SI, et al. A candidate tumor suppressor HtrA1 is downregulated in ovarian cancer. Oncogene 2004; 23 : 1636–44. 23. Dewan A, Liu M, Hartman S, et al. HTRA1 promoter polymorphism in wet age-related macular degeneration. Science 2006; 314 : 989–92. 24. Chen W, Xu W, Tao Q, et al. Meta-analysis of the association of the HTRA1 polymorphisms with the risk of age-related macular degeneration. Exp Eye Res 2009; 89 : 292–300. 25. Kanda A, Chen W, Othman M, et al. A variant of mitochondrial protein LOC387715/ARMS2, not HTRA1, is strongly associated with age-related macular degeneration. Proc Natl Acad Sci USA 2007; 104 : 16227–32. 26. Dewan A, Liu M, Hartman S, et al. HTRA1 promoter polymorphism in wet age-related macular degeneration. Science 2006; 314 : 989–92. 27. Yang Z, Camp NJ, Sun H, et al. A variant of the HTRA1 gene increases susceptibility to age-related macular degeneration. Science 2006; 314 : 992–3. 28. Fritsche LG, Loenhardt T, Janssen A, et al. Age-related macular degeneration is associated with an unstable ARMS2 (LOC387715) mRNA. Nat Genet 2008; 40 : 892–6. 29. Conley YP, Jakobsdottir J, Mah T, et al. CFH, ELOVL4, PLEKHA1 and LOC387715 genes and susceptibility to age-related maculopathy: AREDS and CHS cohorts and meta-analyses. Hum Mol Genet 2006; 15 : 3206–18. 30. Seddon JM, Francis PJ, George S, et al. Association of CFH Y402H and LOC387715 A69S with progression of age-related macular degeneration. JAMA 2007; 297 : 1793–800. 31. Seddon JM, Reynolds R, Maller J, et al. Prediction model for prevalence and incidence of advanced age-related macular degeneration based on genetic, demographic, and environmental variables. Invest Ophthalmol Vis Sci 2009; 50 : 2044–53. 32. Haddad WM, Coscas G, Soubrane G. Eligibility for treatment and angiographic features at the early stage of exudative age related macular degeneration. Br J Ophthalmol 2002; 86 : 663–9. 33. Cohen SY, Creuzot-Garcher C, Darmon J, et al. Types of choroidal neovascularization (CNV) in newly diagnosed exudative age-related macular degeneration (AMD). Br J Ophthalmol 2007; 91 : 1173–6. 34. Leveziel N, Zerbib J, Richard F, et al. Genotype-phenotype correlation for exudative age-related macular degeneration associated with homozygous HTRA1 and CFH genotypes. Invest Ophthalmol Vis Sci 2008; 49 : 3090–4. 35. Wegscheider BJ, Weger M, Renner W, et al. Association of complement factor H Y402H gene polymorphism with different subtypes of exudative age-related macular degeneration. Ophthalmology 2007; 114 : 738–42. 36. Droz I, Mantel I, Ambresin A, et al. Genotype-phenotype correlation of age-related macular degeneration: influence of complement factor H polymorphism. Br J Ophthalmol 2008; 92 : 513–7. 37. Leveziel N, Puche N, Richard F, et al. Genotypic influences on severity of exudative age-related macular degeneration. Invest Ophthalmol Vis Sci 2010 (sous presse). 38. Sakurada Y, Kubota T, Imasawa M, et al. Angiographic lesion size associated with LOC387715 A69S genotype in subfoveal polypoidal choroidal vasculopathy. Retina 2009; 29 : 1522–6. 39. Klein ML, Francis PJ, Rosner B, et al. CFH and LOC387715/ARMS2 Genotypes and Treatment with Antioxidants and Zinc for Age-Related Macular Degeneration. Ophthalmology 2008; 115 : 1019–25. 40. Rosenfeld PJ, Brown DM, Heier JS, et al. MARINA Study Group. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006; 355 : 1419–31. 41. Brown DM, Kaiser PK, Michels M, et al. Comparison of ranibizumab and verteporfin photodynamic therapy for neovascular age-related macular degeneration. N Engl J Med 2006; 355 : 1432–14. 42. Brantley MA Jr, Fang AM, King JM, et al. Association of complement factor H and LOC387715 genotypes with response of exudative age-related macular degeneration to intravitreal bevacizumab. Ophthalmology 2007; 114 : 2168–73. 43. Leveziel N, Soubrane G, H Souied E. Anti-VEGF : applications pratiques en ophtalmologie. Med Sci (Paris) 2009; 25 : 1105–7. 44. Brantley MA Jr, Edelstein SL, King JM, et al. Association of complement factor H and LOC387715 genotypes with response of exudative age-related macular degeneration to photodynamic therapy. Eye (Londres) 2009; 23 : 626–31. 45. Lin JM, Wan L, Tsai YY, et al. Vascular endothelial growth factor gene polymorphisms in age-related macular degeneration. Am J Ophthalmol 2008; 145 : 1045–51. 46. Haines JL, Schnetz-Boutaud N, Schmidt S, et al. Functional candidate genes in age-related macular degeneration: significant association with VEGF, VLDLR, and LRP6. Invest Ophthalmol Vis Sci 2006; 47 : 329–335. 47. Churchill AJ, Carter JG, Lovell HC, et al. VEGF polymorphisms are associated with neovascular age-related macular degeneration. Hum Mol Genet 2006; 15 : 2955–61. 48. Behar-Cohen F, Sennlaub F, Berdugo M. Espoirs thérapeutiques dans la DMLA. Med Sci (Paris) 2007; 23 : 127–9. |