| |
| Med Sci (Paris). 2010 May; 26(5): 504–508. Published online 2010 May 15. doi: 10.1051/medsci/2010265504.Un dermomyotome chez les poissons ? Pierre-Yves Rescan* Inra-Scribe, IFR 140, campus de Beaulieu, 35042 Rennes, France |
La morphogenèse du dermomyotome Le dermomyotome a pour origine les somites. Les somites sont des structures embryonnaires sphériques disposées de part et d’autre du tube neural, et répétées le long de l’axe antéro-postérieur de l’embryon. Les somites se forment juste après la gastrulation par segmentation récurrente du mésoderme paraxial. Au cours de leur maturation, les somites sont progressivement divisés en une partie ventrale mésenchymateuse qui donne le sclérotome à l’origine du squelette axial, et en une structure épithéliale dorsale qui forme le dermomyotome [
1]. Des expériences de rotation et de greffe de jeunes somites montrent que les axes ventrodorsal et médiolatéral ne sont pas prédéterminés mais se construisent progressivement. En effet, les cellules somitiques présentent initialement une multipotence (elles sont capables de donner indifféremment du sclérotome ventral ou du dermomyotome dorsal) que restreint progressivement l’installation de gradients morphogénétiques superposés, générés par la diffusion de substances solubles libérées par les tissus voisins du somite. Ainsi, à l’activité ventralisante (qui induit la formation du sclérotome) de la protéine Sonic Hedgehog sécrétée par la notochorde et le plancher du tube neural s’oppose l’action dorsalisante (qui induit la formation du dermomyotome et du myotome) des protéines de type Wnt sécrétées par l’ectoderme et la région dorsale du tube neural [
2]. |
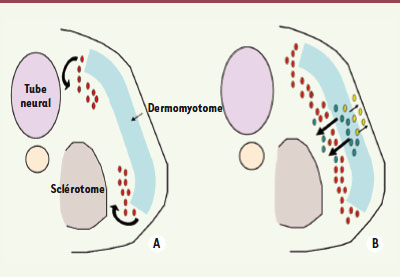
Le dermomyotome génère plusieurs vagues successives de cellules musculaires Après l’individualisation du dermomyotome, les quatre lèvres qui le délimitent en position dorsomédiane, ventrolatérale, rostrale et caudale vont s’incurver progressivement en direction du sclérotome. Ces différentes lèvres vont ensuite produire, par délamination, des cellules myogéniques (Figure 1A) qui vont s’allonger le long de l’axe rostrocaudal, puis se différencier en myocytes exprimant des protéines contractiles, et finalement former un myotome embryonnaire situé sous le dermomyotome [
3]. La lèvre dorsomédiane contribue à la formation de la musculature épaxiale (muscles dorsaux), tandis que la lèvre ventrolatérale participe à celle de la musculature hypaxiale (muscles ventraux et des membres). La lèvre caudale et la lèvre rostrale fournissent, quant à elles, des progéniteurs musculaires qui s’intercalent entre les myocytes provenant des lèvres dorsomédiane et ventrolatérale [3]. Les cellules myogéniques des quatre lèvres du dermomyotome ont la propriété d’exprimer Pax3, un régulateur transcriptionnel dont dépend le démarrage du programme myogénique [
4]. La formation du myotome primaire à partir des quatre lèvres du dermomyotome est suivie d’une transition épithélio-mésenchymateuse de la partie centrale du dermomyotome, conduisant à la libération d’une deuxième vague de précurseurs myogéniques qui colonisent le myotome primaire sous-jacent (Figure 1B). Cette colonisation est à l’origine des cellules musculaires embryonnaires et fœtales qui contribueront à l’expansion du myotome embryonnaire ; elle est la source des cellules satellites qui s’installeront entre lame basale et sarcolemme (membrane qui délimite une fibre) des fibres musculaires, et qui seront mobilisées pour la croissance ultérieure des muscles du tronc [
5–
7]. Les progéniteurs musculaires de la partie centrale du dermomyotome expriment les gènes Pax3 et Pax7 [4]. L’expression des gènes Pax cesse lorsque démarre celle des gènes codant des régulateurs transcriptionnels myogéniques (MRF) comme MyoD, myogénine, myf5 et mrf4, qui assurent le déclenchement du programme de différenciation musculaire.
 | Figure 1.
Le dermomyotome génère plusieurs phases successives de progéniteurs musculaires. A et B. Représentation schématique d’une coupe transversale du tronc d’un embryon de poulet. A. Les cellules (en rouge) des lèvres dorsomédiane et ventrolatérale (mais aussi caudale et rostrale, non représentées sur ce schéma) du dermomyotome migrent entre le sclérotome et le dermomyotome où elles se différencient pour former un myotome embryonnaire. B. Les cellules (en vert) du dermomyotome central subissent ensuite une transition épithélio-mésenchymateuse et migrent en direction du myotome embryonnaire où elles prolifèrent, forment de nouvelles fibres ou fusionnent avec les fibres embryonnaires. Certains progéniteurs musculaires libérés par le dermomyotome central seront à l’origine des cellules satellites qui contribueront à la croissance et à la régénération du muscle. Le dermomyotome produit aussi des cellules dermogéniques (en jaune) qui vont former le derme dorsal. |
|
Le dermomyotome contribue à la formation du derme dorsal et produit des cellules endothéliales Le dermomyotome produit d’autres tissus que le muscle, et en particulier le derme dorsal du tronc. Les cellules dermogéniques sont formées au cours de la transition épithélio-mésenchymateuse du dermomyotome central (Figure 1B). Contrairement aux progéniteurs myogéniques, les cellules dermogéniques cessent rapidement d’exprimer les gènes Pax [
8], migrent en direction de l’ectoderme et forment en dessous de ce dernier un mésenchyme qui exprimera le marqueur Dermo-1 [
9]. Il a été montré que Wnt-1, qui est produit par la partie dorsale du tube neural, exerce une action inductrice du développement du derme dorsal [
10]. Le dermomyotome produit également deux lignées endothéliales : les cellules endothéliales des vaisseaux sanguins (angioblastes) qui expriment VEGFR2 (vascular endothelial growth factor receptor-2), et les cellules endothéliales des vaisseaux lymphatiques (lymphangioblastes) [
11]. |
Un épithélium externe exprimant des marqueurs du dermomyotome recouvre le myotome embryonnaire du poisson Ainsi, chez les amniotes, le dermomyotome apparaît sous la forme d’un épithélium situé dans la partie dorso-latérale du somite, en dessous de l’épiderme. Il est la source cellulaire des progéniteurs musculaires du tronc et des membres. Qu’en est-il de la différenciation d’une telle structure dans les somites des vertébrés inférieurs ? Des descriptions parfois anciennes ont évoqué la présence d’un épithélium externe recouvrant le myotome embryonnaire du poisson [
12]. Il a été suggéré, compte tenu de sa position sous-ectodermique et de son origine somitique, que cet épithélium pourrait constituer une structure à l’origine du dermatome [
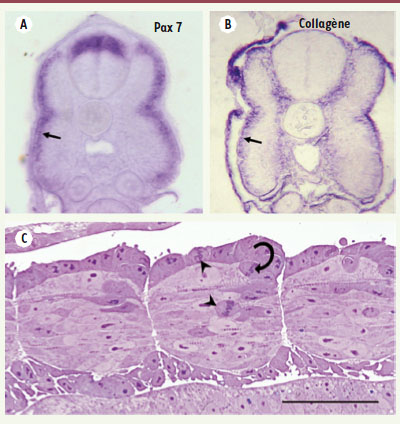
13]. En accord avec cette interprétation, nous avons observé que l’épithélium externe de l’embryon de truite ne présente pas de différenciation contractile, n’exprime pas la myogénine mais le collagène de type I qui est déposé entre sa surface et l’épiderme (Figure 2B) [
14]. Il a été rapporté, par ailleurs, que cet épithélium exprime aussi Pax3 et Pax7 (Figure 2A) [12], tout comme le fait le dermomyotome des amniotes. Certains auteurs ont alors proposé que l’épithélium externe, qui est aussi présent chez les agnathes comme la lamproie [
15], serait l’homologue du dermomyotome des amniotes [12]. Le dermomyotome serait ainsi une structure ancienne commune aux vertébrés. Des études de marquages cellulaires par injection de colorants vitaux ont permis récemment de caractériser la fonction de l’épithélium externe du somite de poisson.
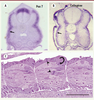 | Figure 2.
Caractérisation moléculaire et histologique de l’épithélium externe de l’embryon de truite. A et B. Coupes transversales d’un embryon de truite au stade œillé (la somitogenèse est achevée) après hybridation in situ. L’épithélium externe recouvrant le myotome embryonnaire (flèche) exprime à la fois Pax7 (A) et la chaîne a1 du collagène de type I (B). C. Coupe horizontale d’un embryon de truite en fin de somitogenèse (pôle antérieur à gauche). Le dermomyotome s’incurve en position postérieure (flèche) et libère des cellules qui pénètrent dans le myotome embryonnaire. Des figures de mitose sont visibles dans le dermomyotome et le myotome embryonnaire (têtes de flèche). |
|
La maturation du somite chez les poissons et la formation de l’épithélium externe Le somite du poisson diffère notablement de celui des amniotes. D’abord, le territoire somitique à l’origine du sclérotome en position ventrale est très réduit. Ensuite, l’étude des patrons d’expression des MRF fait apparaître différents domaines qui lui sont propres ;
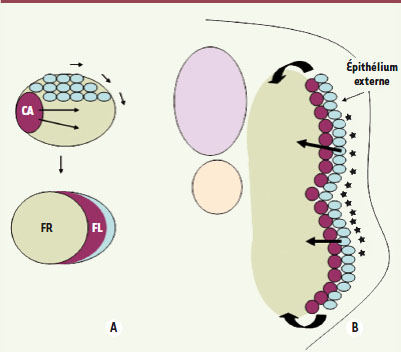
: premièrement, une population cellulaire adaxiale1 jouxtant la notochorde qui exprime très tôt les MRF ; deuxièmement, une population située dans la partie postérieure du somite précoce, qui exprime également les MRF mais plus tardivement que les cellules adaxiales ; enfin, une population n’exprimant pas les MRF et localisée dans la moitié antérieure du somite. Des expériences d’injection de colorants vitaux ont permis de décrire l’évolution de ces différentes populations cellulaires. Les cellules adaxiales migrent latéralement pour former les fibres lentes du myotome embryonnaire (Figure 3A). Ces cellules, qui sont les premières à exprimer les MRF, sont aussi les premières à se différencier. Les cellules de la moitié postérieure du somite contribuent à la formation des fibres rapides profondes du myotome embryonnaire. Enfin, les cellules de la moitié antérieure se déplacent vers la surface latérale du somite, pour recouvrir le myotome primaire et former l’épithélium externe recouvrant le myotome embryonnaire (Figure 3A) [
16,
17]. 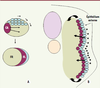 | Figure 3.
Le somite des poissons forme un épithélium externe qui produit des progéniteurs musculaires à l’origine de l’expansion du myotome embryonnaire. A. Représentation schématique en vue dorsale d’un somite d’un embryon de poisson montrant le déplacement des cellules de la moitié antérieure du somite (en bleu) vers la surface externe. À cet endroit, ces cellules forment un épithélium recouvrant le myotome embryonnaire composé de fibres rapides profondes (FR) et de fibres lentes superficielles (FL). La formation des fibres lentes résulte de la migration latérale des cellules adaxiales (CA).B. Schéma d’une coupe transversale d’un embryon de poisson montrant la migration des cellules myogéniques de l’épithélium externe vers le myotome embryonnaire. Les flèches indiquent les chemins empruntés par les cellules de l’épithélium externe. Les étoiles représentent le collagène interstitiel produit par l’épithélium externe et l’épiderme. |
|
Croissance du myotome embryonnaire à partir de l’épithélium externe du somite des poissons Les expériences de marquage cellulaire ont montré que des cellules de l’épithélium externe finissent par s’incorporer au myotome embryonnaire où elles produisent de nouvelles fibres musculaires qui s’ajoutent à celles du myotome embryonnaire [16, 17]. Il a été proposé, chez le poisson zèbre, que ce déplacement s’effectuerait entre les fibres lentes superficielles (Figure 3B) [17]. Steinbacher et al. [
18] ont proposé une autre hypothèse : l’acheminement des cellules myogéniques vers le myotome embryonnaire résulterait de la dé-épithélialisation des lèvres ventrale, dorsale et caudale (Figures 3B et 2C). Il a été montré que la moitié antérieure des somites rostraux, à partir de laquelle se forme l’épithélium externe, produit aussi des progéniteurs cellulaires à l’origine de la musculature hypaxiale et appendiculaire (qui concerne les nageoires chez les poissons) [16]. En revanche, il n’est pas encore formellement établi que les cellules satellites qui constituent, après le développement, la fraction cellulaire myogène du muscle, dérivent de l’épithélium externe. L’examen des mutants de poisson zèbre smu et ace a révélé que la différenciation des cellules myogènes de l’épithélium externe en nouvelles fibres musculaires est sous la dépendance non seulement de l’activité des protéines Hedgehog, tout comme l’est la différenciation musculaire des cellules myogènes du dermomyotome des amniotes, mais aussi de l’activité du FGF8 (fibroblast growth factor 8) [
19]. On notera une différence importante entre l’épithélium externe des poissons téléostéens et le dermomyotome des amniotes : le dermomyotome produit le myotome embryonnaire, alors que chez les poissons téléostéens ce sont les cellules adaxiales et les cellules postérieures du somite épithélial qui le forment. À propos des progéniteurs cellulaires du myotome embryonnaire, il est intéressant de noter des traits qui sont communs aux cellules de la lèvre dorsomédiane du dermomyotome des amniotes et aux cellules adaxiales du poisson. En effet, les cellules adaxiales comme les cellules de la lèvre dorsomédiane sont les premières à exprimer les MRF et à se différencier ; elles expriment le gène NLRR-1 (neuronal leucine-rich repeat-1) qui code une molécule transmembranaire impliquée dans l’adhérence cellulaire [
20], et enfin elles sont programmées pour former des fibres musculaires dont le phénotype est essentiellement lent [
21]. |
La participation des cellules de l’épithélium externe à la formation du derme : une question débattue Une propriété du dermomyotome des amniotes est de contribuer à la formation des vaisseaux sanguins et lymphatiques, ainsi qu’à celle du derme. Le potentiel angiogénique des cellules somitiques externes n’a pas été montré à ce jour. En recourant à des techniques de marquage cellulaire, Hollway et al. [16] ont publié que la moitié antérieure du somite chez le poisson zèbre, à l’origine de l’épithélium externe, contient des cellules qui migrent sous l’ectoderme pour former des cellules du derme. Ces résultats n’ont cependant pas été confirmés par Stellabotte et al. [17]. Il n’en reste pas moins que l’épithélium externe exprime, outre les gènes Pax3/7, des marqueurs de différenciation dermogénique, comme le régulateur transcriptionnel Dermo-1 [
22] et le collagène de type I [14, 19]. Si donc la question de la différenciation de l’épithélium externe en cellules dermiques est encore discutée, il est clair cependant que l’épithélium externe de l’embryon de poisson contribue, en même temps que la couche profonde de l’épiderme, au dépôt d’un tissu conjonctif acellulaire formant un stroma dermique primitif qui s’accumule entre myotome et épiderme (Figure 3B). |
Le somite des poissons forme donc au cours de sa maturation un épithélium externe qui présente de nombreuses caractéristiques du dermomyotome des amniotes : il est localisé à la périphérie du somite, il exprime des gènes du dermomyotome, et enfin il produit des progéniteurs musculaires qui contribuent à la croissance du myotome embryonnaire et à la formation de la musculature appendiculaire. Des différences toutefois subsistent entre ces deux structures, qui doivent être imputées à la distance phylogénétique, somme toute importante, séparant les poissons téléostéens des amniotes. Ainsi, alors que le dermomyotome des amniotes se développe à partir de la région dorsale du somite, l’épithélium externe des poissons dérive de la moitié antérieure du somite. Par ailleurs le dermomyotome des amniotes est à l’origine du myotome embryonnaire, alors que le myotome embryonnaire des poissons dérive de populations somitiques (cellules adaxiales et cellules de la moitié postérieure du somite) qui n’ont pas pour origine l’épithélium externe. Enfin, reste à savoir quelle est la capacité de l’épithélium externe à produire d’autres cellules que les cellules myogéniques. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
L’auteur remercie le professeur Walter Stoiber (Université de Salzbourg) de lui avoir aimablement transmis la figure 2C.
|
Footnotes |
1. Duband JL. La segmentation du mésoderme chez les vertébrés. Med Sci (Paris) 1993; 9 : 791–9. 2. Brent AE, Tabin CJ. Developmental regulation of somite derivatives: muscle, cartilage and tendon. Curr Opin Genet Dev 2002; 12 : 548–57. 3. Gros J, Scaal M, Marcelle C. A two-step mechanism for myotome formation in chick. Dev Cell 2004; 6 : 875–82. 4. Buckingham M, Relaix F. The role of Pax genes in the development of tissues and organs: Pax3 and Pax7 regulate muscle progenitor cell functions. Annu Rev Cell Dev Biol 2007; 23 : 645–73. 5. Gros J, Manceau M, Thomé V, et al. A common somitic origin for embryonic muscle progenitors and satellite cells. Nature 2005; 435 : 954–8. 6. Relaix F, Rocancourt D, Mansouri A, et al. A Pax3/Pax7-dependent population of skeletal muscle progenitor cells. Nature 2005; 435 : 948–53. 7. Manceau M, Marcelle C, Gros J. Une source unique de progéniteurs musculaires. Med Sci (Paris) 2005; 21 : 915–7. 8. Ben-Yair R, Kalcheim C. Lineage analysis of the avian dermomyotome sheet reveals the existence of single cells with both dermal and muscle progenitor fates. Development 2005; 132 : 689–701. 9. Li L, Cserjesi P, Olson EN. Dermo-1: a novel twist-related bHLH protein expressed in the developing dermis. Dev Biol 1995; 172 : 280–92. 10. Olivera-Martinez I, Thélu J, Teillet MA, et al. Dorsal dermis development depends on a signal from the dorsal neural tube, which can be substituted by Wnt-1. Mech Dev 2001; 100 : 233–44. 11. Wilting J, Becker J. Two endothelial cell lines derived from the somite. Anat Embryol
(Berlin) 2006; 211 (suppl 1) : 57–63. 12. Devoto SH, Stoiber W, Hammond CL, et al. Generality of vertebrate developmental patterns: evidence for a dermomyotome in fish Evol Dev 2006; 8 :101–10. 13. Waterman RE. Development of the lateral musculature in the teleost, Brachydanio rerio: a fine structural study. Am J Anat 1969; 125 : 457–94. 14. Rescan PY, Ralliere C, Chauvigné F, et al. Expression patterns of collagen I (alpha1) encoding gene and muscle-specific genes reveal that the lateral domain of the fish somite forms a connective tissue surrounding the myotome. Dev Dyn 2005; 233 : 605–11. 15. Kusakabe R, Kuratani S. Evolutionary perspectives from development of mesodermal components in the lamprey Dev Dyn 2007; 236 : 2410–20. 16. Hollway GE, Bryson-Richardson RJ, Berger S, et al. Whole-somite rotation generates muscle progenitor cell compartments in the developing zebrafish embryo. Dev Cell 2007; 12 : 207–19. 17. Stellabotte F, Dobbs-McAuliffe B, Fernández DA, et al. Dynamic somite cell rearrangements lead to distinct waves of myotome growth. Development 2007; 134 : 1253–7. 18. Steinbacher P, Stadlmayr V, Marschallinger J, et al. Lateral fast muscle fibers originate from the posterior lip of the teleost dermomyotome. Dev Dyn 2008; 237 : 3233–9. 19. Hammond CL, Hinits Y, Osborn DP, et al. Signals and myogenic regulatory factors restrict pax3 and pax7 expression to dermomyotome-like tissue in zebrafish. Dev Biol 2007; 302 : 504–21. 20. Dumont E, Rallière C, Tabet KC, et al. A NLRR-1 gene is expressed in migrating slow muscle cells of the trout (Oncorhynchus mykiss) embryo. Dev Genes Evol 2007; 217 : 469–75. 21. Biressi S, Molinaro M, Cossu G. Satellite cells, myoblasts and other occasional myogenic progenitors: possible origin, phenotypic features and role in muscle regeneration. Dev Biol 2007; 304 : 633–51. 22. Dumont E, Rallière C, Rescan PY. Identification of novel genes including Dermo-1, a marker of dermal differentiation, expressed in trout somitic external cells. J Exp Biol 2008; 211 : 1163–8. |