| |
| Med Sci (Paris). 2010 May; 26(5): 470–473. Published online 2010 May 15. doi: 10.1051/medsci/2010265470.
FOXL2, le gardien de l’identité ovarienne Maëlle Pannetier* and Eric Pailhoux* INRA, UMR 1198-Biologie du développement et de la reproduction, bâtiment J. Poly, 78350 Jouy-en-Josas, France MeSH keywords: Animaux, Hormone antimullérienne, physiologie, Artiodactyla, Troubles du développement sexuel, génétique, Femelle, Facteurs de transcription Forkhead, Hormones sexuelles stéroïdiennes, Humains, Mâle, Souris, Souris knockout, Souris transgéniques, Modèles biologiques, Ovaire, embryologie, métabolisme, Facteur de transcription SOX-9, Chromosomes sexuels, Différenciation sexuelle, Testicule |
La différenciation sexuelle et les différences qui existent entre les deux sexes ont toujours été sources d’interrogations et de débat. Pour les philosophes grecs, le sexe du fœtus ou sa ressemblance avec l’un des parents était déterminé par un jeu d’opposition (force de la semence, opposition gauche/droite). À l’heure de la biologie moléculaire, les mécanismes intervenant dans la détermination du sexe sont de mieux en mieux connus : le schéma général qui prévaut actuellement met en jeu différents signaux mâles et femelles qui s’opposent, provoquant le basculement vers un sexe ou vers l’autre. Dans leur récente étude des conséquences de l’invalidation conditionnelle du gène Foxl2, les équipes de Mathias Treier et Robin Lovell-Badge démontrent que cette opposition mâle/femelle perdure même dans un tissu totalement différencié comme l’est l’ovaire adulte de souris [
1]. |
Sexe chromosomique et sexe phénotypique Chez les mammifères, le sexe chromosomique du futur individu est déterminé dès la fécondation par l’apport, par le spermatozoïde fécondant, d’un chromosome X ou d’un chromosome Y. Au cours du développement fœtal, les gonades qui se différencient vont se déterminer en accord avec ce sexe génétique et évoluer vers des ovaires (XX) ou des testicules (XY). Une fois le testicule différencié, il sécrète différentes hormones (androgènes, antimullerian hormone AMH) qui vont orienter la différenciation du tractus génital interne et externe vers un phénotype mâle. En l’absence de ces hormones, un tractus génital de type femelle se met en place. Ce sont ces dernières observations qui ont conduit une partie de la communauté scientifique à considérer, à tort, que le sexe femelle était un sexe par défaut. |
SRY, un déterminant testiculaire Après une quête qui a duré presque 30 ans et qui a été émaillée de quelques fausses pistes (antigène HY, ZFY1), le gène SRY, déterminant du sexe mâle, nécessaire et suffisant à la différenciation du testicule, a été isolé sur le chromosome Y humain en 1990 [
2]. Les preuves de son action déterminante pour la formation du testicule ont été apportées par : (1) la découverte de mutations de ce gène chez des patientes présentant une inversion sexuelle de type femmes XY et (2) l’induction d’une différenciation testiculaire chez des souris XX transgéniques pour ce seul gène du chromosome Y [
3,
4]. À la suite de la découverte de SRY, un autre gène-clé de la différenciation testiculaire a pu être mis en évidence, le gène SOX9. La surexpression ectopique de ce gène dans une gonade XX en cours de différenciation induit la formation de testicules comme le fait l’addition de Sry [
5,
6]. Ainsi, SOX9 est situé très en amont dans la cascade des gènes de la différenciation testiculaire et il serait « mis en marche » par SRY. Pendant près de 15 ans, les mécanismes moléculaires déclenchant l’activation de SOX9 ont été recherchés, et ce n’est que récemment qu’une action activatrice directe de Sry sur la région promotrice de Sox9 a pu être démontrée chez la souris [
7]. Néanmoins, cette action directe sur l’activation de la voie mâle ne permet pas d’expliquer certaines pathologies d’inversion sexuelle de type mâle XX en l’absence de SRY [
8]. Dans ces pathologies, une différenciation testiculaire se met en place chez des individus XX en réponse à l’expression de SOX9 ; il faut donc imaginer que chez les femelles, ce gène mâle est normalement inhibé par un gène actif chez les femelles (modèle de double inhibition ou modèle du gène Z putatif, voir encadré). Ainsi, en plus d’une action directe sur SOX9, SRY protégerait la voie mâle en inhibant cet inhibiteur chez les individus XY. Chez les individus XX, des mutations amorphes homozygotes de Z (perte de fonction) induisent l’expression de SOX9 en l’absence de SRY.

|
FOXL2, un gène Z candidat Afin de découvrir de tels gènes Z, gènes « anti-testiculaires », différentes analyses génétiques ont été mises en place dans des populations d’individus mâles XX. Ce type d’inversion sexuelle est rencontré chez l’homme, mais aussi chez plusieurs espèces animales : le chien, le cheval, le porc et la chèvre. À l’heure actuelle, deux gènes responsables de ce type de pathologie ont pu être isolés, FOXL2 chez la chèvre et R-Spondin1 (RSPO1) chez l’homme [
9,
10]. Chez la chèvre, la perte de fonction du gène FOXL2 est syndromique. Elle est liée à la mutation PIS (Polled intersex syndrome) responsable de l’absence de cornes (dominant) et de l’inversion sexuelle des individus XX homozygotes (récessif). Cette mutation est une délétion d’environ 12 kb localisée à 300 kb en amont du gène FOXL2. C’est une mutation régulatrice qui affecte l’expression de FOXL2 et d’au moins 2 longs ARN non codants, de manière différente selon le tissu considéré (perte d’expression dans les ovaires, gain d’expression dans les cornes). Dans les gonades, la perte de fonction de FOXL2 entraîne très précocement (1) la déféminisation de la gonade, avec notamment perte de l’expression de l’enzyme codant pour l’aromatase (et donc perte de la production d’œstrogènes) et (2) la surexpression de SOX9 et la masculinisation complète des gonades et du tractus génital interne et externe des individus XX [10,
11]. |
Invalidation de Foxl2 chez la souris - Des différences entre espèces L’invalidation du gène Foxl2 a été réalisée chez la souris par deux équipes distinctes [
12,
13]. Bien que ce gène soit exprimé très précocement au cours de la différenciation ovarienne murine, les effets de son inactivation ne sont visibles qu’après la naissance avec l’abolition de la formation des follicules primaires conduisant à une insuffisance ovarienne. Selon ces études, Foxl2 joue un rôle majeur dans la formation des follicules ovariens et il constitue un gène-clé de la fertilité femelle. Pour expliquer les différences de phénotypes observées entre la chèvre et la souris, un paramètre important doit être pris en compte : la production d’hormones femelles. En effet, dans l’espèce caprine les œstrogènes sont produits très tôt dans la gonade femelle, participant à la morphogenèse ovarienne précoce. Cette production hormonale est directement sous le contrôle de FOXL2 qui régule positivement l’expression du gène codant pour l’aromatase (responsable de la conversion des androgènes en œstrogènes) (Figure 1) [
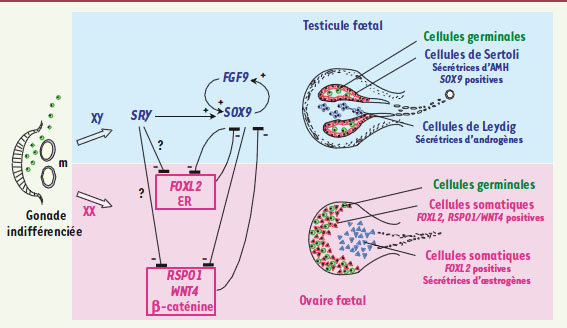
14]. Au contraire, dans l’espèce murine, le développement ovarien se fait en l’absence de toute production hormonale et ce n’est qu’après la naissance, lors de la croissance folliculaire, que la stéroïdogenèse ovarienne se met en place. Ainsi, pour faire un ovaire, la chèvre a besoin d’œstrogènes, alors que la souris a développé d’autres stratégies évolutives.  | Figure 1.
Signaux antagonistes au cours du développement gonadique fœtal chez la chèvre. Les crêtes génitales apparaissent sous forme d’un épaississement de l’épithélium cœlomique du mésonéphros (m). Après un stade de croissance où la gonade est dite indifférenciée, la différenciation en testicule ou en ovaire va s’engager en fonction du sexe chromosomique du fœtus. Chez les individus XY, porteur du déterminant testiculaire SRY, la cascade des gènes mâles est activée en commençant par SOX9 dont l’expression est amplifiée grâce à une boucle de régulation utilisant la voie de signalisation FGF9 (fibroblast growth factor). L’expression de SRY puis de SOX9 permet de spécifier les cellules précurseurs des cellules de Sertoli qui vont s’organiser pour former des tubes séminifères enfermant les cellules germinales en arrêt mitotique. À la suite de la différenciation de ces cellules de soutien, la lignée stéroïdogène se met en place sous la forme des cellules de Leydig qui vont sécréter des androgènes. Chez les individus XX où SRY est absent, deux voies moléculaires sont responsables de la différenciation ovarienne dans deux types cellulaires somatiques différents : la voie canonique de la β-caténine (activée par RSPO1/WNT4) et la voie activée par FOXL2 et les récepteurs aux œstrogènes (ER). En effet, chez les bovidés (bovin, ovin, caprin), avant même l’initiation de la méiose des cellules germinales, l’ovaire s’organise très tôt en deux compartiments : le cortex où sont localisées les cellules germinales en phase active de division et les cellules exprimant RSPO1/WNT4, et la médulla où les cellules somatiques XX produisent des œstrogènes sous le contrôle de FOXL2. Ces cellules stéroïdogènes n’ont pas d’équivalent dans l’ovaire fœtal de souris, chez qui la voie initiée par la β-caténine est privilégiée pour l’élaboration de la gonade femelle. De plus en plus de travaux réalisés chez la chèvre, chez la souris ou chez l’homme tendent à démontrer l’existence de signaux antagonistes entre la voie mâle (SRY/SOX9) et la voie femelle (FOXL2 et β-caténine). |
|
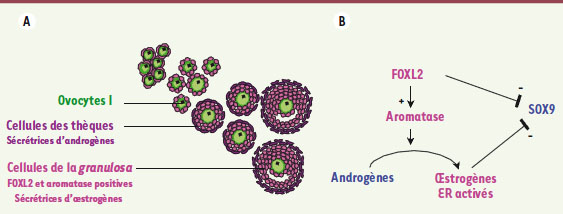
Perte de fonction du gène Foxl2 chez la souris adulte Dans leur étude récente d’invalidation conditionnelle du gène Foxl2 dans l’ovaire adulte, les équipes de Mathias Treier et Robin Lovell-Badge viennent d’apporter des éléments de réconciliation entre les différents modèles [1]. En effet, la perte de fonction du gène Foxl2 dans l’ovaire adulte entraîne, après un délai de seulement 4 jours, la surexpression du gène Sox9 dans les cellules de la granulosa. Celles-ci vont se trans-différencier en cellules de Sertoli qui, à leur tour, vont induire la trans-différenciation des cellules des thèques en cellules de Leydig conduisant à une « inversion » de la stéroïdogenèse ovarienne. Les auteurs montrent également que Foxl2, en partenariat avec les récepteurs des œstrogènes, inhibe directement la transcription du gène Sox9 (Figure 2). En fait, l’invalidation conditionnelle de Foxl2 ou l’invalidation complète des deux récepteurs œstrogéniques [
15] conduit au même phénotype chez la souris : trans-différenciation des cellules de la gonade d’un caractère femelle vers mâle. Ces résultats permettent de mieux comprendre l’apparition d’une inversion sexuelle mâle XX dans le cadre de la mutation PIS chez la chèvre. Ainsi, la perte de fonction de FOXL2, engendrant très précocement l’inversion de la stéroïdogenèse ovarienne, est bien responsable de la surexpression de SOX9 dans les gonades XX mutantes.  | Figure 2.
FOXL2 et les œstrogènes, gardiens de l’identité ovarienne dans l’ovaire adulte. A. Développement folliculaire dans l’ovaire adulte. Lors de la formation des follicules ovariens, les cellules germinales ont déjà initié leur méiose et sont bloquées au stade prophase de la première division méiotique sous forme d’ovocytes I. Les cellules somatiques, futures cellules de la granulosa, s’organisent autour des ovocytes pour former des follicules. Au fur et à mesure de la croissance folliculaire, les cellules de la granulosa se multiplient, alors que les cellules des thèques se différencient autour des follicules. Ces dernières expriment toutes les enzymes de la stéroïdogenèse, permettant de produire des androgènes qui seront aromatisés en œstrogènes dans les cellules de la granulosa qui expriment l’ultime enzyme responsable de la synthèse d’hormones femelles, l’aromatase. B. Les gardiens de l’identité femelle dans l’ovaire adulte. FOXL2 est un gène indispensable à la formation des follicules. Il est exprimé par les cellules de la granulosa où il va directement contrôler l’expression de l’aromatase et donc la production d’œstrogènes. C’est par l’action conjointe de FOXL2 et des œstrogènes, via leurs récepteurs (ER), que le gène majeur de l’identité mâle, SOX9, est maintenu silencieux. L’absence d’expression de FOXL2 ou des 2 types de ER entraîne une dérepression de SOX9, induisant une masculinisation des cellules somatiques de l’ovaire adulte. |
Enfin, de façon plus générale, ces expériences démontrent, qu’en plus de son rôle dans la morphogenèse de la gonade femelle et en particulier dans la formation des follicules ovariens, FOXL2, à l’âge adulte, est un gardien de l’identité femelle. La frontière entre le masculin et le féminin n’a jamais été aussi mince. FOXL2, un seul gène vous manque et tout est déféminisé… |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Uhlenhaut NH, Jakob S, Anlag K, et al. Somatic sex reprogramming of adult ovaries to testes by FOXL2 ablation. Cell 2009; 139 : 1130–42. 2. Sinclair AH, Berta P, Palmer MS, et al. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature 1990; 346 : 240–4. 3. Berta P, Hawkins JR, Sinclair AH, et al. Genetic evidence equating SRY and the testis-determining factor. Nature 1990; 348 : 448–50. 4. Koopman P, Gubbay J, Vivian N, et al. Male development of chromosomally female mice transgenic for Sry. Nature 1991; 351 : 117–21. 5. Vidal VP, Chaboissier MC, de Rooij DG, et al. Sox9 induces testis development in XX transgenic mice. Nat Genet 2001; 28 : 216–7. 6. Qin Y, Bishop CE. Sox9 is sufficient for functional testis development producing fertile male mice in the absence of Sry. Hum Mol Genet 2005; 14 : 1221–9. 7. Sekido R, Lovell-Badge R. Sex determination involves synergistic action of SRY and SF1 on a specific Sox9 enhancer. Nature 2008; 453 : 930–4. 8. McElreavey K, Vilain E, Abbas N, et al. A regulatory cascade hypothesis for mammalian sex determination : SRY represses a negative regulator of male development. Proc Natl Acad Sci USA 1993; 90 : 3368–72. 9. Parma P, Radi O, Vidal V, et al R-spondin1 is essential in sex determination, skin differentiation and malignancy. Nat Genet 2006; 38 : 1304–9. 10. Pailhoux E, Vigier B, Chaffaux S, et al. A 11.7-kb deletion triggers intersexuality and polledness in goats. Nat Genet 2001; 29 : 453–8. 11. Pailhoux E, Vigier B, Vaiman D, et al. Ontogenesis of female-to-male sex-reversal in XX polled goats. Dev Dyn 2002; 224 : 39–50. 12. Schmidt D, Ovitt CE, Anlag K, et al. The murine winged-helix transcription factor Foxl2 is required for granulosa cell differentiation and ovary maintenance. Development 2004; 131 : 933–42. 13. Uda M, Ottolenghi C, Crisponi L, et al. Foxl2 disruption causes mouse ovarian failure by pervasive blockage of follicle development.Hum Mol Genet 2004; 13 : 1171–81. 14. Pannetier M, Fabre S, Batista F, et al. FOXL2 activates P450 aromatase gene transcription : towards a better characterization of the early steps of mammalian ovarian development. J Mol Endocrinol 2006; 36 : 399–413. 15. Couse JF, Hewitt SC, Bunch DO, et al. Postnatal sex reversal of the ovaries in mice lacking estrogen receptors alpha and beta. Science 1999; 286 : 2328–31. 16. McElreavey K, Vilain E, Abbas N, Herskowitz I, Fellous M. A regulatory cascade hypothesis for mammalian sex determination : SRY represses a negative regulator of male development. Proc Natl Acad Sci USA 1993; 90 : 3368–72. |