| |
| Med Sci (Paris). 2010 April; 26(4): 439–442. Published online 2010 April 15. doi: 10.1051/medsci/2010264439.Coup de cœur pour un progéniteur multipotent mésodermique dérivé de cellules souches embryonnaires humaines Laure Coulombel* Médecine/Sciences, Inserm, 2, rue d’Alésia, 75014 Paris, France MeSH keywords: Animaux, Antigènes CD15, analyse, Marqueurs biologiques, Protéine morphogénétique osseuse de type 2, pharmacologie, Différenciation cellulaire, effets des médicaments et des substances chimiques, Lignage cellulaire, Séparation cellulaire, Cellules cultivées, transplantation , Cellules souches embryonnaires, classification, cytologie |
Nous vivons une époque formidable ! Le chemin de la thérapie cellulaire utilisant des cellules souches embryonnaires humaines (CSEh) est « montant, sablonneux, malaisé », mais le duo de choc que forment Michel Pucéat et Philippe Menasché et leurs équipes (Inserm/AP-HP/Université Paris Descartes) l’arpente depuis longtemps et touche au but. Il franchit aujourd’hui une étape cruciale en purifiant un progéniteur multipotent cardiogénique dérivé de CSEh et fonctionnel après transplantation dans un modèle de primate non humain. L’histoire nous est contée dans le Journal of Clinical Investigation [
1]. Rappelons que le défi est, chez les patients ayant fait un infarctus, de remplacer les cardiomyocytes lésés ou morts et d’éviter le développement d’une fibrose qui compromet à long terme la contractilité myocardique. Toute la question est celle de la nature de la cellule thérapeutique. Trop différenciée et donc post-mitotique, elle serait peu efficace, trop indifférenciée et encore pluripotente, elle ferait courir un risque tumoral ; il faut donc sélectionner un progéniteur déjà spécifié vers les voies cardiaques, mais encore capable de prolifération, voire multipotent. Mais, à la différence du système hématopoïétique, de la peau, de l’intestin, ou même du cerveau, tissus dans lesquels des cellules souches spécifiques de ces tissus sont bien caractérisées, ce concept est plus difficile à établir dans le cœur adulte. Cet organe résulte de l’assemblage, au cours de l’embryogenèse, de plusieurs « pièces » formant d’abord un cœur tubulaire primaire puis les quatre chambres (oreillettes et ventricules) et dont le fonctionnement chez l’adulte requiert la coordination subtile de plusieurs populations cellulaires, myocytes, cellules endothéliales, cellules musculaires lisses et fibroblastes [
2]. Toutes dérivent du mésoderme embryonnaire à partir duquel sont générés consécutivement deux lignages : primaire à l’origine du ventricule gauche et d’une partie des oreillettes, et secondaire très prolifératif à l’origine du reste du cœur. Si de tels progéniteurs communs aux deux lignages existent, ils semblent confinés à la période embryonnaire, et chez l’adulte, leur réalité est très controversée. C’est ce qui explique que probablement seules des cellules pluripotentes - cellules souches embryonnaires (CSE) ou les récentes iPS (induced pluripotent stem cells) - puissent offrir un produit cellulaire efficace dans ces indications de réparation cardiovasculaire. |
Spécification in vitro de cellules souches embryonnaires humaines en un progéniteur multipotent cardiogénique Or Michel Pucéat et son équipe nous révèlent dans le Journal of Clinical Investigation la purification et la caractérisation très détaillée - phénotypique, moléculaire et fonctionnelle - d’une telle population de progéniteurs multipotents cardiaques chez l’homme dont la spécification est induite à partir de CSE humaines (CSEh) et qui s’avèrent être d’excellents candidats thérapeutiques puisqu’ils se différencient en cardiomyocytes exprimant les protéines contractiles après leur transplantation in vivo chez les primates. Une solide connaissance de l’embryologie est un prérequis indispensable au succès des protocoles de différenciation, quel que soit le lignage, à partir de CSEh [
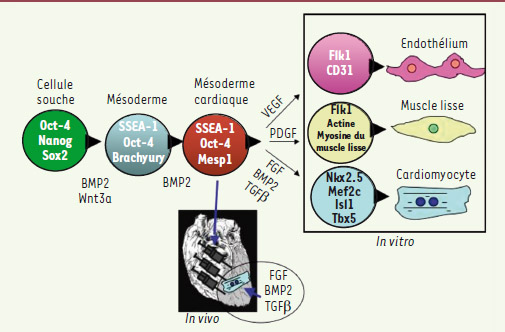
3]. En effet, il faut d’abord engager les CSEh pluripotentes vers l’un des trois feuillets embryonnaires, ici le mésoderme (Figure 1). La « recette » associe le morphogène BMP2 (bone morphogenetic protein) à un inhibiteur du récepteur du FGF2 (fibroblast growth factor 2) et au Wnt3a dont la sécrétion endogène est induite dans ces conditions. Or, cet engagement dans la voie mésodermique/cardiogénique, qui survient au jour 4, s’accompagne de l’expression de SSEA-1 (CD15)1,, ce qui fait de ce marqueur - d’expression membranaire - un excellent outil de purification de ces progéniteurs précoces. Les cellules SSEA-1+ (qui représentent 40 à 60 % des cellules induites selon les lignées CSEh utilisées) semblent très homogènes : elles ne sont plus pluripotentes malgré la persistance transitoire de l’expression de OCT4 [3], et dans leur grande majorité, elles expriment des transcrits du tube cardiaque primaire du mésoderme précoce. Elles n’expriment aucun marqueur, ni endodermique ni ectodermique, ni aucun marqueur hématopoïétique ou musculaire squelettique dérivant également du mésoderme (Tableau I). Les marques épigénétiques (code histone) associées aux promoteurs de ces gènes cardiogéniques, détectées par ChIP (chromatin immunoprecipitation), confirment leur activation et l’engagement dans cette voie. Qui plus est, le profil des miARN se superpose également avec celui qui est décrit au cours de la cardiogenèse in vivo. Il est donc probable que ces cellules SSEA-1+ correspondent aux progéniteurs cardiogéniques embryonnaires identifiés très tôt dans l’épiblaste. Cela est également confirmé par l’induction de l’expression de marqueurs du champ cardiaque secondaire en présence de FGF8. L’induction d’un tel progéniteur avait été décrite à partir de CSE de souris et humaines par deux équipes indépendantes [
4,
5], mais ces cellules ne pouvaient pas être facilement purifiées.  | Tableau I.
Caractérisation des cellules SSEA-1+ issues de la différenciation de CSEh. FLK1 : fetal liver kinase, autre nom du VGEFR23, récepteur du VEGF (vascular endothelial growth factor) ; TBX : T box ; VG : ventricule gauche ; MESP : mésoderme postérieur ; ISL1 : LIM domain homeobox islet 1.
|
 | Figure 1.
Étapes du protocole expérimental. Les cellules souches embryonnaires suivent les étapes du développement embryonnaire en répondant aux facteurs de croissance pour se différencier en progéniteurs cardiovasculaires. Ces progéniteurs continuent leur différenciation en cellules endothéliales, musculaires lisses et cardiaques in vitro et en cardiomyocytes matures in vivo.
|
En accord avec ce caractère mésodermique précoce, ces progéniteurs SSEA-1+ sont effectivement multipotents et produisent plusieurs dérivés mésodermiques selon les combinaisons de cytokines utilisées : en effet, 80 % des cellules SSEA-1+ se différencient non seulement en cardiomyocytes (détectés après 2-3 semaines de culture) exprimant l’actinine organisée en unités sarcomériques caractéristiques, mais aussi en cellules endothéliales et en cellules musculaires lisses (ces dernières sont les premières cellules à apparaître après une semaine) (Figure 1). L’analyse du comportement de multiples cellules uniques confirme cette multipotence et exclut qu’il s’agisse de la coexistence dans la population SSEA-1+ de plusieurs populations de progéniteurs dont chacune aurait une spécificité propre. L’analyse clonale confirme aussi le potentiel de prolifération important de la majorité des progéniteurs. |
Pour faire un bon cardiomocyte… Il reste deux obstacles à franchir : démontrer la fonctionnalité des cardiomyocytes différenciés in vitro et in vivo après l’examen de passage final que constitue leur transplantation dans un modèle préclinique pertinent. Pour qu’un greffon cellulaire soit efficace, il est nécessaire que les cellules une fois greffées (mais comment les greffer est une autre histoire qui requiert tout l’art du chirurgien et qu’il faudra raconter !) non seulement ne meurent pas, mais prolifèrent et se différencient efficacement dans un environnement souvent hétérogène et fibrotique, et que les cardiomyocytes différenciés se comportent fonctionnellement comme des cellules adultes alors même qu’ils sont issus de CS embryonnaires. Rappelons que le myocarde est un muscle strié composé de myocytes interconnectés en un réseau tridimensionnel et qu’il se contracte de façon involontaire et rythmique. Le sarcomère constitue l’unité de base des myofibrilles et est responsable de la striation transversale observée en microscopie optique. Michel Pucéat et Philippe Menasché ont précédemment exploré l’efficacité de précurseurs cardiaques dérivés de cellules ES murines dans un modèle d’infarctus chez le rat [
6] et le mouton [
7], dans un essai de phase I évaluant la tolérance immunologique et la tumorigénicité. Le modèle ici est celui du singe Rhésus : des progéniteurs SSEA-1+ ont d’abord été induits in vitro à partir de CSE de primates (Rhésus)2, puis cultivés dans une « niche » tissulaire spécifique, en présence de cellules musculaires atriales et/ ou de fibroblastes cardiaques. Leur devenir a été suivi grâce à l’allumage du promoteur de lαa-actine cardiaque. Lorsqu’elles sont cultivées en présence à la fois de fibroblastes cardiaques et de myocytes, mélange destiné à simuler l’environnement de la zone infarcie in vivo, et donc apportant les interactions paracrines appropriées pour leur différenciation, près de 70 % à 80 % des cellules SSEA-1+ se différencient en cardiomyocytes matures qui s’alignent et expriment une organisation protéique sarcomérique de type adulte caractéristique (la taille des sarcomères correspond à une cellule adulte) et elles progressent jusqu’à acquérir un phénotype de myocytes ventriculaires typiques exprimant l’isoforme ventriculaire de la connexine 43, la chaîne légère de la myosine ventriculaire et l’isoforme de la chaîne lourde bêta de la myosine. L’importance du rôle additif des fibroblastes et des myocytes démontrée in vitro indique donc qu’in vivo, pour bénéficier de l’effet paracrine de ces deux populations, il faudra greffer les cellules en bordure de la zone infarcie, là où persistent des fibres cardiaques encore fonctionnelles. |
« Après bien du travail le Coche arrive au haut » Ces résultats ont donc guidé l’essai in vivo chez le singe Rhésus, chez lequel on a créé un infarctus (par occlusion/reperfusion coronaire) : les cellules ES de Rhésus - qui se comportent comme les cellules ES humaines pour leur cinétique de différenciation cardiogénique et l’expression des marqueurs correspondants - ont été traitées 2 jours par le BMP2, puis injectées par voie thoracique dans la zone infarcie 2 semaines après l’occlusion. Vingt millions de cellules SSEA-1+ ont été injectées chez 5 singes (3 autres ont été utilisés comme contrôles et ont reçu une injection de milieu seul), soumis à un traitement immunosuppresseur. L’examen du greffon 2 mois plus tard révèle que 20 % de la zone infarcie ont été colonisés par les cellules greffées qui se sont différenciées en cardiomyocytes arborant un phénotype de cellules ventriculaires adultes : elles expriment MLC2 (myosin light chain) et MLCk (myosin light chain kinase), la Cx43 et un assemblage caractéristique de structures sarcomériques. Reste à analyser le couplage électrique avec les cellules voisines, ainsi que la possible production de structures vasculaires par les cellules SSEA-1+ qui ne sont pas reconnaissables dans ce système de greffe allogénique. Aucun tératome n’a été observé après greffe de cellules SSEA-1+, contrairement aux microtératomes détectés lors des expériences antérieures utilisant des cellules non triées. L’absence de tératome a été confirmée lors de l’injection intracardiaque de ces cellules à des souris immunodéficientes. |
En route vers l’essai clinique Quelle sera l’étape suivante ? Un essai clinique mettant en place le scénario que les auteurs qualifiaient eux-mêmes avec prudence de « science fiction » il n’y a pas si longtemps ? L’étape suivante, déjà en cours, est la préparation d’un essai clinique pilote s’adressant à un petit nombre de patients souffrant d’insuffisance cardiaque sévère. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
L’auteur remercie Michel Pucéat et Philippe Menasché pour leur relecture de cet article.
|
Footnotes |
1. Blin G, Nury D, Stefanovic S, et al. A purified population of multipotent cardiovascular progenitors derived from primate pluripotent stem cells engrafts in postmyocardial infarcted nonhuman primates. J Clin Invest 2010 (online). 2. Brand T. Heart development: molecular insights into cardiac specification and early morphogenesis. Dev Biol 2003; 258 : 1–19. 3. Murry CE, Keller G. Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development. Cell 2008; 132 : 661–804. 4. Moretti A, Caron L, Nakano A, et al. Multipotent embryonic isl1+ progenitor cells lead to cardiac, smooth muscle, and endothelial cell diversification. Cell 2006; 127 : 1151–65. 5. Kattman SJ, Adler ED, Keller GM. Specification of multipotential cardiovascular progenitor cells during embryonic stem cell differentiation and embryonic development.Trends Cardiovasc Med 2007; 17 : 240–66. 6. Pucéat M. Les cellules souches embryonnaires : du développement myocardique à la médecine régénératrice. Med Sci (Paris) 2005; 21 : 1076–82. 7. Ménard C, Hagège AA, Agbulut O, et al. Transplantation of cardiac-committed mouse embryonic stem cells to infarcted sheep myocardium: a preclinical study. Lancet 2005; 366 : 1005–12. |