| |
| Med Sci (Paris). 2010 April; 26(4): 417–421. Published online 2010 April 15. doi: 10.1051/medsci/2010264417.Effets non osseux de la vitamine D Marie Courbebaisse,1,2* Jean-Claude Souberbielle,3,4 Dominique Prié,3,4 and Éric Thervet4,5* 1Service de néphrologie et dialyses, Hôpital Tenon, AP-HP, 4, rue de la Chine, 75020 Paris, France 2Université Pierre et Marie Curie, Paris, France 3Service d’explorations fonctionnelles, Hôpital Necker-Enfants malades, AP-HP, Paris 4Université Paris Descartes, 149, rue de Sèvres, 75015 Paris, France 5Service de transplantation rénale, Hôpital Necker-Enfants malades, AP-HP |
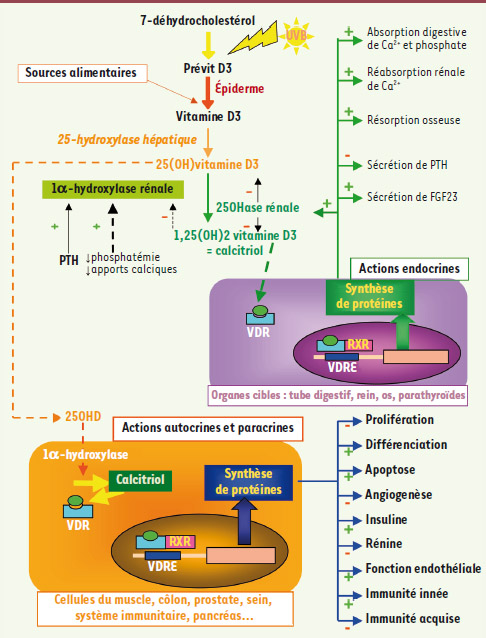
La vitamine D joue un rôle majeur dans la croissance et la minéralisation osseuses. Le terme vitamine est inapproprié pour la vitamine D qui doit être plutôt considérée comme une pro-hormone. La vitamine D3 provient essentiellement de la conversion cutanée du 7-déhydrocholestérol sous l’action des UVB, les sources alimentaires de vitamine D3 (et D2) étant peu nombreuses. La vitamine D subit une 1re hydroxylation sur le carbone 25 sous l’effet de la 25-hydroxylase hépatique. La concentration sérique de 25-hydroxy vitamine D (25OHD) reflète les stocks de l’organisme en vitamine D et se mesure en pratique courante. La 25OHD subit ensuite une 2e hydroxylation sur le carbone 1 sous l’effet de la 1α-hydroxylase et est ainsi convertie en 1,25 dihydroxyvitamine D ou calcitriol, forme active de la vitamine D [
1]. La 1α-hydroxylase est soit rénale, soit exprimée localement dans les tissus autres que le rein (la prostate, le côlon, le sein, le pancréas, les monocytes et les macrophages, etc.). Il est admis que le calcitriol produit par le rein exerce une action endocrine phosphocalcique alors que le calcitriol issu de la conversion locale extrarénale de la 25OHD a des actions autocrines et paracrines induisant des effets non phosphocalciques. Le calcitriol contrôle ainsi plus de 200 gènes régulant entre autres la prolifération et la différenciation cellulaires, l’apoptose, l’angiogenèse, la sécrétion d’insuline et celle de rénine (Figure 1). De ce fait, l’insuffisance en 25OHD peut avoir des conséquences phosphocalciques et osseuses, mais aussi extra-osseuses. De nombreux experts [1,
2] considèrent que l’insuffisance en 25OHD est définie par une concentration sérique inférieure à 30 ng/ml (ou 75 nmol/l), puisqu’en dessous de ce seuil, on observe une élévation de la concentration sérique de parathormone, une diminution de l’absorption digestive de calcium, mais aussi une augmentation du risque de nombreuses pathologies extra-osseuses [2].
 | Figure 1.
Différentes étapes de synthèse du calcitriol, facteurs régulant la 1α-hydroxylase rénale et actions endocrines phosphocalciques et autocrines/paracrines non phosphocalciques du calcitriol. La vitamine D3 provient essentiellement (90 %) de la conversion cutanée du 7-déhydrocholestérol sous l’action des UVB. Les sources alimentaires de vitamine D3 (et D2) sont minoritaires (10 %). La vitamine D3 subit une 1 re hydroxylation sur le carbone 25 sous l’effet de la 25-hydroxylase hépatique (étape non régulée). La 25-hydroxy-vitamine D (25OHD) subit ensuite une 2 e hydroxylation sur le carbone 1 sous l’effet des 1α-hydroxylases (la 1α-hydroxylase rénale et celles exprimées localement dans les tissus autres que le rein) et est ainsi convertie en calcitriol, forme active de la vitamine D [31]. L’activité 1α-hydroxylase rénale est stimulée principalement par la parathormone (PTH), la baisse de la calcitriolémie, de faibles apports alimentaires en calcium ou l’hypophosphatémie. La 24-hydroxylase rénale transforme la 25OHD et le calcitriol en métabolites inactifs, hydroxylés en position 24. Le calcitriol se lie à des récepteurs de la vitamine D (VDR) intra-cellulaires, qui s’associent eux-mêmes à des récepteurs de l’acide rétinoïque RXR. Le complexe calcitriol/VDR/RXR se lie à des éléments de réponse à la vitamine D (VDRE) et module ainsi l’expression de nombreux gènes. Il est admis que le calcitriol produit par le rein a des actions endocrines phosphocalciques. Il s’agit de la stimulation de l’absorption digestive du calcium et du phosphate, de la stimulation de la réabsorption rénale de calcium et de la résorption osseuse, de l’inhibition de la sécrétion de PTH et de la stimulation de la production de fibroblast growth factor 23 (FGF23) [
32]. Le calcitriol issu de la conversion locale extrarénale de la 25OHD a des actions autocrines et paracrines et des effets non phosphocalciques. Il s’agit de l’inhibition de la prolifération cellulaire, de la stimulation de la différenciation cellulaire et de l’apoptose, de l’inhibition de l’angiogenèse, de l’amélioration de la fonction endothéliale, de la stimulation de la sécrétion d’insuline, de l’inhibition de la sécrétion de rénine, de la stimulation de l’immunité innée et de l’inhibition de l’immunité acquise. |
|
Vitamine D et risque de cancers De nombreuses études écologiques ont rapporté que le fait de vivre à des latitudes élevées était associé à un risque accru de développer certains cancers (côlon, prostate, sein, etc.) [1]. Ceci pourrait être expliqué par un défaut de synthèse cutanée de vitamine D3, en raison du faible ensoleillement. Par ailleurs, plusieurs études cas-contrôles ont montré que les adultes dont le taux de 25OHD se situait dans le quantile le plus élevé avaient une diminution de 30 à 50 % du risque de cancers [1] du côlon, du sein, de la prostate et de l’ovaire, par rapport aux sujets ayant un taux de 25OHD dans le quantile le plus bas. Enfin, des études rétrospectives ont suggéré une association entre un taux sérique bas de 25OHD et le risque de décès par cancer [
3]. Cependant, il convient de rester prudent puisqu’une étude rétrospective d’observation a montré que des niveaux élevés de 25OHD pouvaient aussi être associés à un risque accru de cancer de la prostate [
4]. De très nombreuses données expérimentales expliquent le lien entre l’insuffisance en 25OHD et le risque de cancers observé chez l’homme : le calcitriol stimule la différenciation cellulaire et l’apoptose et inhibe la prolifération cellulaire et l’angiogenèse. De plus, la vitamine D stimule l’adhérence et la communication intercellulaires, diminuant ainsi le risque métastatique et renforçant l’inhibition de la prolifération cellulaire résultant d’un contact étroit entre les cellules [
5]. Chez l’homme, les études d’intervention donnent des résultats contradictoires. L’étude WHI (Women’s Health Initiative) a montré une corrélation inverse entre le taux basal de 25OHD et l’incidence de cancer colorectal mais pas de réduction de l’incidence du risque global de cancers dans le groupe traité par rapport au groupe placebo [
6]. Cependant, dans cette étude, l’adhésion au traitement était médiocre et la posologie de vitamine D3 (400 UI/jour) était considérée comme insuffisante par la plupart des experts. Plus récemment, une étude prospective, randomisée contre placebo, incluant 1 180 femmes ménopausées, a pu mettre en évidence une diminution significative du risque global de cancers après 4 ans de suivi dans le groupe traité avec des doses plus fortes de vitamine D3 (1 100 UI/jour) [
7]. Dans cette étude, l’adhésion au traitement était correcte et la concentration sérique de 25OHD a augmenté de 28,8 à 38 ng/ml dans le groupe traité, alors qu’elle est restée stable à 28,8 ng/ml dans le groupe contrôle. |
Vitamine D et diabète de type 2 Chez l’homme, la concentration sérique de 25OHD est inversement corrélée à la prévalence du diabète de type 2, au taux d’hémoglobine glycosylée et à la résistance à l’insuline [
8]. De nombreuses données expérimentales confirment ces études d’observation [8]. Le VDR (vitamin D receptor) et la 1α-hydroxylase sont exprimés dans les cellules β du pancréas, et des VDRE (vitamin D responsive elements) ont été identifiés dans le promoteur du gène humain de l’insuline. Des études in vitro ont montré que le calcitriol stimule la transcription du gène humain de l’insuline, l’expression du récepteur à l’insuline et le transport de glucose. Enfin, la sécrétion d’insuline est altérée chez les souris invalidées pour le VDR, et un traitement par vitamine D3 stimule la sécrétion d’insuline ainsi que la tolérance au glucose chez les rats déficients en vitamine D. Des données récentes suggèrent que le contrôle du gène de l’adiponectine par le calcitriol pourrait expliquer en partie l’influence de la vitamine D sur la résistance à l’insuline [
9]. Enfin, chez les patients, quelques études d’intervention ont rapporté qu’un traitement par vitamine D pouvait avoir des effets positifs sur des paramètres intermédiaires de résistance à l’insuline [
10]. |
Vitamine D et risque cardiovasculaire Des études d’observation ont rapporté une forte association entre une faible concentration sérique de 25OHD et un risque accru d’événements cardiovasculaires majeurs [
11] ou de décès d’origine cardiovasculaire [
12]. Le déficit en 25OHD a aussi été associé à l’artériosclérose et à la dysfonction endothéliale chez les patients dialysés [
13]. Ces observations peuvent s’expliquer à la fois par des effets directs et indirects de la vitamine D sur le système cardiovasculaire. Les effets directs sont liés au fait que les cardiomyocytes, les cellules musculaires lisses vasculaires et les cellules endothéliales expriment à la fois le VDR et la 1α-hydroxylase [
14]. De plus, les gènes dont la transcription est stimulée au cours de l’hypertrophie myocardique (facteur natriurétique atrial par exemple) possèdent des VDRE et sont inhibés par le calcitriol dans des modèles cellulaires ou animaux. Enfin, le calcitriol inhibe la prolifération des cardiomyocytes et module leur contractilité et stimule la prolifération des cellules musculaires lisses vasculaires et l’expression du VEGF (vascular endothelial growth factor) par ces cellules [
15]. Les effets indirects potentiels de la vitamine D sur le risque cardiovasculaire concernent, en plus du contrôle glycémique, la régulation du système rénine-angiotensine (SRA), de l’inflammation, le contrôle de l’hyperparathyroïdie secondaire et d’éléments favorisant les calcifications vasculaires (métalloprotéinases, MMP). Les souris invalidées pour le gène codant pour VDR ou la 1α-hydroxylase présentent une activation du SRA responsable d’une hypertension artérielle et d’une hypertrophie cardiaque [
16]. De plus, le calcitriol inhibe l’activation du SRA, diminue la pression artérielle et l’hypertrophie myocardique chez les souris invalidées pour le gène codant pour la 1α-hydroxylase. Enfin, le calcitriol diminue l’expression de MMP2 et MMP9 [
17], deux MMP favorisant les calcifications vasculaires. Quelques études d’intervention ont mis en évidence un effet bénéfique du traitement par vitamine D sur des paramètres intermédiaires, possiblement reliés aux pathologies cardiovasculaires. Ainsi, chez des patients présentant une insuffisance cardiaque, un essai prospectif randomisé contre placebo a montré une amélioration du profil inflammatoire et de la fonction endothéliale après traitement par vitamine D3 [
18]. Une récente méta-analyse a confirmé une réduction de la pression artérielle chez les patients hypertendus traités et a suggéré que la forme native de la vitamine D permettait un meilleur contrôle de la pression artérielle que celui observé avec les composés actifs (hydroxylés en position 1α, ne requérant pas l’hydroxylation in vivo pour acquérir leur forme pharmacologiquement active) [
19]. Cependant, étant donné que l’intoxication par la vitamine D favorise le risque de calcifications cardiovasculaires, le rapport bénéfice/risque de doses supraphysiologiques de vitamine D sur le risque cardiovasculaire reste à évaluer. |
Globalement, de nombreuses études expérimentales sont en faveur d’une inhibition de l’immunité acquise et d’une stimulation de l’immunité innée par la vitamine D. Le VDR et la 1α-hydroxylase sont exprimés dans les lymphocytes T et B, les macrophages et les cellules présentatrices d’antigènes. Vitamine D et auto-immunité Des études épidémiologiques ont mis en évidence une relation entre une plus grande fréquence de certaines maladies auto-immunes (diabète de type 1, sclérose en plaques, polyarthrite rhumatoïde) et, soit de faibles apports de vitamine D, soit des concentrations basses de 25OHD [ 2]. Ces résultats sont cohérents avec des données expérimentales qui montrent que le calcitriol réduit la prolifération lymphocytaire et la production de certaines cytokines et peut atténuer ou même prévenir différentes maladies auto-immunes dans des modèles murins de sclérose en plaques, de lupus, de polyarthrite rhumatoïde et de diabète de type 1. Le mécanisme de ces effets immunorégulateurs est en partie lié à la stimulation de la synthèse de TGF ( transforming growth factor)-β1 et d’interleukine-4 (IL4) et nécessite la présence de calcium [
20]. Vitamine D et rejet d’allogreffe Dans des études rétrospectives cas-contrôles, il a été montré que les patients ayant subi une transplantation rénale et ostéoporotiques traités par calcitriol présentaient moins d’épisodes de rejets aigus [
21]. Des données expérimentales vont dans le sens de ces observations : le calcitriol inhibe l’expression d’IL-2 et d’interféron-γ par les cellules T et atténue la prolifération des lymphocytes T CD4 et CD8, ainsi que la cytotoxicité de ces cellules [20]. Le calcitriol inhibe également la différenciation plasmocytaire, la prolifération des lymphocytes B, la production d’immunoglobulines, ainsi que la différenciation, la maturation et les capacités de stimulation immunitaire des cellules dendritiques. De plus, le calcitriol diminue la synthèse d’IL12 et stimule en parallèle la synthèse d’IL10. La résultante de ces effets est une diminution de la réponse cellulaire Th1 et une induction de cellules T régulatrices. Les capacités immunomodulatrices du calcitriol observées in vitro ont été confirmées dans plusieurs modèles animaux de transplantation (cardiaque, hépatique, pancréatique). Vitamine D et infections Concernant l’immunité innée, il a été mis en évidence que l’insuffisance en 25OHD était associée au risque d’infection par Mycobacterium tuberculosis ou d’infection des voies aériennes supérieures chez l’homme. On sait maintenant que les macrophages ou les monocytes exposés à un agent infectieux comme Mycobacterium tuberculosis, surexpriment le Toll-like receptor 2, le VDR et la 1α-hydroxylase. À condition que la concentration de 25OHD dans le liquide extracellulaire soit suffisante, les macrophages vont produire du calcitriol qui va induire la synthèse de cathélicidine, un antibiotique naturel qui détruit l’agent infectieux [
22]. Il n’existe pas d’étude d’intervention montrant une diminution du risque d’infection par Mycobacterium tuberculosis chez les patients traités par vitamine D. En revanche, un essai prospectif randomisé contre placebo a montré une réduction du risque d’infection par le virus de la grippe dans le groupe traité par vitamine D3 [
23]. D’autres essais rigoureux sont bien sûr nécessaires pour conforter ce résultat. |
Effets néphroprotecteurs de la vitamine D Des études d’observation ont rapporté un effet néphroprotecteur et antiprotéinurique du calcitriol et de ses analogues [
24] ainsi qu’une corrélation inverse entre le taux de 25OHD et l’albuminurie ou la vitesse de progression vers la dialyse [
25]. Les données expérimentales en faveur de l’effet néphroprotecteur de la vitamine D sont les suivantes [24]. Comme mentionné ci-dessus, le calcitriol inhibe le SRA et la voie d’activation de NF-κB [
26], qui participent à la fibrose rénale. Dans des modèles animaux de maladie rénale chronique, les analogues de la vitamine D atténuent la fibrose tubulo-interstitielle et glomérulaire, réduisent le débit de protéinurie, la production de matrice extracellulaire, les marqueurs de transition épithélio-mésenchymateuse et la voie du TGF-β [24]. Une étude récente, randomisée contre placebo, incluant des patients avec une insuffisance rénale chronique, a montré qu’un traitement par paricalcitol (analogue du calcitriol limitant l’augmentation de la calcémie et de la phosphatémie) diminuait l’albuminurie et les marqueurs de l’inflammation par comparaison au placebo, ceci indépendamment de ses effets hémodynamiques et sur la parathormone [
27]. |
Vitamine D et fonction musculaire Il est bien connu que le rachitisme/ostéomalacie s’accompagne de douleurs et de faiblesse musculaires. Plusieurs études d’observation ont retrouvé une association très significative entre des concentrations sériques basses de 25OHD et une sarcopénie1 [
28]. La 25OHD basse pourrait n’être qu’un marqueur d’un mauvais état général. Cependant, plusieurs études d’intervention ont montré qu’un traitement par vitamine D améliorait les performances musculaires des sujets âgés carencés et réduisait le risque relatif de chutes (ce qui explique en partie la diminution du risque de fractures périphériques) [
29]. Cet effet bénéfique de la vitamine D pourrait être lié d’une part à un effet direct sur la taille des fibres musculaires de type 2, et d’autre part à une activation de la protéine kinase C qui favorise l’augmentation du pool calcique intracellulaire nécessaire à la contraction musculaire [2]. |
La vitamine D ne peut plus être considérée comme étant uniquement nécessaire à la prévention du rachitisme/ostéomalacie puisque de très nombreuses données épidémiologiques et expérimentales sont en faveur de son rôle protecteur contre de nombreuses affections extra-osseuses. Quelques études d’intervention confirmant certains de ces effets et une méta-analyse récente de 18 essais randomisés a permis de conclure à une diminution du risque de mortalité chez les sujets ayant un apport régulier de vitamine D [
30]. La correction d’une insuffisance en 25OHD et le maintien d’un taux de 25OHD au dessus de 30 ng/ml au moins sont justifiés par l’ensemble de ces données. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Holick MF. Vitamin D deficiency. N Engl J Med 2007; 357 : 266–81. 2. Souberbielle JC, Prie D, Courbebaisse M, et al. Update on vitamin D and evaluation of vitamin D status. Ann Endocrinol (Paris) 2008; 69 : 501–10. 3. Tretli S, Hernes E, Berg JP, et al. Association between serum 25(OH)D and death from prostate cancer. Br J Cancer 2009; 100 : 450–4. 4. Tuohimaa P, Tenkanen L, Ahonen M, et al. Both high and low levels of blood vitamin D are associated with a higher prostate cancer risk : a longitudinal, nested case-control study in the Nordic countries. Int J Cancer 2004; 108 : 104–8. 5. Fleet JC. Molecular actions of vitamin D contributing to cancer prevention. Mol Aspects Med 2008; 29 : 388–96. 6. Wactawski-Wende J, Kotchen JM, Anderson GL, et al. Calcium plus vitamin D supplementation and the risk of colorectal cancer. N Engl J Med 2006; 354 : 684–96. 7. Lappe JM, Travers-Gustafson D, Davies KM, et al. Vitamin D and calcium supplementation reduces cancer risk : results of a randomized trial. Am J Clin Nutr 2007; 85 : 1586–91. 8. Pittas AG, Lau J, Hu FB, Dawson-Hughes B. The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis. J Clin Endocrinol Metab 2007; 92 : 2017–29. 9. Sun X, Zemel MB. Calcium and 1,25-dihydroxyvitamin D3 regulation of adipokine expression. Obesity 2007; 15 : 340–8. 10. Nagpal J, Pande JN, Bhartia A. A double-blind, randomized, placebo-controlled trial of the short-term effect of vitamin D3 supplementation on insulin sensitivity in apparently healthy, middle-aged, centrally obese men. Diabet Med 2009; 26 : 19–27. 11. Wang TJ, Pencina MJ, Booth SL, et al. Vitamin D deficiency and risk of cardiovascular disease. Circulation 2008; 117 : 503–11. 12. Pilz S, Marz W, Wellnitz B, et al. Association of vitamin D deficiency with heart failure and sudden cardiac death in a large cross-sectional study of patients referred for coronary angiography. J Clin Endocrinol Metab 2008; 93 : 3927–35. 13. London GM, Guerin AP, Verbeke FH, et al. Mineral metabolism and arterial functions in end-stage renal disease : potential role of 25-hydroxyvitamin D deficiency. J Am Soc Nephrol 2007; 18 : 613–20. 14. Zittermann A, Schleithoff SS, Koerfer R. Putting cardiovascular disease and vitamin D insufficiency into perspective. Br J Nutr 2005; 94 : 483–92. 15. Cardus A, Parisi E, Gallego C, et al. 1,25-Dihydroxyvitamin D3 stimulates vascular smooth muscle cell proliferation through a VEGF-mediated pathway. Kidney Int 2006; 69 : 1377–84. 16. Bouillon R, Carmeliet G, Verlinden L, et al. Vitamin D and human health : lessons from vitamin D receptor null mice. Endocr Rev 2008; 29 : 726–76. 17. Nakagawa K, Sasaki Y, Kato S, et al. 22-Oxa-1alpha, 25-dihydroxyvitamin D3 inhibits metastasis and angiogenesis in lung cancer. Carcinogenesis 2005; 26 : 1044–54. 18. Tarcin O, Yavuz DG, Ozben B, et al. Effect of vitamin D deficiency and replacement on endothelial function in asymptomatic subjects. J Clin Endocrinol Metab 2009; 94 : 4023–30. 19. Witham MD, Nadir MA, Struthers AD. Effect of vitamin D on blood pressure’ a systematic review and meta-analysis. J Hypertens 2009; 27 : 1948–54. 20. Mora JR, Iwata M, von Andrian UH. Vitamin effects on the immune system : vitamins A and D take centre stage. Nat Rev Immunol 2010 (sous presse). 21. Tanaci N, Karakose H, Guvener N, et al. Influence of 1,25-dihydroxyvitamin D3 as an immunomodulator in renal transplant recipients : a retrospective cohort study. Transplant Proc 2003; 35 : 2885–7. 22. Liu PT, Stenger S, Li H, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science 2006; 311 : 1770–3. 23. Aloia JF, Li-Ng M. Re : epidemic influenza and vitamin D. Epidemiol Infect 2007; 135 : 1095–6. 24. Li YC. Renoprotective effects of vitamin D analogs. Kidney Int 2010 (sous presse). 25. Ravani P, Malberti F, Tripepi G, et al. Vitamin D levels and patient outcome in chronic kidney disease. Kidney Int 2009; 75 : 88–95. 26. Sun J, Kong J, Duan Y, et al. Increased NF-kappaB activity in fibroblasts lacking the vitamin D receptor. Am J Physiol Endocrinol Metab 2006; 291 : E315–22. 27. Alborzi P, Patel NA, Peterson C, et al. Paricalcitol reduces albuminuria and inflammation in chronic kidney disease : a randomized double-blind pilot trial. Hypertension 2008; 52 : 249–55. 28. Visser M, Deeg DJ, Lips P. Low vitamin D and high parathyroid hormone levels as determinants of loss of muscle strength and muscle mass (sarcopenia) : the longitudinal aging study Amsterdam. J Clin Endocrinol Metab 2003; 88 : 5766–72. 29. Bischoff-Ferrari HA, Willett WC, et al. Fracture prevention with vitamin D supplementation : a meta-analysis of randomized controlled trials. JAMA 2005; 293 : 2257–64. 30. Autier P, Gandini S. Vitamin D supplementation and total mortality : a meta-analysis of randomized controlled trials. Arch Intern Med 2007; 167 : 1730–7. 31. Tissandié E, Guéguen Y, Lobaccaro JM, et al. Vitamine D : métabolisme, régulation et maladies associées. Med Sci (Paris) 2006; 22 : 1095–100. 32. Prié D, Ureña Torres P, Friedlander G. Le facteur de croissance des fibroblastes 23 et son récepteur Klotho : un nouvel axe de régulation du bilan du phosphate. Med Sci (Paris) 2009; 25 : 489–95. |