| |
| Med Sci (Paris). 2010 April; 26(4): 391–396. Published online 2010 April 15. doi: 10.1051/medsci/2010264391.Leucémies T induites par HTLV-1 Y a-t-il un avant et un après HBZ ? Madeleine Duc Dodon,1,2,3 Benoît Barbeau,4 and Jean-Michel Mesnard5,6* 1Virologie Humaine, Inserm U758, 69364, Lyon Cedex 07, France 2École Normale Supérieure de Lyon, 69364, Lyon Cedex 07,
France 3IFR128, Biosciences Lyon-Gerland, 69364, Lyon Cedex 07, France 4Département des sciences biologiques et Centre de recherche BioMed, Université du Québec, Montréal, Canada 5Université Montpellier 1, Centre d’études d’agents pathogènes et biotechnologies pour la santé (CPBS), 4, boulevard Henri IV, 34965 Montpellier Cedex 2, France 6CNRS UM5236, Montpellier, Université Montpellier 2, CPBS, Montpellier, France |
Pathologies associées à l’infection par HTLV-1 HTLV-1 (human T-cell leukemia virus type 1) est le premier rétrovirus humain à avoir été isolé en 1980, à partir de lymphocytes T d’un patient ayant un lymphome cutané. On estime que 15 à 20 millions de personnes sont infectées par ce virus, avec des zones de forte endémie comme les Caraïbes, la Mélanésie, le sud du Japon, certaines régions de l’Afrique intertropicale (Gabon et Cameroun) et de l’Amérique du Sud (Brésil, Guyane, Colombie). Seul un individu infecté sur dix va développer une pathologie lors d’une infection par HTLV-1. Deux syndromes majeurs sont associés à cette infection : la leucémie à cellules T de l’adulte ou ATL (adult T-cell leukemia) et la paraparésie spastique tropicale ou la myélopathie associée à HTLV-1 ou TSP/HAM1,. Il semblerait que HTLV-1 puisse être aussi associé à des syndromes inflammatoires tels que des uvéites, pneumopathies, arthrites, polymyosites et un syndrome de Sjögren2. La contamination par voie sanguine ou sexuelle est plus spécifiquement associée à la TSP/HAM qui se développe de un mois à quatre ans après l’infection. En revanche, l’ATL ne se développera que 30 à 50 ans après la primo-infection, cette dernière survenant généralement lors de l’allaitement du nouveau-né par sa mère infectée.
-
La TSP/HAM est une maladie neurologique [
1] due à un processus inflammatoire chronique de la substance blanche et de la substance grise de la moelle épinière, localisé principalement au niveau thoracique. Elle se caractérise par le développement de paralysies spastiques3 des membres inférieurs et de déficits sensoriels divers, conséquence des lésions d’inflammation et de démyélinisation. Cependant, les mécanismes exacts responsables de cette démyélinisation restent encore hypothétiques.
-
L’ATL se caractérise par l’apparition de cellules T leucémiques ayant un noyau polylobé en forme de fleur [
31]. Ces cellules expriment les marqueurs lymphocytaires CD2, CD3, CD4, CD5, CD45RO4,. De rares cellules peuvent exprimer le marqueur CD8. On retrouve le plus souvent à leur surface les marqueurs d’activation comme HLA-DR, HLA-DQ et surtout la chaîne alpha du récepteur de l’interleukine 2 (CD25). Quatre formes cliniques peuvent se succéder au cours du développement de l’ATL. Dans la forme chronique, les signes cliniques sont peu sévères. La forme subaiguë dite smouldering (rampante) se caractérise par des lésions cutanées et un faible nombre de cellules leucémiques circulantes. Ce nombre augmente considérablement dans la forme aiguë qui est associée à une lymphoadénopathie, une hépatomégalie, une splénomégalie, des lésions cutanées dues à l’infiltration de cellules tumorales, et dans certains cas une hypercalcémie. Enfin, la forme lymphomateuse se différencie de la forme leucémique par la présence des cellules transformées au niveau des organes lymphoïdes et non pas dans la moelle osseuse. Au Japon, chaque année, 700 nouveaux cas d’ATL sont diagnostiqués. La médiane de survie pour les formes aiguës est de 6 mois, les traitements par chimiothérapie se révélant peu efficaces puisqu’ils permettent d’atteindre une médiane de survie de deux ans. Cependant, des traitements associant la zidovudine5 et l’interféron alpha ont donné des résultats encourageants et permis de prolonger la survie de malades ayant développé une ATL [
2].
|
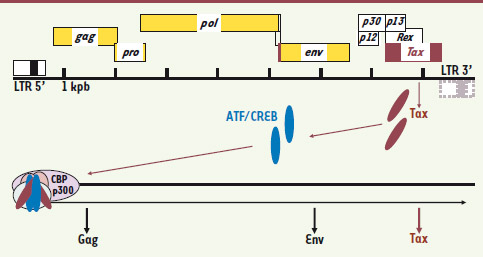
La protéine virale Tax n’explique pas tout L’ATL se caractérise par une prolifération cellulaire monoclonale dont le critère de diagnostic est la présence de l’ADN proviral intégré au même site dans le génome cellulaire, suggérant fortement l’implication du virus dans le développement de la maladie. Comme l’ADN proviral n’est pas intégré à proximité d’un proto-oncogène ou d’un gène suppresseur de tumeur, et que le virus ne code pas pour un oncogène viral, l’implication dans la transformation de la cellule infectée d’une protéine virale spécifique au HTLV-1 a été suggérée. Comme tous les rétrovirus, HTLV-1 possède les gènes Gag, Pro, Pol et Env qui codent pour des protéines indispensables à la formation de particules virales infectieuses (Figure 1). Mais HTLV-1 est un rétrovirus complexe, c’est-à-dire capable de coder pour des protéines régulatrices (Tax et Rex) et des protéines auxiliaires p12I, p13II, et p30II. Parmi ces différentes protéines, la protéine Tax est impliquée dans la trans-activation de la transcription virale à partir du promoteur situé dans le LTR 5’ (long terminal repeat). Tax n’est pas capable de se fixer directement sur le promoteur viral mais elle peut interagir avec des facteurs transcriptionnels à domaine bZIP de la famille ATF/CREB, capables de se fixer sur des boîtes CRE présentes dans le domaine U3 du LTR 5’ (Figure 1). Une fois positionnée sur le promoteur viral, Tax recrute des histones acétyltransférases telles que CBP et p300 qui vont induire un changement dans la structure de la chromatine favorisant ainsi la stimulation de la transcription. Tax stimule donc sa propre expression mais aussi par la suite l’expression des autres protéines virales telles que Gag et Env qui codent pour les protéines de structure de la particule virale (Figure 1). Cette production de protéines virales induit l’apparition d’anticorps dirigés contre Gag, Env puis Tax lors des premiers temps de l’infection [
3]. Les cellules infectées sont aussi la cible d’une forte réponse immune cellulaire cytotoxique anti-Tax. Ainsi, l’expression de Tax devient très rapidement un désavantage pour la cellule infectée qui sera rapidement éliminée par le système immunitaire.
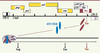 | Figure 1.
Organisation génomique de l’ADN proviral de HTLV-1. En plus des gènes communs à tous les rétrovirus (en jaune), l’ADN proviral code pour des protéines auxiliaires ou régulatrices (en noir). Parmi ces dernières, la protéine Tax (en rouge foncé) est impliquée dans la stimulation de la transcription virale. Tax, en interagissant avec des facteurs transcriptionnels cellulaires de la famille ATF/CREB, se positionne sur le promoteur viral du 5’ LTR et y recrute les cofacteurs transcriptionnels CBP/p300. |
Tax est aussi impliquée dans la prolifération de la cellule infectée. Ainsi, Tax est capable d’immortaliser des lymphocytes T in vitro et de provoquer la formation de tumeurs chez des souris transgéniques. Ses propriétés transformantes s’expliquent par sa capacité à activer différents facteurs de transcription tels qu’AP-1, E2F, NF-κB et SRF qui sont impliqués dans la régulation de gènes cellulaires contrôlant la prolifération et la mort cellulaires [
4,
5]. Tax est aussi capable d’interagir via son domaine PBM avec des suppresseurs de tumeurs à domaines PDZ tels que hDlg et hScrib [
6]. Enfin, Tax jouerait aussi sur l’instabilité du génome de la cellule infectée et sur la diminution de l’expression de la télomérase dans les phases précoces de l’infection [5,
7]. Cependant, l’expression de Tax n’est détectée que dans 40 % des cas d’ATL [
8]. Cette absence de Tax s’explique par une extinction progressive de l’activité du promoteur viral (due à des modifications épigénétiques ou à une délétion du LTR 5’) lorsque la cellule infectée évolue en cellule leucémique. Il semblerait donc que Tax soit plutôt présente lors des étapes préleucémiques. En outre, un contrôle pointu de l’expression de Tax semble nécessaire pour éviter que la cellule infectée ne soit éliminée par le système immunitaire de l’individu infecté. |
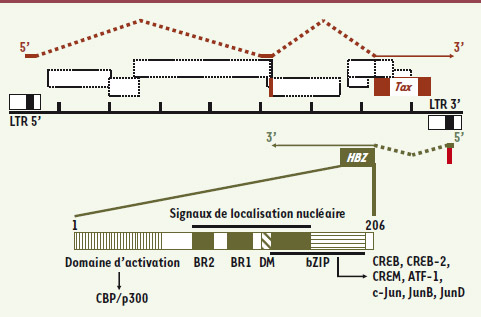
Transcription antisens de HBZ C’est en 2002, soit près de 20 ans après le séquençage complet de l’ADN proviral, que nous avons été les premiers à identifier, dans des lignées cellulaires infectées par HTLV-1, une nouvelle protéine virale, appelée HBZ [
9]. L’existence probable de cette protéine avait été pourtant suggérée dès 1989 [
10], mais son expression nécessitait la production d’ARNm à partir du LTR 3’, c’est-à-dire une transcription allant dans le sens opposé à celle permettant l’expression de tous les autres transcrits viraux (Figure 2). Or, les rétrovirologistes avaient exclu assez rapidement la possibilité pour un ADN proviral de produire des protéines à partir d’ARN messagers synthétisés par une telle transcription dite antisens. Nos résultats prouvaient le contraire. Depuis, nous avons pu montrer avec d’autres que HBZ est produite majoritairement dans les cellules infectées à partir d’un transcrit épissé [
11–
13]. Il est intéressant de noter que vu leur structure primaire (Figure 2), les ARNm de Tax et HBZ ne sont quasiment pas complémentaires, ce qui exclut qu’ils aient un effet antisens l’un sur l’autre. Ceci suggérait fortement que les deux transcrits peuvent être exprimés à un même moment du cycle viral, ce qui a été confirmé par la suite [
14].
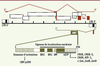 | Figure 2.
Expression de la protéine virale HBZ. HBZ (en vert) est traduite à partir d’un ARNm épissé produit à partir d’un promoteur localisé dans le LTR 3’. Les transcrits épissés produisant Tax (en rouge) et HBZ sont représentés respectivement au-dessus et au-dessous du provirus. HBZ est un facteur de transcription de 206 acides aminés de long possédant un domaine d’activation en amino-terminal et un domaine bZIP en carboxy-terminal précédé d’un domaine de modulation transcriptionnel (DM). La partie centrale de HBZ contient trois domaines basiques (boîtes vertes) impliqués dans la localisation nucléaire de la protéine. Le domaine bZIP est impliqué dans l’interaction de HBZ avec CREB, CREB-2, CREM, ATF-1, c-Jun, JunB ou JunD. |
HBZ déjoue le contrôle immunitaire Bien que différentes isoformes de HBZ aient été décrites, seules la structure et les propriétés de l’isoforme de 206 acides aminés traduite à partir du transcrit épissé majoritaire (Figure 2) seront détaillées dans cette revue. Comme son nom l’indique, HBZ possède un domaine bZIP, situé dans sa partie carboxy-terminale (Figure 2), ainsi qu’un domaine d’activation transcriptionnelle dans sa région amino-terminale, les deux domaines étant séparés par une partie centrale riche en acides aminés basiques impliqués dans sa localisation nucléaire [
15,
16]. Toutes ces caractéristiques font que HBZ peut être considéré comme un facteur de transcription de la famille des protéines à domaine bZIP. Cette famille comprend des facteurs de transcription capables de s’homodimériser ou de s’hétérodimériser via leur domaine ZIP. Alors que HBZ est incapable de s’homodimériser, il peut former in vivo des dimères avec des membres de la famille ATF/CREB et Jun (Figure 2) [ 9,
17–
21]. En outre, grâce à son domaine d’activation, HBZ interagit aussi avec les cofacteurs transcriptionnels CBP/p300 [
22]. Il est frappant de constater que HBZ cible les facteurs nucléaires qui sont impliqués dans le contrôle de la transcription virale Tax-dépendante (Figure 1). En fait, nous avons pu démontrer que HBZ régule négativement la transcription des autres gènes viraux en inhibant l’association de Tax avec CREB sur le promoteur du LTR 5’ et en empêchant le recrutement de CBP/p300 sur ce même promoteur (Figure 3) [ 21, 22].
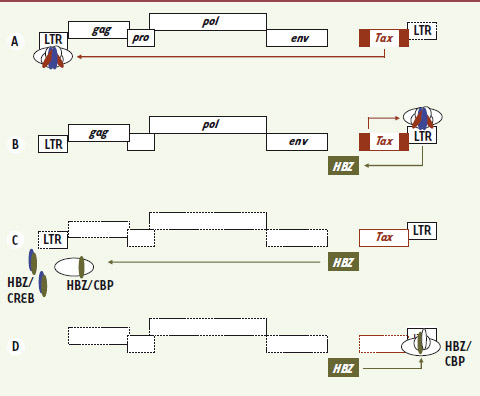
 | Figure 3.
Modèle de la régulation de l’expression des gènes rétroviraux à partir des deux LTR. Seuls les gènes impliqués dans le modèle sont représentés sur le schéma. A. Tax permet l’activation transcriptionnelle à partir du LTR 5’, impliquée dans l’expression de Tax et des autres gènes viraux permettant la production de particules virales infectieuses. B. L’expression des protéines virales entraîne l’élimination de la cellule infectée par la réponse immunitaire. Tax pourrait alors stimuler l’expression de HBZ à partir du LTR 3’.C. La protéine HBZ ainsi produite régulerait négativement l’expression de Tax en bloquant les facteurs et cofacteurs cellulaires impliqués dans la stimulation de la transcription virale Tax-dépendante. D. Au fur à mesure de l’établissement de l’infection, l’expression à partir du LTR 5’ pourrait s’éteindre au dépend de celle à partir du LTR 3’. HBZ pourrait être impliquée dans le contrôle de la transcription à partir du LTR 3’ grâce à sa capacité à activer JunD. |
Nous proposons le modèle suivant pour la fonction de HBZ (Figure 3) : lors des étapes précoces de l’infection, la production des protéines virales à partir du promoteur situé dans le LTR 5’ permet la formation de virions infectieux, favorisant ainsi la propagation virale chez l’individu infecté (Figure 3A). Cependant, l’apparition d’une réponse immunitaire dirigée plus particulièrement contre Gag, Env et Tax va entraîner l’élimination des cellules infectées. L’expression de HBZ à partir du LTR 3’ permettrait de contrôler négativement l’expression des protéines Gag, Env et Tax favorisant ainsi l’échappement de cellules infectées à la réponse immunitaire de l’hôte (Figure 3C). Il est intéressant de noter que Tax est capable de stimuler la transcription à partir du promoteur du LTR 3’ via la voie ATF/CREB [
23,
24]. On peut donc supposer qu’une forte expression de Tax déclencherait l’expression de HBZ (Figure 3B). En outre, le site d’intégration de l’ADN proviral joue aussi sur l’activité du promoteur du LTR 3’ et donc probablement sur la production de HBZ [24]. Ainsi le taux d’expression de HBZ dans une cellule infectée pourrait déterminer la survie ou non de cette cellule dans l’organisme infecté. Alors qu’une faible expression de HBZ entraînerait l’élimination de cette cellule par le système immunitaire, une forte expression permettrait de contrôler l’expression de Tax dont la présence est nécessaire à la prolifération de la cellule infectée. Les expériences réalisées in vivo vont dans ce sens. En effet, Arnold et al. [
25] ont démontré que des lapins inoculés avec un virus n’exprimant plus HBZ présentent une charge provirale plus faible, confirmant que la présence de HBZ favorise l’établissement de l’infection dans l’organisme. En outre, cette même équipe a récemment montré que l’expression de l’ARNm de HBZ chez les lapins infectés augmente progessivement pour finalement se stabiliser huit semaines après l’infection à des taux correspondant à huit fois ceux des ARNm de Tax [
26]. Ces derniers, comme les transcrits Gag, sont fortement exprimés au début de l’infection mais chutent progressivement, leur quantité étant inversement proportionnelle à la charge provirale et à la réponse immunitaire. Enfin, chez les patients infectés naturellement par HTLV-1, on trouve une expression significative de HBZ alors que les ARNm de Tax sont quasiment indétectables [
27]. En outre, il est possible que la répression du promoteur du LTR 5’ puisse favoriser l’expression du LTR 3’ [11] (Figure 3D). Paradoxalement, aucune réponse anti-HBZ n’a été pour l’instant décrite chez les patients infectés. Il semblerait que HBZ puisse échapper à la réponse cytotoxique par un mécanisme pour le moment totalement inconnu [
28]. |
HBZ et la prolifération cellulaire Ce sont les expériences réalisées par Satou et al. [13] qui les premières ont établi la responsabilité d’HBZ dans la prolifération cellulaire. En effet, la transduction dans des cellules leucémiques d’ATL de petits ARN interférants qui diminuent l’expression des ARNm de HBZ est suivie d’un ralentissement de leur prolifération [13]. De même, l’inhibition de l’expression du gène HBZ dans des lignées cellulaires T infectées par HTLV-1 diminue non seulement leur prolifération mais aussi leur capacité à développer des tumeurs solides dans des souris NOG6 [
29]. À l’inverse, des lymphocytes T humains, dépendants pour leur prolifération de l’ajout d’interleukine-2, survivent en l’absence de cette cytokine lorsqu’on y surexprime HBZ, et une proportion plus importante est en phase S du cycle cellulaire [13]. De manière surprenante, HBZ conserve sa capacité à augmenter la prolifération cellulaire lorsqu’il est exprimé par un vecteur porteur d’une mutation empêchant la traduction de la protéine. Ce résultat suggère donc que seul l’ARN favoriserait la prolifération cellulaire. L’analyse par puces à ADN incite à penser que les effets du transcrit de HBZ sur la prolifération cellulaire seraient la conséquence de la stimulation de la transcription du gène E2F1, lui-même responsable de l’activation de l’expression d’une série de gènes cibles [13]. Cependant des expériences récentes indiquent que la protéine HBZ est aussi capable d’activer la transcription de gènes cellulaires. Ainsi nous avons montré que HBZ stimule l’expression du gène hTERT qui code pour la sous-unité catalytique de la télomérase [
30]. C’est par sa capacité à former un hétérodimère avec JunD que HBZ activerait hTERT [
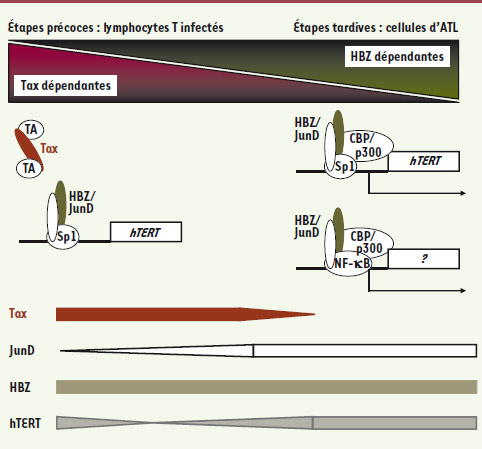
18] : JunD interagirait avec le facteur de transcription Sp1 permettant à HBZ d’être recrutée sur les sites Sp1 présents sur le promoteur proximal de hTERT [30]. Le recrutement ultérieur de CBP/p300 par le domaine activateur de HBZ [22, 30] stimulerait la transcription cellulaire (Figure 4). Cette étude démontrait pour la première fois le rôle direct de la protéine HBZ dans la régulation d’un gène impliqué dans le développement d’un processus tumoral.
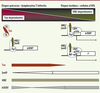 | Figure 4.
Modèle d’établissement de la leucémogenèse : rôle de la balance Tax/HBZ sur l’activation de la télomérase. Au cours des étapes précoces de l’infection des lymphocytes T par HTLV-1, la présence de Tax stimule la prolifération cellulaire en activant les voies NF-kB et AP-1. Au cours de cette phase préleucémique, bien que HBZ soit produite, la présence de Tax inhiberait l’expression de la télomérase en empêchant le recrutement de transactivateurs transcriptionnels (TA) comme CBP/p300 sur le promoteur de hTERT. En revanche, les étapes tardives de la leucémogenèse seraient entièrement dépendantes de HBZ puisqu’une quasi-disparition de Tax dans les cellules d’ATL est observée. À ce stade, l’interaction de HBZ avec JunD permettrait le positionnement de l’hétérodimère HBZ/JunD via Sp1 sur le promoteur de hTERT. Le recrutement de CBP/p300 par le domaine activateur de HBZ stimulerait la transcription de hTERT et ainsi la réactivation de l’activité télomérase. Une activation analogue pourrait être observée sur des gènes régulés par NF-kB. |
|
Nos résultats suggèrent un modèle dans lequel la régulation de l’expression de hTERT par le couple Tax/HBZ serait impliquée dans l’évolution de la cellule T infectée vers un phénotype malin (Figure 4). Lors des étapes précoces, la présence de Tax diminuerait l’expression de hTERT, mais à une étape ultérieure du processus leucémogène, marquée par l’extinction de l’expression de Tax, HBZ participerait à la réactivation de hTERT. Elle le ferait via son association avec le facteur cellulaire JunD. Ce dernier étant capable d’interagir avec des facteurs de transcription tels que Sp1 ou NF-κB, l’activité des dimères HBZ/JunD dépendrait de ces facteurs qui permettraient leur recrutement sur le promoteur de gènes impliqués dans la prolifération cellulaire, comme par exemple celui de la cycline D1 (M. Duc Dodon, résultats non publiés). Un point important reste cependant à clarifier : les ARN HBZ et la protéine HBZ peuvent-ils agir en synergie dans la régulation de fonctions cellulaires majeures ? Quoiqu’il en soit, ces observations soulignent que HBZ joue un rôle essentiel au cours des phases tardives du processus leucémogène. Désormais, il sera intéressant de déterminer si HBZ, en coopération avec Tax, ne serait pas aussi impliquée au cours des phases initiales de la leucémogenèse.

|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Cooper SA, van der Loeff MS, Taylor GP. The neurology of HTLV-1 infection. Pract Neurol 2009; 9 : 16–26. 2. Mahieux R, Hermine O. In vivo and in vitro treatment of HTLV-1 and HTLV-2 infected cells with arsenic trioxide and interferon-alpha. Leuk Lymphoma 2005; 46 : 347–55. 3. Bangham CR. The immune response to HTLV-1. Curr Opin Immunol 2000; 12 : 397–402. 4. Mesnard JM, Devaux C. Multiple control levels of cell proliferation by human T-cell leukemia virus type 1 Tax protein. Virology 1999; 257 : 277–84. 5. Matsuoka M, Jeang KT. Human T-cell leukaemia virus type 1 (HTLV-1) infectivity and cellular transformation. Nat Rev Cancer 2007; 7 : 270–80. 6. Arpin-Andre C, Mesnard JM. The PDZ domain-binding motif of the human T cell leukemia virus type 1 Tax protein induces mislocalization of the tumor suppressor hScrib in T cells. J Biol Chem 2007; 282 : 33132–41. 7. Gabet AS, Mortreux F, Charneau P, et al. Inactivation of hTERT transcription by Tax. Oncogene 2003; 22 : 3734–41. 8. Taylor GP, Matsuoka M. Natural history of adult T-cell leukemia/lymphoma and approaches to therapy. Oncogene 2005; 24 : 6047–57. 9. Gaudray G, Gachon F, Basbous J, et al. The complementary strand of HTLV-1 RNA genome encodes a bZIP transcription factor that down-regulates the viral transcription. J Virol 2002; 76 : 12813–22. 10. Larocca D, Chao LA, Seto MH, Brunck TK. Human T-cell leukemia virus minus strand transcription in infected T-cells. Biochem Biophys Res Commun 1989; 163 : 1006–13. 11. Cavanagh MH, Landry S, Audet B, et al. HTLV-I antisense transcripts initiating in the 3’LTR are alternatively spliced and polyadenylated. Retrovirology 2006; 3 : 15. 12. Murata K, Hayashibara T, Sugahara K, et al. A novel alternative splicing isoform of human T-cell leukemia virus type 1 bZIP factor (HBZ-SI) targets distinct subnuclear localization. J Virol 2006; 80 : 2495–505. 13. Satou Y, Yasunaga JI, Yoshida M, Matsuoka M. HTLV-I basic leucine zipper factor gene mRNA supports proliferation of adult T cell leukemia cells. Proc Natl Acad Sci USA 2006; 103 : 720–25. 14. Usui T, Yanagihara K, Tsukasaki K, et al. Characteristic expression of HTLV-1 basic zipper factor (HBZ) transcripts in HTLV-1 provirus-positive cells. Retrovirology 2008; 5 : 34. 15. Hivin P, Frédéric M, Arpin-André C, et al. Nuclear localization of HTLV-I bZIP factor (HBZ) is mediated by three distinct motifs. J Cell Sci 2005; 118 : 1355–62. 16. Hivin P, Arpin-André C, Clerc I, et al. A modified version of a Fos-associated cluster in HBZ affects Jun transcriptional potency. Nucleic Acids Res 2006; 34 : 2761–72. 17. Basbous J, Arpin C, Gaudray G, et al. HBZ factor of HTLV-I dimerizes with transcription factors JunB and c-Jun and modulates their transcriptional activity. J Biol Chem 2003; 278 : 43620–27. 18. Thébault S, Basbous J, Hivin P, et al. HBZ interacts with JunD and stimulates its transcriptional activity. FEBS Lett 2004; 562 : 165–70. 19. Matsumoto J, Ohshima T, Isono O, Shimotohno K. HTLV-1 HBZ suppresses AP-1 activity by impairing both the DNA-binding ability and the stability of c-Jun protein. Oncogene 2005; 24 : 1001–10. 20. Hivin P, Basbous J, Raymond F, et al. The HBZ-SP1 isoform of human T-cell leukemia virus type I represses JunB activity by sequestration into nuclear bodies. Retrovirology 2007; 4 : 14. 21. Lemasson I, Lewis MR, Polakowski N, et al. Human T-cell leukemia virus type 1 (HTLV-1) bZIP protein interacts with the cellular transcription factor CREB to inhibit HTLV-1 transcription. J Virol 2007; 81 : 1543–53. 22. Clerc I, Polakowski N, Andre-Arpin C, et al. An interaction between the human T cell leukemia virus type 1 basic leucine zipper factor (HBZ) and the KIX domain of p300/CBP contributes to the down-regulation of tax-dependent viral transcription by HBZ. J Biol Chem 2008; 283 : 23903–13. 23. Yoshida M, Satou Y, Yasunaga J, et al. Transcriptional control of spliced and unspliced HTLV-1 bZIP factor gene. J Virol 2008; 82 : 9359–68. 24. Landry S, Halin M, Vargas A, et al. Upregulation of human T-cell leukemia virus type 1 antisense transcription by the viral tax protein. J Virol 2009; 83 : 2048–54. 25. Arnold J, Yamamoto B, Li M, et al. Enhancement of infectivity and persistence in vivo by HBZ, a natural antisense coded protein of HTLV-1. Blood 2006; 107 : 3976–82. 26. Li M, Kesic M, Yin H, et al. Kinetic analysis of human T-cell leukemia virus type 1 gene expression in cell culture and infected animals. J Virol 2009; 83 : 3788–97. 27. Saito M, Matsuzaki T, Satou Y, et al. In vivo expression of the HBZ gene of HTLV-1 correlates with proviral load, inflammatory markers and disease severity in HTLV-1 associated myelopathy/tropical spastic paraparesis (HAM/TSP). Retrovirology 2009; 6 : 19. 28. Suemori K, Fujiwara H, Ochi T, et al. HBZ is an immunogenic protein but not a target antigen for HTLV-1-specific cytotoxic T lymphocytes. J Gen Virol 2009; 90 : 1806–11. 29. Arnold J, Zimmerman B, Li M, et al. Human T-cell leukemia virus type-1 antisense-encoded gene, Hbz, promotes T-lymphocyte proliferation. Blood 2008; 112 : 3788–97. 30. Kuhlmann AS, Villaudy J, Gazzolo L, et al. HTLV-1 HBZ cooperates with JunD to enhance transcription of the human telomerase reverse transcriptase gene (hTERT). Retrovirology 2007; 4 : 92. 31. Manel N, Kinet S, Kim FJ, et al. GLUT-1 est le récepteur des rétrovirus humains HTLV. Med Sci (Paris) 2004; 20 : 277–9. |