| |
| Med Sci (Paris). 2010 April; 26(4): 371–376. Published online 2010 April 15. doi: 10.1051/medsci/2010264371.Syndrome de Down Nouvelles perspectives thérapeutiques ? Jean Maurice Delabar* Unité de biologie fonctionnelle et adaptative (BFA), EAC CNRS 4413, Université Paris Diderot, 3, rue Marie-Andrée Lagroua-Weill-Hallé, bâtiment Lamarck, 75205 Paris, France |
Les aneuploïdies, qui sont des variations du nombre de copies d’éléments du génome, sont relativement fréquentes et peuvent avoir des répercussions profondes sur la santé. Les conséquences phénotypiques des aneuploïdies sont nombreuses et conduisent à des retards mentaux, des anomalies de développement, une susceptibilité à des maladies communes ou à différentes formes de néoplasmes. La trisomie 21 (syndrome de Down, DS, T21) est l’aneuploïdie la plus fréquente (1/700 naissances et 500 000 patients en Europe) et ces chiffres, même après les améliorations du diagnostic prénatal, la distinguent des maladies rares (< 1/2 000 naissances) [20]. C’est l’une des principales causes génétiques du retard mental. Après une brève description du syndrome nous analyserons les outils dont nous disposons pour élaborer et tester ces protocoles, les gènes candidats et les modèles animaux qui ont été créés, et enfin nous présenterons les différentes stratégies qui pourraient permettre de diminuer certains des effets indésirables. |
La trisomie 21 et les phénotypes associés La trisomie 21 exerce un effet puissant sur l’évolution du quotient intellectuel (QI). Le ratio âge mental/âge chronologique n’est pas constant. Contrairement à des enfants normaux, on observe chez les porteurs de trisomie 21 une diminution relative et progressive du QI à partir de la première année de vie. Les bases moléculaires et les gènes impliqués dans le déclin survenant au cours du développement ne sont pas connus. Ce faible QI correspond à un retard mental global. Néanmoins, lorsqu’on analyse différents facteurs liés à la cognition, on constate des déficits plus ou moins prononcés selon le type de tests utilisés pour caractériser l’attention, les fonctions exécutives, le langage, la mémoire et l’apprentissage. Au niveau morphologique, on connaît les modifications caractéristiques de la face et des membres, mais il y a aussi des modifications au niveau du cerveau. Le volume de trois zones du cerveau - le cortex préfrontal, l’hippocampe et le cervelet - est globalement réduit et l’effet le plus important porte sur cette dernière structure. En revanche, le volume de certaines zones comme la région sous-corticale est augmenté en valeur relative [1]. Au niveau microscopique, la densité neuronale de certaines régions est modifiée ainsi que la structure des épines dendritiques qui assurent les connexions entre neurones. Les altérations des processus de la cognition n’ont pas encore été reliées aux caractéristiques histologiques de la trisomie 21. Les personnes atteintes du syndrome de Down sont aussi plus susceptibles de développer une démence à partir de 40-45 ans. La maladie d’Alzheimer est caractérisée par le dépôt de plaques séniles et une dégénérescence neurofibrillaire dans les régions cérébrales vulnérables. Les changements neuropathologiques observés dans le cerveau des patients porteurs de trisomie 21 (au-delà de 35 ans) sont identiques à ceux observés dans la maladie d’Alzheimer sporadique en termes de mode de répartition des lésions (plaques et enchevêtrements) et d’immunomarquage (propriétés des lésions), bien que chez les personnes atteintes de trisomie 21 ils semblent plus prononcés. Ces changements sont associés à la démence chez 30 à 50 % des patients au-delà de 50 ans [2]. Une hypothèse pour expliquer le phénotype Alzheimer chez les personnes atteintes de trisomie 21 est que la triplication du gène codant pour la protéine amyloïde (APP), situé sur le chromosome 21, conduirait à la surproduction de peptides Aß, mais d’autres gènes du chromosome 21 pourraient également être impliqués dans le processus. |
Parmi les critères utilisés pour définir des gènes candidats on citera : La localisation chromosomique et la notion de régions critiques Le séquençage génomique a permis d’établir une liste à peu près complète des gènes présents sur le chromosome 21. De toute évidence, d’autres gènes que les gènes codés par le chromosome 21 (HSA21) sont aussi impliqués dans les phénotypes, mais leur dérèglement est vraisemblablement dû, initialement, aux gènes tripliqués sur HSA21. Cependant, la question de la localisation régionale des gènes sur le chromosome est également importante : des études de corrélation génotype-phénotype sur dix patients atteints de trisomie 21 partielle ont permis de suggérer qu’une région d’environ 2,5 Mb entre les gènes ERG ( Ets-related gene) et CBR ( carbonyl reductase), lorsqu’elle est présente en trois copies, est associée à l’altération de plusieurs tissus et fonctionnalités. Il s’agit notamment de dysmorphologie faciale (arête nasale plate, macroglossie, palais ogival, oreilles mal ourlées), des membres, d’une hyperlaxité, d’une hypotonie musculaire, d’une petite taille et d’un retard mental. La mise en commun des données de la littérature ont permis de valider l’importance de cette région (DCR-1) et d’en identifier une deuxième située dans la région proximale et qui a une plus faible pénétrance. Récemment, l’analyse d’une famille dont trois membres étaient porteurs d’une duplication de quinze gènes seulement située dans la DCR-1 a permis de circonscrire cette région [ 3, 4]. Les territoires et niveaux d’expression dans les tissus de patients ou de souris transgéniques La connaissance des territoires d’expression des gènes considérés est aussi une donnée importante : leur lien éventuel avec une atteinte de la mémoire spatiale suppose une expression dans l’hippocampe alors qu’une implication dans les malformations cardiaques suppose une expression dans le cœur fœtal. Les analyses du transcriptome ont montré que la majorité des gènes présents en trois copies sont exprimés 1,5 fois plus que les gènes en deux copies. Toutefois, certains gènes sont surexprimés plus de 1,5 fois (amplification) et d’autres sont soumis à des mécanismes compensatoires, sans changement dans leur expression ou, plus rarement, on observe une diminution de l’expression. De toute évidence, un gène dont l’expression se trouve compensée ne sera pas un bon candidat pour expliquer un phénotype observé dans le tissu étudié [5]. Les études fonctionnelles Les caractéristiques des protéines codées par les gènes candidats, leurs cibles, leurs localisations cellulaires et/ou leur appartenance à des voies de signalisation impliquées dans des fonctions précises, comme par exemple la plasticité synaptique, permettent d’identifier de bons candidats. Enfin, le meilleur critère reste la démonstration d’un phénotype résultant de la surexpression dans un modèle de souris, et ces phénotypes sont utilisés comme marqueurs de l’efficacité des stratégies thérapeutiques. |
Changements phénotypiques dans les modèles murins Les modèles murins Les orthologues des gènes situés chez l’homme sur HSA21 sont situés chez la souris sur les chromosomes 16 (MMU16), 10 (MMU10) et 17 (MMU17). Ainsi, la caractérisation de modèles de souris qui ont une copie supplémentaire de tout ou partie de MMU16, MMU10 ou MMU17 devrait être utile à la compréhension des altérations rencontrées dans la trisomie 21 [ 21]. En particulier deux modèles de trisomie partielle du chromosome 16 sont très étudiés : le premier, le modèle Ts65Dn, porte 132 gènes en trois copies et le second, le modèle Ts1Cje, porte 85 gènes en trois copies. Les souris Ts65Dn présentent des traits phénotypiques qui rappellent la trisomie : des anomalies crâniofaciales, un certain pourcentage d’anomalies cardiaques, un retard de développement et une baisse de performance dans les différents tests d’apprentissage. En outre, les altérations observées sur des tranches de cerveau montrent des anomalies de la transmission du signal électrique [ 6]. Récemment, deux modèles de souris chimères contenant une grande partie d’un chromosome 21 humain supplémentaire avec un degré variable de mosaïcisme ont également été construits : le premier a démontré une corrélation entre la gravité des phénotypes (anomalies d’apprentissage et malformation cardiaque) et le pourcentage de cellules présentant un HSA21 supplémentaire [7] ; le deuxième modèle (TC1) a montré une transmission germinale aboutissant à des mosaïques qui associent des modifications phénotypiques du comportement, de la plasticité synaptique, de la densité neuronale dans le cervelet et du développement du cœur [8]. Les stratégies de gènes candidats ont aussi permis de développer des modèles murins centrés sur un seul gène ou sur un petit groupe de gènes, et plusieurs de ces modèles présentent des altérations phénotypiques dans des organes modifiés par la trisomie. |
Les stratégies de corrections utilisées dans les modèles murins Ces modèles permettent de tester deux types d’approches : les corrections portant sur les quantités de molécules et les corrections portant sur l’activité ou l’efficacité de protéines cibles. Corrections portant sur les quantités moléculaires Elles peuvent cibler soit le transcrit, soit la protéine. On pense que la première conséquence de la présence de trois copies de gènes est le plus souvent une augmentation de l’ARN messager. L’utilisation d’une nouvelle classe de petits ARN est l’une des stratégies permettant de diminuer la quantité des ARN cibles et, en conséquence, la quantité de protéine codée. Une expérience ciblant Dyrk1a ( dual-specificity tyrosine-(Y)-phosphorylation regulated kinase 1A), une kinase importante localisée dans la région DCR-1, en est un bon exemple : les chercheurs ont utilisé un vecteur viral modifié pour délivrer un siARN provoquant la destruction d’une partie de l’ARN codant pour la protéine Dyrk1a. Son administration à une souris modèle surexprimant ce gène a entraîné la correction d’anomalies de la coordination motrice observées en plaçant les animaux sur un tapis roulant couplé à un dispositif électrique [ 9]. La deuxième stratégie vise directement la protéine codée par le gène candidat. Il s’agit dans ce cas d’agir sur la quantité de peptide bêta-amyloïde impliqué dans les altérations de la mémoire chez les patients atteints de la maladie d’Alzheimer. Deux études ont utilisé des anticorps dirigés contre ce peptide : dans le premier cas, les auteurs montrent une correction du taux d’acétylcholine hippocampique ; dans le second cas, ils montrent qu’une injection intrapéritonéale d’anticorps induit des améliorations significatives de l’apprentissage spatial et de la mémoire par rapport à des souris contrôles [10]. Corrections portant sur l’activité des protéines Protéines du cycle cellulaire
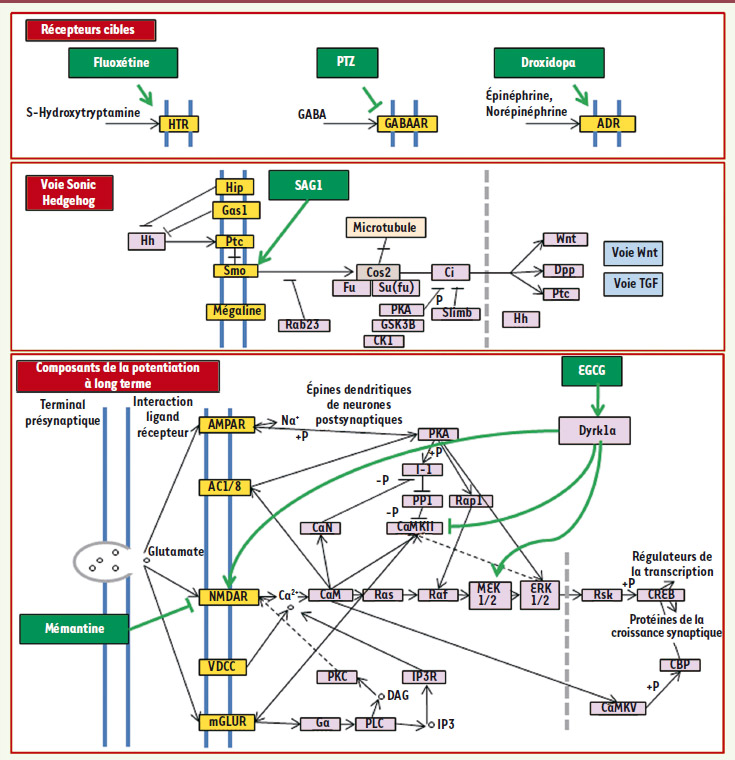
- Sonic Hedgehog (Figure 1). Le développement des précurseurs de cellules granulaires du cervelet est diminué chez les souris Ts65Dnn, ce qui explique la taille réduite du cervelet chez les souris trisomiques adultes. Ce déficit serait directement provoqué par un défaut de réponse à la protéine Sonic Hedgehog qui normalement contrôle la prolifération cellulaire pendant le développement du cervelet. On peut stimuler cette prolifération soit par l’ajout direct de la protéine, soit en utilisant un agoniste (SAG1) qui stimule son activité. Un traitement donné à des souriceaux permet de corriger le taux bas de division cellulaire. Cet agoniste permet aussi de corriger des défauts de prolifération des cellules de la crête neurale, en particulier de l’arc pharyngien, lorsqu’elles sont exposées in vitro à ce produit [11].
 | Figure 1. Principales voies ciblées par les différentes stratégies thérapeutiques mises en œuvre dans les modèles murins. La plupart de ces molécules agissent sur des récepteurs membranaires excepté l’EGCG qui cible une protéine à la fois cytosolique et nucléaire, Dyrk1a. |
- Prozac® et neurogenèse (Figures 1 et 2). La recherche des mécanismes des déficits de la mémoire et de l’apprentissage observés chez les souris Ts65Dn a conduit certains auteurs à évaluer la neurogenèse dans le gyrus denté. Ils ont constaté une diminution de la neurogenèse par rapport aux animaux euploïdes. L’administration chronique d’antidépresseurs (comme le Prozac®, également appelé la fluoxétine) permet de contrer les aspects comportementaux négatifs induits par le stress et la dépression en agissant sur le récepteur de la sérotonine et en augmentant la neurogenèse. Pour déterminer si la neurogenèse induite par les antidépresseurs est également efficace chez la souris Ts65Dn, une équipe a traité de façon prolongée (24 jours) les souris Ts65Dn jeunes (2 mois et demi) avec la fluoxétine. Ces auteurs rapportent des augmentations significatives de la neurogenèse dans l’hippocampe [12].
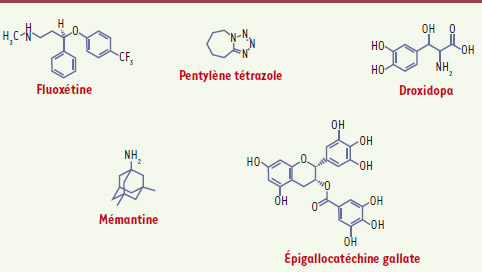
 | Figure 2. Molécules utilisées dans les tests thérapeutiques dans les modèles murins. Fluoxétine : le chlorhydrate de fluoxétine est un médicament antidépresseur utilisé dans le traitement de la dépression. C’est un inhibiteur sélectif de la recapture de la sérotonine. Pentylènetétrazole : aussi appelé cardiazol ou PTZ, c’est un antagoniste du GABA. Il a été utilisé comme stimulant cardiaque et respiratoire. Droxidopa : la L-thréo-dihydroxyphénylsérine est un agent psychoactif converti en norépinéphrine (ou noradrénaline). Mémantine : c’est une substance active médicamenteuse proposée dans le traitement de la maladie d’Alzheimer qui agit par blocage des récepteurs NMDA. Épigallocatéchine gallate : c’est la plus abondante des catéchines du thé vert ; son activité antioxydante est reconnue et elle est considérée comme un agent anticancéreux. |
Protéines de la plasticité synaptique
- Voies GABAergiques. Des recherches antérieures ont suggéré que les déficits cognitifs des souris Ts65Dn ne sont pas dus à des anomalies flagrantes de la neuroanatomie, mais plutôt à une baisse sélective du nombre de synapses excitatrices dans le cerveau et aux changements correspondants dans la connectivité synaptique. Ces résultats sont confirmés par des études in vitro montrant qu’un excès d’acide γ-aminobutyrique (GABA), l’un des principaux neurotransmetteurs et neuromodulateurs, entraîne un excès d’inhibition correspondant à une atteinte des propriétés de la potentialisation à long terme, comme celle qui est observée chez les souris Ts65Dn (Figure 1). Lorsqu’on administre une dose non épileptogène de picrotoxine, un antagoniste non compétitif du GABA, on observe une amélioration de la mémoire dans le processus de reconnaissance d’objets. Un traitement per os est aussi efficace dans ce test. Une autre étude a utilisé le labyrinthe aquatique de Morris pour évaluer l’apprentissage spatial après un traitement avec le pentylènetétrazole (PTZ) et montre que ce dernier entraîne également une amélioration des performances (temps de latence pour atteindre la plate-forme) avec néanmoins une altération des fonctions motrices [13, 14].
- Voie norépinéphrine (Figure 1). L’étude des déficits observés chez la souris Ts65Dn et des études effectuées chez des patients atteints de la maladie d’Alzheimer et du syndrome de Down suggèrent un déficit en norépinéphrine qui aurait pour conséquence un déficit de l’apprentissage contextuel. La mesure directe effectuée sur des cerveaux de souris Ts65Dn montre effectivement une quantité diminuée de norépinéphrine. L’administration de droxidopa, un acide aminé synthétique qui est métabolisé par une enzyme présente dans les neurones contenant la norépinephrine, provoque l’augmentation du neurotransmetteur dans l’hippocampe. Ce traitement améliore les performances des souris Ts65Dn traitées dans les tests de mémoire contextuelle. Pour pallier les effets secondaires du droxidopa dans l’organisme, les auteurs de l’étude proposent de coupler l’utilisation du droxidopa qui pénètre la barrière hématoencéphalique avec le carbidopa, un inhibiteur de l’enzyme permettant de métaboliser le droxidopa qui, lui, ne passe pas cette barrière [15].
Récepteurs NMDA et administration de mémantine Les récepteurs NMDA (NMDAR) exercent un contrôle moléculaire sur la plasticité synaptique car lorsqu’ils sont activés, ils provoquent l’ouverture de canaux ioniques. L’action conjuguée de deux gènes de HSA21, DSCR1 ( Down’s syndrome candidate region-1, aussi dénommé RCAN1) et DYRK1A, conduit à une activité réduite de la calcineurine et à une augmentation moyenne du temps d’ouverture des NMDAR. La mémantine, un antagoniste non compétitif des NMDAR, peut partiellement restaurer la fonction physiologique des NMDAR et potentiellement améliorer l’apprentissage et la mémoire chez ces animaux (Figure 1). Un paradigme permettant de tester la mémoire contextuelle (conditionnement à la peur) montre une amélioration des performances des souris Ts65Dn lorsqu’on leur injecte une solution saline contenant la mémantine [ 16]. Voie Dyrk1a La kinase minibrain (chez la drosophile) est une sérine thréonine kinase à double spécificité. Elle fait partie des gènes candidats responsables d’anomalies cognitives. Son expression est élevée dans le cerveau de fœtus trisomiques et dans des tissus provenant d’adultes trisomiques [ 17]. Plusieurs substrats endogènes de cette kinase ont été identifiés, dont le facteur de transcription FKHR ( Forkhead related transcription factor, FOXO1a), la protéine tau (constituant les neurofilaments enchevêtrés observés dans la maladie d’Alzheimer) [ 22] et des protéines engagées dans l’endocytose comme la dynamine et la synaptojanine. Elle est impliquée dans le contrôle de la neurogenèse et de la plasticité neuronale. Plusieurs modèles de souris transgéniques ont été construits qui montrent des atteintes à la fois de la neurogenèse et de la plasticité synaptique. En particulier, ces souris ont des performances diminuées lorsqu’elles sont soumises au test de reconnaissance d’objet ou à celui de la piscine de Morris. Les recherches systématiques d’inhibiteurs de kinases ont permis d’identifier deux inhibiteurs de la protéine Dyrk1a (Figure 1) : l’harmine, qui est aussi malheureusement inducteur de tremblement chez l’animal, et une catéchine du thé vert, l’épigallocatéchine gallate (EGCG) [18] (Figure 2). Un régime riche en polyphénols du thé vert administré aux femelles gestantes et poursuivi chez le nouveau-né induit des corrections non seulement de la morphogenèse, mais aussi des marqueurs moléculaires et de la plasticité synaptique [19]. Un régime similaire donné aux souris trisomiques Ts65Dn entraîne lui aussi une correction du phénotype cognitif, ce qui confirme l’intérêt de ces molécules. |
L’efficacité des stratégies correctrices décrites ci-dessus, et leurs éventuels effets secondaires, devront être évalués dans plusieurs modèles d’analyse de gènes uniques et dans des modèles de trisomie partielle, avec une batterie complète de tests moléculaires et cognitifs. Les progrès déjà réalisés en quelques années dans les stratégies de ciblage de gènes spécifiques ou de voies dérégulées dans la trisomie sont très prometteurs. On peut espérer que des stratégies similaires, ou le développement en clinique humaine des stratégies exposées dans cet article, rendront possible une amélioration des potentialités cognitives et des capacités d’autonomie des patients porteurs de trisomie 21. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
1. Pinter JD, Eliez S, Schmitt JE, et al. Neuroanatomy of Down’s syndrome: a high-resolution MRI study. Am J Psychiatry 2001; 158 : 1659–65. 2. Mann DM, Royston MC, Ravindra CR. Some morphometric observations on the brains of patients with Down’s syndrome: their relationship to age and dementia. J Neurol Sci 1990; 99 : 153–64. 3. Delabar JM, Theophile D, Rahmani Z, et al. Molecular mapping of twenty-four features of Down syndrome on chromosome 21. Eur J Hum Genet 1993; 1 : 114–24. 4. Ronan A, Fagan K, Christie L, et al. Familial 4.3 Mb duplication of 21q22 sheds new light on the Down syndrome critical region. Med Genet 2007; 44 : 448–51. 5. Aït Yahya-Graison E, Aubert J, Dauphinot L, et al. Classification of human chromosome 21 gene-expression variations in Down syndrome: impact on disease phenotypes. Am J Hum Genet 2007; 81 : 475–91. 6. Kleschevnikov AM, Belichenko PV, Villar AJ, et al. Hippocampal long-term potentiation suppressed by increased inhibition in the Ts65Dn mouse, a genetic model of Down syndrome. J Neurosci 2004; 24 : 8153–60. 7. Shinohara T, Tomizuka K, Miyabara S, et al. Mice containing a human chromosome 21 model behavioral impairment and cardiac anomalies of Down’s syndrome. Hum Mol Genet 2001; 10 : 1163–75. 8. O’Doherty A, Ruf S, Mulligan C, et al. An aneuploid mouse strain carrying human chromosome 21 with Down syndrome phenotypes. Science 2005; 309 : 2033–7. 9. Ortiz-Abalia J, Sahún I, Altafaj X, et al. Targeting Dyrk1A with AAVshRNA attenuates motor alterations in TgDyrk1A, a mouse model of Down syndrome. Am J Hum Genet 2008; 83 : 479–88. 10. Lee EB, Leng LZ, Zhang B, et al. Targeting amyloid-beta peptide (Abeta) oligomers by passive immunization with a conformation-selective monoclonal antibody improves learning and memory in Abeta precursor protein (APP) transgenic mice. J Biol Chem 2006; 281 : 4292–9. 11. Roper RJ, VanHorn JF, Cain CC, Reeves RH. A neural crest deficit in Down syndrome mice is associated with deficient mitotic response to Sonic hedgehog. Mech Dev 2009; 126 : 212–9. 12. Clark S, Schwalbe J, Stasko MR, et al. Fluoxetine rescues deficient neurogenesis in hippocampus of the Ts65Dn mouse model for Down syndrome. Exp Neurol 2006; 200 : 256–61. 13. Fernandez F, Morishita W, Zuniga E, et al. Pharmacotherapy for cognitive impairment in a mouse model of Down syndrome. Nat Neurosci 2007; 10 : 411–3. 14. Rueda N, Flórez J, Martínez-Cué C. Chronic pentylenetetrazole but not donepezil treatment rescues spatial cognition in Ts65Dn mice, a model for Down syndrome. Neurosci Lett 2008; 433 : 22–7. 15. Salehi A, Faizi M, Colas D, et al. Restoration of Norepinephrine-Modulated Contextual Memory in a Mouse Model of Down Syndrome. Sci Transl Med 2009; 7 : 7–17. 16. Costa AC, Scott-McKean JJ, Stasko MR. Acute injections of the NMDA receptor antagonist memantine rescue performance deficits of the Ts65Dn mouse model of Down syndrome on a fear conditioning test. Neuropsychopharmacology 2008; 33 : 1624–32. 17. Dowjat WK, Adayev T, Kuchna I, et al. Trisomy-driven overexpression of DYRK1A kinase in the brain of subjects with Down syndrome. Neurosci Lett 2007; 413 : 77–81. 18. Bain J, McLauchlan H, Elliott M, Cohen P. The specificities of protein kinase inhibitors: an update. Biochem J 2003; 371 : 199–204. 19. Guedj F, Sébrié C, Rivals I, et al. Green tea polyphenols rescue of brain defects induced by overexpression of DYRK1A. PLOS One 2009; 4 : e4606. 20. Turleau C, Vekemans M. Trisomie 21 : 50 ans entre médecine et science. Med Sci (Paris) 2010; 26 : 267–72. 21. Langui D, Lachapelle F, Duyckaerts C. Modèles animaux des maladies neurodégénératives. Med Sci (Paris) 2007; 23 : 180–6. 22. Clavaguera F, Goedert M, Tolnay M. Induction et propagation de la pathologie par la protéine tau chez un modèle murin de la maladie d’Alzheimer. Med Sci (Paris) 2010; 26 : 121–5. |