| |
| Med Sci (Paris). 2010 March; 26(3): 251–258. Published online 2010 March 15. doi: 10.1051/medsci/2010263251.Mécanismes de division cellulaire asymétrique Des organismes modèles au développement tumoral Nicolas T. Chartier,1* Vincent Hyenne,1* and Jean-Claude Labbé1,2* 1Unité de recherche en division et différenciation cellulaire, Institut de recherche en immunologie et en cancérologie, Université de Montréal, CP 6128, Succursale Centre-ville, Montréal (Québec), Canada H3C 3J7, Canada 2Département de pathologie et biologie cellulaire, Faculté de Médecine, Université de Montréal, Montréal (Québec) H3C 3J7 Canada |
Découverte des protéines PAR dans l’embryon de C. elegans
Les protéines PAR, régulateurs majeurs de la polarité cellulaire, furent découvertes au milieu des années 1980 lors de cribles destinés à isoler des mutations à l’origine d’une létalité embryonnaire précoce chez C. elegans [
1]. Les embryons de C. elegans réalisent normalement une série de divisions asymétriques nécessaires à la viabilité embryonnaire : dès les premières minutes qui suivent la fécondation, l’embryon unicellulaire établit une polarité corticale et cytoplasmique antéro-postérieure qui permet une première mitose asymétrique [
38]. Cette division donne deux blastomères différents à la fois en taille et en destinée : un blastomère antérieur volumineux appelé AB et un blastomère postérieur nommé P1, plus petit, à l’origine de la lignée germinale. Les six mutants létaux, découverts par Kemphues et al., partagent tous un phénotype commun : leurs premières divisions embryonnaires ne sont plus asymétriques comme chez les embryons sauvages mais symétriques (Figure 1A). Ces mutations furent nommées par (partitioning defective), leur phénotype de divisions symétriques étant associé à une mauvaise répartition des déterminants cytoplasmiques. Par la suite, le clonage de ces gènes permit d’identifier la nature moléculaire des protéines codées par chacun des six gènes par (Tableau I).
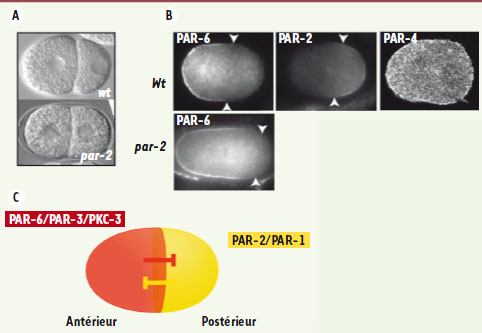
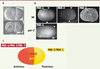 | Figure 1.
Protéines PAR et asymétries chez l’embryon précoce de C. elegans. A. Embryons de C. elegans au stade 2 cellules observés par microscopie à contraste interférentiel différentiel (DIC). Les embryons sauvages (wt) présentent une forte asymétrie de taille entre la cellule antérieure AB (à gauche) et la cellule postérieure P1 (à droite). Dans les embryons mutants pour le gène par-2, les deux cellules sont identiques. B. Observation en microscopie confocale des localisations des protéines PAR-6, PAR-2 et PAR-4. Les protéines PAR présentent différentes localisations spécifiques dans l’embryon unicellulaire, PAR-6 étant enrichie au cortex antérieur et PAR-2 enrichie au cortex postérieur. PAR-4 est répartie uniformément au cortex et dans le cytoplasme. Dans les mutants par-2, le domaine de PAR-6 s’étend vers le pôle postérieur comparativement aux embryons de type sauvage (les flèches blanches délimitent les domaines respectifs définis par immunofluorescence). C. Schéma représentant une vue du cortex des deux domaines PAR d’un embryon sauvage au stade unicellulaire. Le domaine antérieur PAR-6/PAR-3/ PKC-3 et le domaine antérieur PAR-2/PAR-1 s’inhibent mutuellement. |
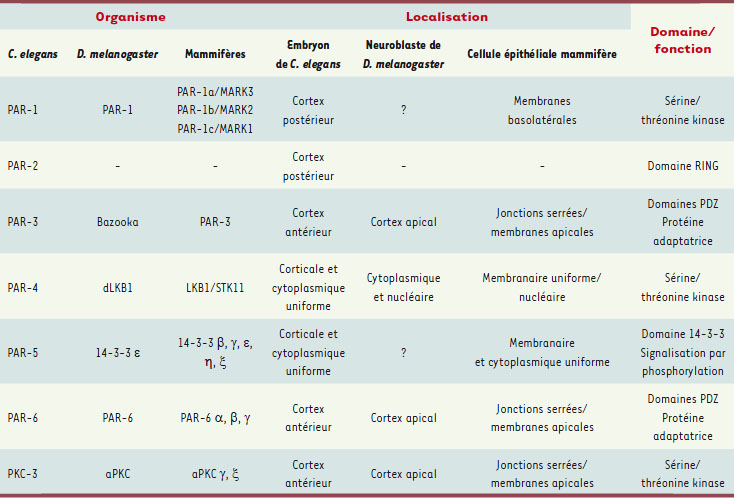
 | Tableau I.
La famille des protéines PAR et ses orthologues.
|
Les protéines PAR sont initialement réparties de façon symétrique au cortex ou dans le cytoplasme de l’ovocyte non fécondé de C. elegans. Lors de la fécondation, le pôle postérieur est défini par le point d’entrée du pronoyau mâle et du centrosome associé [
2]. Après la fécondation, un (ou plusieurs) facteur(s) véhiculés par le spermatozoïde inhibe(nt) localement les contractions corticales du cytosquelette d’actine qui vont se déplacer vers le pôle antérieur et circonscrire alors deux domaines corticaux distincts [
3] : PAR-6 et PAR-3 forment un complexe avec la protéine kinase PKC-3 au cortex antérieur, tandis que PAR-1 et PAR-2 sont restreintes au cortex postérieur (Figure 1B). PAR-4 et PAR-5 restent distribuées de façon symétrique sur l’ensemble du cortex ainsi que dans le cytoplasme et permettent de définir et de stabiliser la limite entre les domaines antéro-postérieurs [
4,
5]. La mise en place et le maintien des deux domaines corticaux distincts : PAR-3/PAR-6/PKC-3 au cortex antérieur et PAR-1/PAR-2 au cortex postérieur, reposent sur une inhibition réciproque des deux complexes l’un vis-à-vis de l’autre (Figure 1C). Ainsi dans un mutant par-2, le complexe antérieur peut s’étendre jusqu’au pôle postérieur et occuper uniformément le cortex (Figure 1B). Inversement, dans un mutant par-6, le domaine PAR-2 demeure uniforme sur l’intégralité du cortex [
6]. Chaque protéine PAR est donc nécessaire à la polarisation de l’embryon de C. elegans puisque l’activité et la localisation de chacune d’elles sont interdépendantes des autres. Cette polarisation de l’embryon dès le stade du zygote est indispensable à la division asymétrique. |
Les protéines PAR, des régulateurs essentiels à l’établissement de la polarité conservés dans divers modèles de divisions asymétriques D’autres modèles d’études ont permis de démontrer que cette voie de signalisation dépendante des protéines PAR n’est pas l’apanage de C. elegans mais est conservée dès qu’il s’agit de créer et de maintenir des asymétries cellulaires (Tableau I). Chez la drosophile, par exemple, une polarisation cellulaire suivie de divisions asymétriques est observée dans les cellules du système nerveux central de l’embryon et de la larve : des cellules progénitrices appelées neuroblastes se détachent du neuroectoderme et entament alors un cycle de divisions asymétriques [
7]. Chaque division donne naissance à une petite cellule basale appelée GMC (pour ganglion mother cell, cellule mère ganglionnaire) et un neuroblaste apical plus volumineux. La GMC donne ensuite elle-même naissance à un neurone et à une cellule gliale tandis que le neuroblaste apical est capable de se diviser à nouveau en GMC et neuroblaste. Dans ce système, un complexe homologue à celui de C. elegans, Bazooka (PAR-3)/PAR-6/aPKC (PKC-3) est localisé au pôle apical du neuroblaste et joue un rôle crucial dans la restriction de déterminants du devenir cellulaire de la GMC comme Prospero, Miranda, Numb et Pon [
8,
9]. Une fois la polarité établie au cortex cellulaire, la signalisation dépendante des protéines PAR permet de réguler deux processus importants au cours d’une division asymétrique : le positionnement asymétrique du fuseau mitotique et la ségrégation de déterminants propres à chaque cellule fille (Figure 2A).
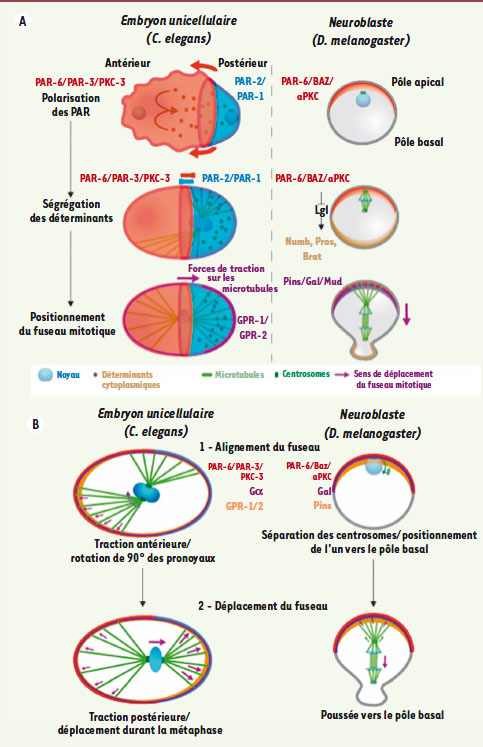
 | Figure 2.
Différentes étapes nécessaires à la division asymétrique chez les organismes modèles. A. Représentation schématique des trois étapes successives permettant la division asymétrique de l’embryon de C. elegans et du neuroblaste embryonnaire de D. melanogaster. La première phase de polarisation consiste à localiser les différents complexes de protéines PAR de façon asymétrique au cortex. L’activité de ces complexes permet ensuite d’induire des signalisations intracellulaires localisées menant à la ségrégation de déterminants spécifiques du devenir de chacune des cellules filles. Enfin, lors de l’anaphase, le fuseau mitotique s’aligne le long de l’axe de division et est déplacé (vers le pôle postérieur chez C. elegans, vers le pôle basal chez D. melanogaster) afin de produire deux cellules filles de tailles différentes. L’embryon de C. elegans est représenté par une vue semi-transparente du cortex permettant de distinguer les composants cytoplasmiques (microtubules, noyaux et déterminants). B. Acteurs protéiques et chronologie du positionnement asymétrique du fuseau mitotique. L’ensemble noyaux/centrosomes est tout d’abord aligné le long du futur axe de division, puis une machinerie protéique dépendante des protéines G hétérotrimériques déplace le fuseau en exerçant des forces différentes sur les microtubules astraux des deux pôles. |
Longtemps suspectée, l’existence de divisions asymétriques chez les mammifères a récemment été mise en évidence dans les cellules souches musculaires [
10,
11], neuronales [
12], hématopoïétiques [
13] et de l’épithélium de la peau [
14]. S’il est établi que les protéines PAR sont essentielles au maintien de la polarité cellulaire dans de nombreux types cellulaires chez les mammifères, leur rôle dans la division asymétrique des cellules souches reste toutefois moins bien documenté. Chez la souris, les protéines PAR-3, PAR-6 et aPKC se localisent au pôle apical des progéniteurs neuronaux qui peuvent se diviser de manière asymétrique. La délétion de PAR-3 ou de PAR-6 entraîne une sortie du cycle cellulaire et une différenciation précoce de ces progéniteurs. En revanche, la surexpression de PAR-6 augmente le nombre de divisions symétriques et le potentiel prolifératif des progéniteurs non différenciés [
15]. |
Positionnement asymétrique du fuseau mitotique La formation de deux cellules filles très différentes en taille, comme on l’observe chez l’embryon de C. elegans et pour le neuroblaste de la drosophile, implique que la polarité corticale initiale soit transmise au fuseau mitotique pour induire son positionnement asymétrique le long de l’axe de polarité. Des expériences d’ablation du fuseau de microtubules dans l’embryon de C. elegans ont montré que la rotation du fuseau et son positionnement asymétrique le long de l’axe de division dépendent de forces inégales exercées sur ce fuseau [
16, 38]. Ainsi le positionnement de l’ensemble pronoyaux/centrosomes, sa rotation de 90° puis le déplacement du fuseau mitotique vers le pôle postérieur sont les conséquences d’une augmentation des forces relatives exercées sur les microtubules antérieurs dans un premier temps puis sur les microtubules postérieurs. Le positionnement excentré de l’anneau contractile de cytodiérèse, menant à l’individualisation de cellules filles de tailles différentes (Figure 2B) semble alors être en partie attribuable au déplacement postérieur du fuseau de microtubules. Il a été démontré que les protéines PAR ont la capacité de réguler les forces exercées sur les microtubules via les protéines G hétérotrimériques (αβγ) [
39]. La signalisation médiée par les protéines G hétérotrimériques repose sur la propriété de la sous-unité Gα de se fixer aux nucléotides guanidiques (GDP et GTP). Dans la voie de signalisation canonique, l’hétérotrimère Gα-GDP/Gβγ est inactif et la stimulation d’un récepteur transmembranaire associé favorise la liaison de Gα avec le GTP, sa dissociation du dimère Gβγ et l’activation des voies effectrices. La forme Gα-GTP peut être stabilisée par des facteurs d’échange du GTP (GEF) tandis que des inhibiteurs de dissociation du nucléotide guanidique (GDI) favorisent la stabilisation de la forme Gα-GDP. Chez l’embryon de C. elegans, la signalisation médiée par les protéines G hétérotrimériques est indépendante d’un récepteur transmembranaire et repose sur deux sous-unités Gα redondantes, GOA-1 et GPA-16, qui sont activement responsables des forces exercées sur les microtubules [
17]. Ces deux sous-unités Gα sont réparties uniformément au cortex et leur activation polarisée exige que les protéines à motifs GoLoco GPR-1/GPR-2 agissent comme GDI (inhibiteur de la dissociation du nucléotide guanidique) pour GOA-1 et GPA-16. Ces protéines sont enrichies au pôle postérieur de l’embryon à partir de la métaphase, et ce de façon dépendante des protéines PAR [
18]. Ainsi, en favorisant l’augmentation localisée des sous-unités Gα liées au GDP, GPR-1 et GPR-2, celles-ci favorisent l’augmentation des forces exercées sur les microtubules. À quelques différences près, les mécanismes moléculaires en cause dans le positionnement du fuseau mitotique chez C. elegans sont conservés dans les neuroblastes de drosophile (Figure 2B) [
19,
20]), ainsi que dans les progéniteurs neuronaux de mammifères se divisant de manière asymétrique [
21,
22]. Cependant, le rôle de ces machineries moléculaires dans la division asymétrique d’autres types cellulaires, en l’occurrence ceux de mammifères, ainsi que leurs effecteurs en aval, restent encore à caractériser. |
Distribution asymétrique des déterminants du devenir cellulaire Les protéines PAR ne se limitent pas seulement à positionner le fuseau mitotique, elles régissent aussi la répartition des déterminants dans les cellules filles. Ces déterminants sont des facteurs présents dans la cellule mère qui sont essentiels à la différenciation de l’une des deux cellules filles dans laquelle ils doivent donc être exclusivement distribués. Contrairement aux complexes moléculaires régissant la mise en place de la polarité et le positionnement du fuseau mitotique qui sont conservés au cours de l’évolution, les déterminants du devenir cellulaire semblent spécifiques à un système donné. Par exemple, la protéine PIE-1 et le complexe ribonucléoprotéique des granules P sont deux facteurs qui participent à la formation de la lignée germinale chez C. elegans [
23,
24]. Ils sont initialement répartis de manière uniforme dans le cytoplasme des zygotes non polarisés. Lors des événements précoces de contraction du cortex vers le pôle antérieur, des flots cytoplasmiques inverses se déplaçant du pôle antérieur vers le pôle postérieur provoquent l’enrichissement des granules P et de PIE-1 au pôle postérieur (Figure 2) [
25]. Les granules P y sont alors stabilisés par la protéine PAR-1 [4]. En parallèle, une dégradation locale des granules P se produit au pôle antérieur. La protéine PIE-1, qui reste présente dans AB après la première division, est activement dégradée par l’intermédiaire de la protéine ZIF-1 et du complexe E3 ligase elongin C/CUL-2 [25]. Ainsi, PIE-1 et les granules P sont exclusivement localisés dans P1, cellule précurseur de la lignée germinale. Dans le cas contraire, la lignée germinale ne peut se différencier correctement et les vers deviennent stériles. Dans le neuroblaste de drosophile, trois principaux déterminants du devenir cellulaire sont circonscrits de manière asymétrique dans la GMC appelée à se différencier : Numb, Prospero et Brat. Leur localisation au pôle basal est assurée par la protéine Lgl, elle-même exclue du pôle apical par suite de sa phosphorylation par aPKC (Figure 2) [
26]. Numb est un répresseur de la voie de signalisation Notch, régulateur de la division et de la prolifération cellulaire [
27]. Prospero, quant à lui, est un facteur de transcription requis pour réprimer des gènes qui déterminent la différenciation en neuroblaste, notamment des régulateurs positifs du cycle cellulaire et des gènes amorçant la différenciation neuronale [
28]. Bien que la présence de Brat soit indispensable à la différenciation des GMC [
29,
30], son mode d’action demeure mal compris. De manière intéressante, les homologues de Brat chez C. elegans exercent eux aussi un rôle dans la division asymétrique, non pas en tant que déterminants du devenir cellulaire mais en tant que participants à la phase de polarisation précoce en amont des protéines PAR [
31]. L’étude des organismes modèles a donc permis de repérer non seulement les acteurs moléculaires nécessaires à une division asymétrique mais encore les différentes étapes que ces molécules orchestrent. Ces connaissances servent dorénavant de guide aux études réalisées chez les mammifères où, tout récemment encore, l’observation de divisions asymétriques restait difficile. |
La perte de division asymétrique : première étape de la tumorigenèse ? Les divisions asymétriques sont essentielles aussi bien lors des phases de croissance des organismes que dans le cours de leur vie adulte, c’est pourquoi leur dérèglement pourrait avoir des conséquences pathologiques. Des données récentes indiquent en effet que des défauts de divisions asymétriques des neuroblastes entraînent l’apparition de tumeurs chez la drosophile. En 2005, E. Caussinus et C. Gonzalez ont ainsi montré que la transplantation de lobes de cerveaux de larves mutantes pour les gènes codant pour Miranda, Prospero et Numb dans la cavité abdominale de mouches sauvages adultes aboutit à la formation de tumeurs riches en neuroblastes [
32]. On a remarqué dans ce cas que l’instabilité génomique et les altérations du nombre de centrosomes, qui sont fréquemment observées dans les tumeurs humaines, sont des événements secondaires puisqu’ils ne sont pas directement reliés à la formation des tumeurs. Cette étude a depuis été renforcée par l’analyse de la fonction de nouveaux gènes engagés dans la division asymétrique des neuroblastes. Ces gènes suppresseurs de tumeurs peuvent être répartis en trois catégories (Figure 3) :
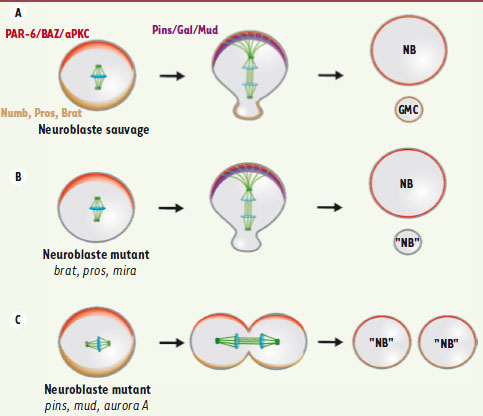
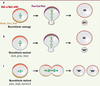 | Figure 3.
Les gènes engagés dans le processus de polarité du neuroblaste de drosophile sont des suppresseurs de tumeurs. Le modèle du neuroblaste embryonnaire de drosophile a permis de mettre en évidence des gènes régulant la division asymétrique dans la tumorigenèse. Dans les embryons de type sauvage (A), la localisation polarisée des déterminants du devenir cellulaire et des protéines régulant le déplacement et l’orientation du fuseau mitotique assure une division asymétrique en taille et en devenir pour les cellules filles. Lorsque les déterminants cytoplasmiques (B) ou le complexe orientant le fuseau mitotique (C) sont mutés, les deux cellules filles présentent des caractéristiques neuroblastiques et sont capables de former des tumeurs lorsqu’elles sont successivement réimplantées dans des individus sains. NB : neuroblaste ; GMC : ganglion mother cell. |
-
les gènes régissant la polarité basolatérale en aval du complexe PAR3/PAR6/aPKC comme Lgl, Dlg et Scrib. Leur mutation entraîne une perte de polarité du neuroblaste et la formation de cellules filles qui maintiennent les caractéristiques de neuroblastes et prolifèrent de manière anarchique [
33] ;
-
les gènes en charge de l’orientation du fuseau mitotique le long de l’axe de polarité dans le neuroblaste comme Pins ou Mud. Chez les mutants Mud, les protéines de polarité apicale sont correctement localisées, ainsi que les déterminants du devenir cellulaire. Mais le fuseau mitotique n’étant plus aligné le long de l’axe de polarité, les déterminants cellulaires sont répartis dans les deux cellules filles. Ceci aboutit à la formation de neuroblastes ectopiques qui continuent de proliférer [33,
34] ;
-
les déterminants cellulaires comme le gène Brat. Chez les mouches mutantes pour Brat, la GMC adopte le devenir d’un neuroblaste. Il en résulte une prolifération anarchique qui aboutit à une tumeur du cerveau et à la mort de la mouche [29, 30]. Les gènes Numb, Prospero et Miranda appartiennent également à cette catégorie ;
-
des mutations dans des gènes intervenant à différentes étapes de la division asymétrique du neuroblaste de drosophile peuvent donc directement engendrer des tumeurs chez la mouche.
|
Le concept de cellule souche cancéreuse chez les mammifères Chez les mammifères, il est maintenant clairement accepté que des mutations dans les gènes suppresseurs de tumeurs PKC, Lgl ou LKB1 peuvent entraîner, dans des cellules épithéliales, une perte de polarité ainsi que la formation de tumeurs. En revanche, le fait qu’une perte de polarité puisse altérer une division cellulaire asymétrique et ainsi déclencher la tumorigenèse reste à démontrer. Toutefois, cette possibilité repose sur le concept de cellules souches cancéreuses. Selon ce concept, les tumeurs humaines proviennent d’une petite sous-population de cellules capables à la fois de se régénérer et de produire des cellules qui se différencient à divers degrés. Si seules les cellules souches cancéreuses disposent de la capacité de proliférer de manière significative et de produire de nouvelles tumeurs, les cellules tumorales plus différenciées constituent la majeure partie de la masse tumorale. Ces cellules souches cancéreuses sont donc semblables aux cellules souches normales, à la différence notable que leur prolifération est hors de contrôle et leur différenciation anormale. Ce concept a été conforté par l’étude des LAM (leucémies aiguës myéloblastiques). Dans le système hématopoïétique, la hiérarchie cellulaire est particulièrement bien établie et D. Bonnet et J. Dick ont montré que les LAM se caractérisent par la présence d’une population hétérogène de cellules plus ou moins différenciées provenant probablement d’une cellule souche originelle [
35]. Des études de cancers solides comme les cancers du sein [
36] ou les glioblastomes [
37] ont d’ailleurs étayé cette théorie. Ces cellules souches cancéreuses pourraient conduire à une prolifération tumorale en se différenciant de manière anormale sans qu’une division asymétrique ne soit directement affectée. Toutefois, au regard des données obtenues chez la drosophile, il est envisageable qu’un certain nombre de cancers humains proviennent du dérèglement des divisions asymétriques des cellules souches. Ces travaux suggèrent que la division asymétrique pourrait être une étape précoce de la tumorigenèse chez l’homme. Certes, il ne s’agit encore que d’une hypothèse. Cependant, si une démonstration directe en faisait la preuve, celle-ci pourrait avoir de profondes répercussions sur la compréhension de la tumorigenèse et, par conséquent, dans la mise au point de nouvelles approches thérapeutiques. Celles-ci pourraient viser plus spécifiquement les cellules souches cancéreuses en inhibant, par exemple, leur capacité d’autorenouvellement par division asymétrique. Les complexes moléculaires détectés chez les organismes modèles pour leur rôle dans l’établissement de la polarité et le positionnement du fuseau constitueraient alors des cibles clés contre la progression tumorale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nicolas T. Chartier et Vincent Hyenne ont contribué également à la rédaction de cette synthèse. Nous tenons à remercier les membres du laboratoire de Jean-Claude Labbé pour leurs critiques constructives. Nicolas T. Chartier était boursier de la Fondation recherche médicale (France) et est boursier du Fonds de la recherche en santé du Québec. Vincent Hyenne est boursier de la Fondation Terry Fox. Jean-Claude Labbé est titulaire de la chaire de recherche du Canada en division et différenciation cellulaires et du fonds de recherche des Instituts de recherche en santé du Canada (#158715) et de la Société canadienne du cancer (#19378).
|
1. Kemphues KJ, Priess JR, Morton DG, Cheng NS. Identification of genes required for cytoplasmic localization in early C. elegans embryos. Cell 1988; 52 : 311–20. 2. Goldstein B, Hird SN. Specification of the anteroposterior axis in Caenorhabditis elegans. Development 1996; 122 : 1467–74. 3. Munro E, Nance J, Priess JR. Cortical flows powered by asymmetrical contraction transport PAR proteins to establish and maintain anterior-posterior polarity in the early C. elegans embryo. Dev Cell 2004; 7 : 413–24. 4. Cheeks RJ, Canman JC, Gabriel WN, et al.
C. elegans PAR proteins function by mobilizing and stabilizing asymmetrically localized protein complexes. Curr Biol 2004; 14 : 851–62. 5. Morton DG, Shakes DC, Nugent S, et al. The Caenorhabditis elegans par-5 gene encodes a 14-3-3 protein required for cellular asymmetry in the early embryo. Dev Biol 2002; 241 : 47–58. 6. Cuenca AA, Schetter A, Aceto D, et al. Polarization of the C. elegans zygote proceeds via distinct establishment and maintenance phases. Development 2003; 130 : 1255–65. 7. Doe CQ. Molecular markers for identified neuroblasts and ganglion mother cells in the Drosophila central nervous system. Development 1992; 116 : 855–63. 8. Schober M, Schaefer M, Knoblich JA. Bazooka recruits Inscuteable to orient asymmetric cell divisions in Drosophila neuroblasts. Nature 1999; 402 : 548–51. 9. Lu B, Rothenberg M, Jan LY, Jan YN. Partner of Numb colocalizes with Numb during mitosis and directs Numb asymmetric localization in Drosophila neural and muscle progenitors. Cell 1998; 95 : 225–35. 10. Kuang S, Kuroda K, Le Grand F, Rudnicki MA. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell 2007; 129 : 999–1010. 11. Shinin V, Gayraud-Morel B, Gomes D, Tajbakhsh S. Asymmetric division and cosegregation of template DNA strands in adult muscle satellite cells. Nat Cell Biol 2006; 8 : 677–87. 12. Noctor SC, Martinez-Cerdeno V, Ivic L, Kriegstein AR. Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat Neurosci 2004; 7 : 136–44. 13. Wu M, Kwon HY, Rattis F, et al. Imaging hematopoietic precursor division in real time. Cell Stem Cell 2007; 1 : 541–54. 14. Lechler T, Fuchs E. Asymmetric cell divisions promote stratification and differentiation of mammalian skin. Nature 2005; 437 : 275–80. 15. Costa MR, Wen G, Lepier A, et al. Par-complex proteins promote proliferative progenitor divisions in the developing mouse cerebral cortex. Development 2008; 135 : 11–22. 16. Labbé JC, McCarthy EK, Goldstein B. The forces that position a mitotic spindle asymmetrically are tethered until after the time of spindle assembly. J Cell Biol 2004; 167 : 245–56. 17. Gotta M, Ahringer J. Distinct roles for Galpha and Gbetagamma in regulating spindle position and orientation in Caenorhabditis elegans embryos. Nat Cell Biol 2001; 3 : 297–300. 18. Srinivasan DG, Fisk RM, Xu H, van den Heuvel S. A complex of LIN-5 and GPR proteins regulates G protein signaling and spindle function in C. elegans. Genes Dev 2003; 17 : 1225–39. 19. Schaefer M, Shevchenko A, Knoblich JA. A protein complex containing Inscuteable and the Galpha-binding protein Pins orients asymmetric cell divisions in Drosophila. Curr Biol 2000; 10 : 353–62. 20. Wodarz A, Ramrath A, Kuchinke U, Knust E. Bazooka provides an apical cue for Inscuteable localization in Drosophila neuroblasts. Nature 1999; 402 : 544–7. 21. Sanada K, Tsai LH. G protein betagamma subunits and AGS3 control spindle orientation and asymmetric cell fate of cerebral cortical progenitors. Cell 2005; 122 : 119–31. 22. Zigman M, Cayouette M, Charalambous C, et al. Mammalian inscuteable regulates spindle orientation and cell fate in the developing retina. Neuron 2005; 48 : 539–45. 23. Mello CC, Schubert C, Draper B, et al. The PIE-1 protein and germline specification in C. elegans embryos.Nature 1996; 382 : 710–2. 24. Strome S, Wood WB. Generation of asymmetry and segregation of germ-line granules in early C. elegans embryos. Cell 1983; 35 : 15–25. 25. Reese KJ, Dunn MA, Waddle JA, Seydoux G. Asymmetric segregation of PIE-1 in C. elegans is mediated by two complementary mechanisms that act through separate PIE-1 protein domains. Mol Cell 2000; 6 : 445–55. 26. Betschinger J, Mechtler K, Knoblich JA. The Par complex directs asymmetric cell division by phosphorylating the cytoskeletal protein Lgl. Nature 2003; 422 : 326–30. 27. Guo M, Jan LY, Jan YN. Control of daughter cell fates during asymmetric division: interaction of Numb and Notch. Neuron 1996; 17 : 27–41. 28. Choksi SP, Southall TD, Bossing T, et al. Prospero acts as a binary switch between self-renewal and differentiation in Drosophila neural stem cells. Dev Cell 2006; 11 : 775–89. 29. Betschinger J, Mechtler K, Knoblich JA. Asymmetric segregation of the tumor suppressor brat regulates self-renewal in Drosophila neural stem cells. Cell 2006; 124 : 1241–53. 30. Lee CY, Wilkinson BD, Siegrist SE, et al. Brat is a Miranda cargo protein that promotes neuronal differentiation and inhibits neuroblast self-renewal. Dev Cell 2006; 10 : 441–9. 31. Hyenne V, Desrosiers M, Labbé JC. C. elegans Brat homologs regulate PAR protein-dependent polarity and asymmetric cell division. Dev Biol 2008; 321 : 368–78. 32. Caussinus E, Gonzalez C. Induction of tumor growth by altered stem-cell asymmetric division in Drosophila melanogaster. Nat Genet 2005; 37 : 1125–9. 33. Lee CY, Robinson KJ, Doe CQ. Lgl, Pins and aPKC regulate neuroblast self-renewal versus differentiation.Nature 2006; 439 : 594–8. 34. Bowman SK, Neumuller RA, Novatchkova M, et al. The Drosophila NuMA Homolog Mud regulates spindle orientation in asymmetric cell division. Dev Cell 2006; 10 : 731–42. 35. Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med 1997; 3 : 730–7. 36. Al-Hajj M, Wicha MS, Benito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 2003; 100 : 3983–8. 37. Singh SK, Clarke ID, Terasaki M, et al. Identification of a cancer stem cell in human brain tumors. Cancer Res 2003; 63 : 5821–8. 38. Gönczy P. Mechanisms of cell division: lessons from a nematode. Med Sci (Paris) 2003; 19 : 735–42 39. Ségalen M, David N, Bellaïche Y. The heterotrimeric G proteins during asymmetric cell division in Drosophila. Med Sci (Paris) 2006; 22 : 243–6. |