| |
| Med Sci (Paris). 2010 March; 26(3): 241–244. Published online 2010 March 15. doi: 10.1051/medsci/2010263241.
TRPM1, un nouveau gène impliqué dans la cécité nocturne congénitale stationnaire Isabelle Audo,* José-Alain Sahel, Shomi Bhattacharya, and Christina Zeitz* Inserm, UMR S968, CNRS, UMR7210, Université Pierre et Marie Curie Paris 6, Institut de la Vision, 17, rue Moreau, 75012 Paris, France CMR/CIC 503 Inserm, CHNO des Quinze-Vingts, 28, rue de Charenton, 75012 Paris, France MeSH keywords: Calcium, métabolisme, Protéines de liaison au calcium, génétique, Codon non-sens, Gènes récessifs, Humains, Modèles génétiques, Mutation, Héméralopie, congénital, Phénotype, Transduction du signal, Canaux cationiques TRPM |
Les différentes formes de cécité nocturne congénitale Notre équipe et deux autres groupes ont rapporté simultanément en novembre dernier dans le journal American Journal of Human Genetics l’implication du gène TRPM1
(Transient receptor potential cation channel subfamily M member 1) dans une forme particulière de cécité nocturne congénitale stationnaire (CNCS), la forme complète [
1–
3]. La cécité nocturne congénitale est une dysfonction rétinienne héréditaire non évolutive, dont un type particulier, décrit par Schubert et Bornschein, se caractérise par un défaut de transmission entre le photorécepteur, premier neurone de la rétine intervenant dans la transduction du signal visuel, et la cellule bipolaire, deuxième neurone rétinien. Il existe deux types de cellules bipolaires, les cellules bipolaires-ON, qui se dépolarisent au début d’un flash lumineux, et les cellules bipolaires-OFF, qui s’hyperpolarisent à l’extinction du flash lumineux. La CNCS de type Schubert-Bornschein se manifeste par une réponse caractéristique, électronégative, de l’électrorétinogramme (ERG) après stimulation par un flash intense dans les conditions d’adaptation à l’obscurité (réponse scotopique mixte). L’onde a (déflection négative) est normale, reflétant la fonction normale des photorécepteurs, alors que l’onde b (déflection positive) est très diminuée, reflétant le défaut de transmission aux cellules bipolaires [
4]. L’hérédité de la CNCS de type Schubert-Borschein peut être soit liée au chromosome X, soit autosomique récessive. Les patients atteints manifestent à des degrés variables des troubles de la vision nocturne, une baisse de l’acuité visuelle, une myopie forte, un nystagmus et un strabisme. L’ERG, pratiqué selon les recommandations de la société internationale d’électrophysiologie visuelle clinique (ISCEV-International society of clinical electrophysiology of vision) est l’examen clef pour le diagnostic. Il permet de distinguer deux formes, complète et incomplète, de CNCS, en fonction de la réponse à un flash d’intensité faible dans les conditions scotopiques1 [
5]. La forme complète (CNCSc) se caractérise par l’absence de réponse discernable au flash d’intensité faible délivré dans les conditions scotopiques. Elle correspond à une atteinte sélective de la voie des cellules bipolaires-ON. Elle s’accompagne d’anomalies caractéristiques des réponses photopiques (adaptation de la rétine à la lumière) qui sont la relative conservation des amplitudes mais avec un retard des temps de culmination2, et un aspect d’onde a carrée [4]. Dans la forme incomplète (CNCSic), la réponse à un flash d’intensité faible délivré dans les conditions scotopiques est très diminuée mais présente. Cette forme est liée à une dysfonction à la fois de la voie des cellules bipolaires-ON et -OFF. Elle s’accompagne d’une altération plus importante des réponses photopiques (diminution d’amplitude, retard de temps de culmination et aspect de double pic au 30Hz) [4]. |
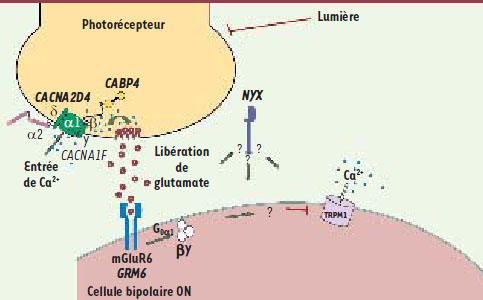
Les gènes impliqués dans les cécités congénitales nocturnes Les avancées de la génétique moléculaire ont permis de mettre en évidence que ces deux formes de CNCS étaient associées à des anomalies génétiques portant sur des gènes distincts avec une bonne corrélation entre le phénotype électrorétinographique et le génotype. En effet, dans les CNCSc, des mutations du gène NYX (Nyctalopin) ont été mises en évidence dans les formes liées à l’X, et du gène GRM6 (glutamate receptor, metabotropic 6) dans les formes autosomiques récessives. Dans les formes incomplètes de CNCS, c’est le gène CACNA1F (calcium channel, voltage-dependent, L type, alpha 1F subunit) qui est muté dans les formes liées à l’X, et les gènes CABP4 (Ca2+-binding protein 4) et CACNA2D4 (calcium channel, voltage-dependent, alpha 2/delta subunit 4) dans les formes autosomiques récessives (voir pour revue [
6], Tableau I et Figure 1). Cependant, malgré l’utilisation de puces de génotypage dédiées aux CNCS pour la détection à haut débit de mutations connues des gènes cités [
7] ou l’approche par séquençage direct des différents gènes connus, l’analyse génétique restait négative dans beaucoup de cas de CNCS, suggérant l’existence d’autres gènes candidats.  | Figure 1.
Transmission du signal visuel des photorécepteurs vers les cellules bipolaires-ON. Les différentes protéines dont la dysfonction conduit à l’héméralopie congénitale stationnaire sont indiquées (modifié de [ 1], © n° 2334770811763). |
 | Tableau I.
Gènes candidats impliqués dans les deux formes phénotypique de cécité nocturne congénitale stationnaire (CNCS) de type Schubert-Bornschein.
|
|
Le cheval Appalloosa permet d’identifier TRPM1, le canal cationique des cellules bipolaires Un modèle équin de CNCS autosomique récessive a été décrit chez le cheval Appalloosa [
8]. Les animaux atteints présentent des anomalies électrorétinographiques suggérant une cécité nocturne [
9]. Ce trait fonctionnel coségrège avec une coloration de la robe du cheval atteint très caractéristique [9]. L’étude de l’expression de certains gènes potentiellement impliqués a mis en évidence une diminution de l’expression du gène TRPM1, également appelé gène de mélanostatine (MLSN1), dans la rétine et la peau des animaux atteints. Ceci suggérait le rôle de ce gène dans l’anomalie de transduction du signal dans les cellules bipolaires et dans les altérations de la fonction mélanocytaire [
10], anomalie que l’analyse directe de la séquence du gène n’a pas encore confirmée chez ce cheval. TRPM1 code pour un canal cationique membranaire appartenant à la famille des canaux à potentiel récepteur transitoire (transient receptor potential ou TRP). Ces canaux permettent l’entrée d’ions Ca2+ dans les cellules hyperpolarisées, ce qui conduit à l’activation de voies de transduction intracellulaires liées au phosphatidylinositol et à la protéine kinase C [
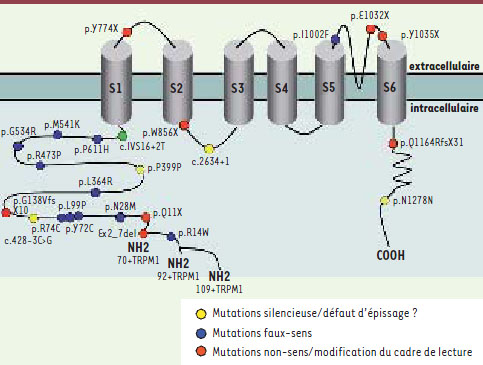
11]. Étant donné la diminution d’expression de TRPM1 chez le cheval Appalloosa atteint de cécité nocturne, il fut suggéré que TRPM1 pouvait jouer un rôle dans la transmission du signal dans les cellules bipolaires en modifiant la concentration de Ca2+ intracellulaire libre. Un argument supplémentaire plaidait en faveur de l’importance de TRPM1 : mGluR6, récepteur métabotropique au glutamate des cellules bipolaires-ON codé par GRM6, également impliqué dans la CNCSc, était couplé à G0a1 et à TRPM1. Il était donc tentant de suggérer que TRPM1 pouvait être le canal cationique des cellules bipolaires-ON, agissant en aval de G0a1, dont l’ouverture serait responsable de l’onde b enregistrée par l’électrorétinogramme (Figure 2) [10].  | Figure 2.
Localisation des mutations rapportées sur les différents domaines de prédiction du canal cationique transmembranaire TRPM1. Modifié de [ 1], © n° 2334770811763 incorporant les mutations rapportées par notre groupe [ 1], ainsi que celles rapportées par Z. Li et al. [
2], et M.M. van Genderen et al. [ 3]. |
|
Mutations de TRPM1 dans les CNCS Au vu de ces éléments, nous avons fait l’hypothèse que TRPM1 pouvait être un bon gène candidat chez les patients atteints de CNCSc. Nous avons donc étudié par séquençage direct 30 fragments amplifiés par PCR couvrant les 27 exons de TRPM1 (RefSeq NM_002420.4, variant 70+TRPM1), 2 fragments correspondant aux 2 exons nouvellement identifiés (exon 1’[variant 92+TRPM1] et exon 0 [variant 109+TRPM1]) et leurs régions introniques flanquantes chez 38 patients atteints de CNCS inclus dans un consortium européen et d’Amérique du Nord [1]. La présence de mutations connues avait été exclue chez la plupart de ces patients [7]. Parmi ces 38 patients, nous en avons détecté dix porteurs de mutations causales dont la pathogénicité fut confirmée par une analyse de coségrégation, quand elle était possible, à partir d’échantillons contrôles et de données de bioinformatique [1]. Les 14 mutations différentes identifiées incluent des mutations non-sens, faux-sens, des délétions avec codon stop prématuré, des mutations dans un site d’épissage et des mutations silencieuses. La localisation des différentes mutations sur la molécule transmembranaire TRPM1 est présentée sur la Figure 1. Pour deux patients, seule une mutation hétérozygote a pu être identifiée suggérant l’existence d’une deuxième mutation dans un site régulateur du gène, ou d’une délétion non détectée par notre approche, ou encore l’implication d’un autre gène. Dans le même numéro de novembre de l’American Journal of Human Genetics, deux autres groupes, l’un anglais [2], l’autre néerlandais [3], décrivent également des mutations de TRPM1 dans leurs cohortes de patients atteints de CNCSc (ces mutations sont également indiquées sur la Figure 2). Le groupe londonien a suivi une approche différente de la nôtre, optant pour une étude par cartographie d’homozygotie dans une famille consanguine [2]. Après avoir identifié une zone homozygote chez les patients atteints, ils ont analysé les gènes candidats de cette région et la littérature les concernant, ce qui les a conduits au choix de TRPM1 comme potentiel candidat. L’étude de 9 familles ayant des membres atteints de CNCSc pour lesquels l’implication de GRM6 et NYX avait été exclue, a conduit à l’identification de 5 mutations causales sur TRPM1. La stratégie du groupe hollandais fut similaire à la nôtre, menant à l’identification de 4 familles et de 7 mutations différentes de TRPM1. L’implication de TRPM1 dans les formes de CNCSc autosomiques récessives et une meilleure caractérisation de son rôle dans la transduction du signal visuel dans les cellules bipolaires-ON enrichissent nos connaissances de la physiologie rétinienne. Des études fonctionnelles sont en cours pour mieux comprendre les conséquences des différents types de mutations de TRPM1 sur la fonction de la protéine. En parallèle, nous poursuivons la caractérisation des différents protagonistes intervenant dans la cascade de signalisation intracellulaire induite par la fixation du glutamate libéré des photorécepteurs sur le récepteur membranaire mGluR6 des cellules bipolaires-ON, jusqu’à la fermeture du canal cationique TRPM1 (Figure 1). Outre une meilleure connaissance de la transduction du signal dans les cellules bipolaires, cette recherche peut aboutir à la découverte de nouveaux gènes candidats et à l’identification de cibles pour l’élaboration d’approches thérapeutiques de ces pathologies. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Audo I, Kohl S, Leroy BP, et al. TRPM1 is mutated in patients with autosomal-recessive complete congenital stationary night blindness. Am J Hum Genet 2009; 85 : 720–9. 2. Li Z, Sergouniotis PI, Michaelides M, et al. Recessive mutations of the gene TRPM1 abrogate ON bipolar cell function and cause complete congenital stationary night blindness in humans. Am J Hum Genet 2009; 85 : 711–9. 3. van Genderen MM, Bijveld MM, Claassen YB, et al. Mutations in TRPM1 are a common cause of complete congenital stationary night blindness. Am J Hum Genet 2009; 85 : 730–6. 4. Audo I, Robson AG, Holder GE, Moore AT. The negative ERG: clinical phenotypes and disease mechanisms of inner retinal dysfunction. Survey Ophthalmol 2008; 53 : 16–40. 5. Miyake Y, Yagasaki K, Horiguchi M, Kawase Y, Kanda T. Congenital stationary night blindness with negative electroretinogram. A new classification. Arch Ophthalmol 1986; 104 : 1013–20. 6. Zeitz C. Molecular genetics and protein function involved in nocturnal vision. Expert Rev Ophthalmol 2007; 2 : 467–85. 7. Zeitz C, Labs S, Lorenz B, et al. Genotyping microarray for CSNB-associated genes. Invest Ophthalmol Vis Sci 2009; 50 : 5919–26. 8. Witzel DA, Smith EL, Wilson RD, Aguirre GD. Congenital stationary night blindness: an animal model. Invest Ophthalmol Vis Sci 1978; 17 : 788–95. 9. Sandmeyer LS, Breaux CB, Archer S, Grahn BH. Clinical and electroretinographic characteristics of congenital stationary night blindness in the Appaloosa and the association with the leopard complex. Veterinary ophthalmology 2007; 10 : 368–375. 10. Bellone RR, Brooks SA, Sandmeyer L, et al. Differential gene expression of TRPM1, the potential cause of congenital stationary night blindness and coat spotting patterns (LP) in the Appaloosa horse (Equus caballus). Genetics 2008; 179 : 1861–70. 11. Clapham DE, Runnels LW, Strubing C. The TRP ion channel family. Nat Rev Neurosci 2001; 2 : 387–96. |