| |
| Med Sci (Paris). 2010 February; 26(2): 205–208. Published online 2010 February 15. doi: 10.1051/medsci/2010262205.Modélisation de la transmission des infections en service hospitalier Identification de « super-propagateurs » Laura Temime* Conservatoire des Arts et Métiers, 292, rue Saint-Martin, 75141 Paris Cedex 03, France MeSH keywords: Infection croisée, transmission, Flambées de maladies, Désinfection des mains, Humains, Transmission de maladie infectieuse du professionnel de santé au patient, prévention et contrôle, statistiques et données numériques, Modèles théoriques, Histoire du 20ème siècle, Mâle, Pedigree, Mutation ponctuelle |
Un modèle mathématique de transmission épidémique dans un service hospitalier de réanimation Plusieurs rapports récents témoignent d’événements dits de « super-propagation » en milieu hospitalier, c’est-à-dire qu’un processus épidémique est attribué à un unique soignant « super-propagateur ». C’est ainsi qu’une épidémie de staphylocoques résistants à l’érythromycine est survenue dans une unité de pédiatrie alors qu’une seule aide-soignante, en contact avec la majorité des enfants hospitalisés, était porteuse du germe [
1]. Dans un autre exemple, une épidémie touchant tout un hôpital, avec 32 cas d’infections par des staphylocoques résistants à la méthicilline (SARM) [
5] a été associée à un seul kinésithérapeute spécialiste des maladies respiratoires qui présentait une sinusite chronique [
2]. Dans un travail récemment publié [
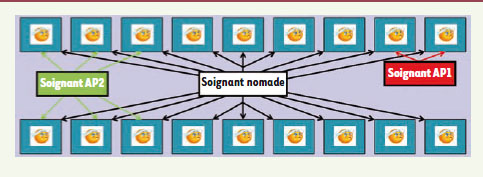
3], nous avons étudié les déterminants de ces événements de super-propagation concernant des bactéries multirésistantes comme les SARM ou les ERV (entérocoques résistants à la vancomycine). Pour cela, nous avons développé et utilisé un modèle mathématique individu-centré appliqué à un service hospitalier de réanimation. La Figure 1 reproduit de manière schématique le service hospitalier modélisé.
 | Figure 1.
Représentation schématique de la modélisation d’un service hospitalier. Il s’agit d’un service de réanimation de 18 chambres simples, dans lequel travaillent 18 soignants de profil AP1 (deux équipes travaillant 12 heures et assimilables à des infirmiers de jour et de nuit), 3 soignants de profil AP2 (assimilables à des médecins), et 1 soignant de profil nomade (par exemple un kinésithérapeute, un technicien de radiologie, etc.). |
Dans ce modèle, le personnel soignant était réparti en trois groupes.
-
Un premier groupe, appelé AP1 (AP = affecté à des patients), où les soignants avaient des contacts fréquents mais avec peu de patients. Lors de ces visites, les soignants avaient un contact physique direct et répété avec les patients. Les caractéristiques du groupe AP1 sont schématiquement assimilables à celles du personnel infirmier dans un service de réanimation.
-
Un deuxième groupe, appelé AP2, où les soignants avaient des contacts moins fréquents mais avec un nombre plus important de patients, et passaient moins de temps en contact physique direct avec les patients. Les caractéristiques du groupe AP2 sont schématiquement assimilables à celles des médecins dans un service de réanimation.
-
Un troisième groupe, celui des soignants « nomades », en contact avec la totalité des patients du service, mais de manière très peu fréquente et avec peu de contacts physiques directs.
Dans le scénario de base, on considérait qu’une observance de 50 % des mesures d’hygiène des mains recommandées par l’hôpital était appliquée uniformément par tous les soignants. Cela signifie que chaque soignant respecte une fois sur deux les mesures d’hygiène des mains lorsqu’il est censé y avoir recours (par exemple avant et après chaque contact avec le patient). Chaque soignant présent dans le service pouvait cependant manquer totalement à l’observance de ces mesures d’hygiène. Lors des simulations, un unique patient porteur d’une bactérie de type SARM ou ERV était introduit dans le service, et la transmission épidémique était suivie pendant un mois. |
Importance du profil des soignants « nomades » dans la transmission de pathogènes nosocomiaux Les prédictions du modèle confirment que le risque nosocomial augmente avec la non-observance des mesures d’hygiène des mains. Dans le scénario de base, le modèle prédit la survenue, en un mois, de 1,5 à 5,8 cas de patients colonisés par le pathogène initialement introduit, en fonction de son épidémicité. Cette taille épidémique augmente de 13 % à 17 % (soit 1,7 à 6,8 cas d’infections pendant le mois de suivi) dans l’hypothèse où l’unique soignant négligerait complètement les mesures d’hygiène. De plus, l’étude met en évidence que cette augmentation est liée de manière très significative au profil des soignants qui ne se plient pas aux règles d’hygiène (Figure 2). C’est ainsi que la taille épidémique totale au cours du mois d’observation était trois fois plus importante lorsque le soignant incriminé était un soignant nomade que lorsque ce soignant était affecté à des patients (profils AP1 ou AP2). Pour un soignant de type AP1 ou AP2, l’augmentation de la taille épidémique attribuable à sa mauvaise observance des règles était de l’ordre de 2 % à 7 % ; si le soignant était de type nomade, cette augmentation pouvait atteindre de 73 % à 238 %.
 | Figure 2.
Résultats de la simulation épidémique. Les histogrammes représentent le nombre total de patients colonisés en un mois, par un pathogène de faible (A) et de forte (B) épidémicité, dans l’hypothèse d’un unique soignant (soignant de profil AP1, AP2 ou nomade) n’observant pas les mesures d’hygiène de mains. Les barres en gris représentent l’impact d’une réduction homogène globale du respect des consignes par tous les soignants de 4,5 % (= 1/22, histogrammes de gauche), ou de 19 % (A) et 23 % (B) (histogrammes de droite). |
Ainsi, le modèle suggère que les soignants de type nomade sont de potentiels « super-propagateurs ». En effet, selon la simulation faite avec notre modèle, si un soignant nomade - représentant 4,5 % de l’ensemble du personnel soignant simulé - n’appliquait aucune observance des règles, il provoquerait une transmission épidémique dans le service similaire à celle qui surviendrait si tous les soignants négligeaient les mesures d’hygiène des mains dans 23 % des situations où elles leur étaient recommandées (Figure 2). On obtient des résultats similaires si l’on prend comme indicateur le risque de transmission secondaire de la colonisation par le pathogène à au moins un deuxième patient. |
En conclusion, ce travail confirme que la non-observance individuelle des mesures recommandées d’hygiène des mains peut être à l’origine d’événements dits de « super-propagation » de pathogènes nosocomiaux. Il souligne de plus que certains soignants présentent un potentiel de super-propagation accru : ceux que nous appelons les soignants nomades. Ces nomades sont définis comme des membres du personnel soignant qui sont amenés, par leur fonction, à être en contact - même brièvement et sans effectuer d’actes traditionnellement associés à un risque élevé de transmission bactérienne - avec un nombre important de patients. On peut penser à des techniciens de radiologie, des kinésithérapeutes, etc. Il est par ailleurs important de garder à l’esprit que, dans un contexte de désorganisation hospitalière occasionnée par un afflux inattendu de patients ou un personnel en sous-effectif, n’importe quel soignant peut être conduit à adopter un comportement nomade. Un tel changement peut être anticipé dans un contexte de pandémie (grippale entre autres), dans la mesure où une désorganisation de certains services hospitaliers peut être observée au plus fort de l’épidémie [
4]. Cette étude suggère que la mesure de l’observance des mesures recommandées d’hygiène de mains via des indicateurs globaux, dont la quantité de solution hydro-alcoolique consommée par les personnels d’un hôpital ou d’un service hospitalier, n’est sans doute pas suffisante pour évaluer le risque global de transmission d’infections nosocomiales [
6]. Il serait sans doute plus pertinent de mettre en place un suivi individualisé. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Back NA, Linnemann CC Jr, Pfaller MA, et al. Recurrent epidemics caused by a single strain of erythromycin-resistant Staphylococcus aureus. The importance of molecular epidemiology. JAMA 1993; 270 : 1329–33. 2. Boyce JM, Opal SM, Potter-Bynoe G, Medeiros AA. Spread of methicillin-resistant Staphylococcus aureus in a hospital after exposure to a health care worker with chronic sinusitis. Clin Infect Dis 1993; 17 : 496–504. 3. Temime L, Opatowski L, Pannet Y, et al. Peripatetic health-care workers as potential superspreaders. Proc Natl Acad Sci USA 2009; 106 : 18420–5. 4. ANZIC Influenza Investigators, Webb SA, Pettilä V, Seppelt I, et al. Critical care services and 2009 H1N1 influenza in Australia and New Zealand. N Engl J Med 2009; 361 : 1925–34. 5. Zahar JR, Bille E, Schnell D, et al. Diffusion communautaire des entérobacteries sécrétrices de bêta-lactamases à spectre élargi. Med Sci (Paris) 2009; 25 : 939–44. 6. Zahar JR. Lutte contre les infections nosocomiales en France : où en sommes-nous en 2007 ? Med Sci
(Paris) 2007; 23 : 644–5. |