Dans la nuit du 16 au 17 juillet 1918, le tsar Nicolas II, sa femme et ses 5 enfants, ainsi que trois domestiques et le médecin personnel du petit Alexis, atteint d’hémophilie, étaient massacrés à Iekaterinbourg. Il fallut presque 100 ans pour authentifier les restes retrouvés dans la forêt voisine de Koptiaki. L’identification des ADN nucléaires et mitochondriaux de tous les membres de la famille Romanov mettait un point final, sur le plan biologique, à cette tragique histoire avec, pour épilogue, la canonisation de toute la famille par l’église orthodoxe russe et l’édification sur les hauteurs de Iekaterinbourg de l’église Sur-le-Sang-Versé, aujourd’hui lieu de commémorations et de pèlerinages [ 1].
Pourtant, il manquait encore une pièce à ce puzzle génomique : la nature moléculaire de l’hémophilie du petit tsarévitch. Nombreux sont les historiens qui estiment que la maladie d’Alexis, seul héritier du trône, a influencé défavorablement la cascade d’évènements qui se succédèrent au cours de la révolution de 1917. Plus sévère que celle de ses cousins espagnols (hémorragie ombilicale à 6 mois, hématomes nombreux au cours des premières années, hémarthrose du genou), elle a suscité chez sa mère, la tsarine Alexandra, une inquiétude d’autant plus vive que celle-ci connaissait parfaitement la gravité de la maladie (responsable de la mort d’un de ses frères, Freidrich, à l’âge de trois ans et d’un de ses neveux, Heinrich, à l’âge de quatre ans). À partir de 1907, la présence de Raspoutine, très mal perçue par l’opinion, a semblé bénéfique sur l’évolution de la maladie. Sa décision de suspendre toute médication, dont l’aspirine, qui, on le sait, aggrave les saignements chez les hémophiles, expliquerait pour certains historiens la relative amélioration.
Cette hémophilie, qui avait touché les cours de Hesse, de Russie et d’Espagne jusqu’au début du XXe siècle avait, on le sait, été transmise par la reine Victoria. Du reste, son arbre généalogique a souvent servi d’exemple de transmission de l’hémophilie et nous est devenu familier, alors que paradoxalement la mutation royale et le type même de l’hémophilie étaient restés inconnus et pour cause : aucun des descendants vivant aujourd’hui n’en étant plus porteur, il était impossible de l’identifier sauf à la rechercher dans l’ADN d’Alexis et dans celui de sa mère (petite-fille de la reine Victoria), ce qui vient d’être réalisé.
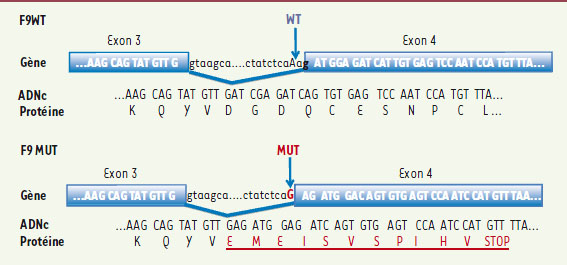
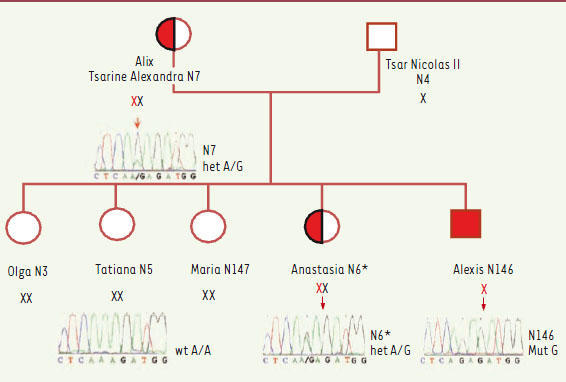
L’étude, effectuée par des généticiens russes et américains, fournit des résultats concluants [ 2]. Aucune mutation n’a été trouvée dans le gène codant pour le facteur VIII (hémophilie A). En revanche, et après avoir amplifié l’ADN par PCR multiplex en raison de la faible quantité à disposition, les chercheurs ont trouvé, dans le gène codant pour le facteur IX (F9) (hémophilie B), une substitution A->G localisée dans un intron, à 3 pb de l’exon 4 : IVS3-3A->G en position en position 10389. Or, ce nucléotide est très conservé dans l’évolution et l’étude des transcrits (par piégeage d’exon, combiné au MPS ou massive parallel sequencing) montre que la mutation crée un nouveau site d’épissage préférentiel en IVS3-3 avec glissement du cadre de lecture aboutissant à un codon stop prématuré (98 % des transcrits sont générés par ce site et produisent une protéine tronquée) (Figure 1). Ceci explique la gravité de l’hémophilie d’Alexis qui ne devait posséder que 1 % de facteur IX normal. L’analyse moléculaire montre que Alexis est hémizygote pour la mutation tandis que sa mère est hétérozygote. Parmi les quatre filles, une seule était hétérozygote, celle qui est présumée être la princesse Alexandra (Figure 2).
Reste encore une interrogation : avant la reine Victoria, qui a transmis la maladie à trois de ses neuf enfants, aucun cas d’hémophilie n’avait été observé chez ses ascendants. Sans doute s’agit-il d’une mutation de novo chez le père, le prince Edward Augustus (il avait 52 ans quand Victoria fut conçue). À moins que, comme le suggèrent certains livres très prisés par les lecteurs de la press people [ 3], la reine Victoria ait été une enfant illégitime (il semble en effet que sa mère, la princesse Viktoria de Saxe Cobourg Saalfeld ait eu une relation avec son secrétaire, Sir Conroy).
Contrairement à ce qu’auraient pu supposer ces mêmes lecteurs, la « mutation royale » n’est pas unique au monde. Elle avait déjà été observée dans deux cas d’hémophilie B sévère, aux États-Unis dans une famille originaire de l’Europe du Nord-Ouest [ 4, 5], et plus récemment dans une famille espagnole [ 6]. Dans les deux cas il s’agit d’une mutation de novo. Il est donc inutile de rechercher un effet fondateur qui relierait ces deux familles roturières à la famille royale d’Angleterre.
Du point de vue scientifique, la découverte de nouveaux cas d’hémophilie B par une mutation sur un site d’épissage déjà rapportée ne mériterait pas publication. Mais ce travail, en utilisant les techniques de génomique actuelles qui remportent des succès sur des ADN encore bien plus anciens [ 7], a eu le mérite d’obtenir des résultats à partir de corps partiellement détruits par le feu et l’acide sulfurique. Et les lecteurs sont toujours friands, même s’ils s’en défendent, de ces retours anecdotiques sur le passé.