| |
| Med Sci (Paris). 2010 February; 26(2): 185–192. Published online 2010 February 15. doi: 10.1051/medsci/2010262185.Lymphocytes Tγδ en cancérologie Des lymphocytes tueurs non conventionnels Véronique Catros,1* Olivier Toutirais,1 Françoise Bouet,1 Florian Cabillic,1 Mireille Desille,1 and Jean-Jacques Fournié2 1EE 341 Biothérapies innovantes, Université de Rennes 1, Faculté de Médecine de Rennes, 2, avenue du Pr. L. Bernard, Rennes Cedex 35043, France 2Inserm U563, CPTP, CHU Purpan, 31000 Toulouse, France |
Les cellules effectrices du système immunitaire détruisent les cellules tumorales Il a été établi il y a presque 30 ans que les cellules effectrices du système immunitaire sont capables d’infiltrer le tissu tumoral et de défendre l’organisme contre l’invasion tumorale en lysant spécifiquement les cellules transformées [
1]. La majorité des travaux publiés porte sur les lymphocytes T conventionnels (Tαβ) dont l’intérêt médical a été établi grâce à des essais cliniques de transfert adoptif [
2]. Cependant, d’autres sous-populations lymphocytaires - dites non conventionnelles - telles que les cellules natural killer (NK), NKT et Tγδ infiltrent aussi le tissu tumoral et sont également capables de lyser les cellules cancéreuses humaines. Les lymphocytes T non conventionnels reconnaissent leur cible de façon indépendante des molécules de CMH (complexe majeur d’histocompatibilité) et présentent souvent un phénotype de lymphoyte T mémoire. Les lymphocytes mémoires se caractérisent par une rapidité d’intervention qui normalement est un attribut du système immunitaire inné. Ces sous-populations de lymphocytes T non conventionnels sont minoritaires dans les localisations lymphoïdes classiques (ganglions), mais abondantes dans certains tissus, notamment épithéliaux. |
Les lymphocytes Tγδ : phénotype et fonction Des lymphocytes non conventionnels avec un TCR canonique Les lymphocytes Tγδ expriment un récepteur de reconnaissance des antigènes ( T cell receptor ou TCR). À la différence des Tαβ, ils expriment rarement les corécepteurs CD4 ou CD8, dont le rôle est de renforcer l’interaction avec les molécules du CMH classiques. Ils partagent avec les Tαβ un précurseur thymique commun. Comme le TCRαβ, le TCR γδ fonctionne au sein d’un complexe associant un module de reconnaissance TCR au module de transduction CD3 1. La diversité du TCRγδ est moins importante que celle du TCRαβ, bien que l’organisation de base des locus du TCRγδ soit similaire à celle du TCRαβ [
3]. Elle est assurée par recombinaison somatique aléatoire des segments géniques V-(D)-J des gènes codant pour les chaînes γ et δ. L’hétérodimère γδ provenant d’une combinatoire d’expression restreinte confère aux TCRγδ un répertoire limité. Chaque réarrangement constitue une sous-population particulière par son récepteur (chaque cellule n’exprime qu’un seul type de récepteur) mais aussi par sa localisation tissulaire. Chez l’homme ou le primate, mais pas chez les rongeurs, les Tγδ exprimés présentent des associations privilégiées comme Vγ9 avec Vδ2 (T Vγ9Vδ2) ou comme celle des chaînes Vγ2, Vγ3, Vγ4, Vγ5 et Vγ8 avec des chaînes Vδ1 (populations VγIVδ1, dites non-δ2). Chez l’adulte sain, les T Vγ9Vδ2 sont retrouvés électivement dans le sang périphérique alors que les Vδ1 sont fréquents dans l’intestin. La sous-population T Vγ9Vδ2 présente des séquences de jonction identiques et exprime un TCR composé d’une chaîne Vγ9-JγP-Cγ1 et d’une chaîne Vδ2-Jδ1-Cδ qui lui confère une capacité de reconnaissance « canonique » pour des petites molécules non peptidiques extrêmement conservées dans l’évolution. Ces dernières sont des antigènes du « soi » ou étrangers appelés phosphoantigènes (PAg).
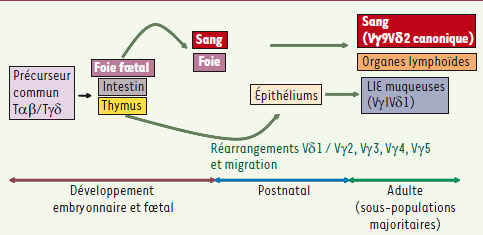
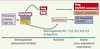 | Figure 1.
Sous-populations lymphocytaires Tγδchez l’homme. Les lymphocytes Tγδ sont les premiers lymphocytes T à se développer. Les réarrangements des gènes du TCRγδ sont détectés dès la 8e semaine du développement fœtal. Une première vague de migration vers le sang et le foie intervient au cours du développement fœtal et concerne les sous-populations Vγ9Vδ2. Après la naissance, les réarrangements impliquent les segments géniques Vδ1 (plus rarement Vδ3 ou Vδ5) dont les localisations anatomiques seront principalement épithéliales. Au stade adulte, la sous-population sanguine majoritaire est de type Vγ9Vδ2 avec un répertoire oligoclonal. Elle reconnaît des phosphoantigènes. Les lymphocytes Tγδ intraépithéliaux (LIE) intestinaux sont des Vδ1/VγI. Les LIE reconnaissent des antigènes de stress (MICA/MICB ou major histocompatibility complex [MHC] class I chain-related) mais la nature des interactions TCR-antigène est encore mal connue. |
L’activation des T Vγ9Vδ2 par des phosphoantigènes du soi ou étrangers Bien que habituellement minoritaires dans le sang (3 % des lymphocytes T), les T Vγ9Vδ2 peuvent proliférer rapidement en réponse à une infection par des pathogènes bactériens ou parasitaires, voire même en présence de cellules tumorales. C’est en utilisant des extraits de Mycobacterium tuberculosis que les PAg ont pu être identifiés dès 1994 comme des ligands naturels des T Vγ9Vδ2 [
4]. Ce sont des petits métabolites phosphorylés permettant la biosynthèse des isoprénoïdes 2, par la voie du DOXP (1-déoxy-D-xylulose 5-phosphate) chez les eubactéries ou les protozoaires et par la voie du mévalonate dans les cellules humaines cancéreuses (Figure 2). Le PAg naturel des T Vγ9Vδ2 dans les cellules tumorales est l’isopentényl pyrophosphate (IPP) 3 dont la biosynthèse est très amplifiée dans les cellules cancéreuses [
5].
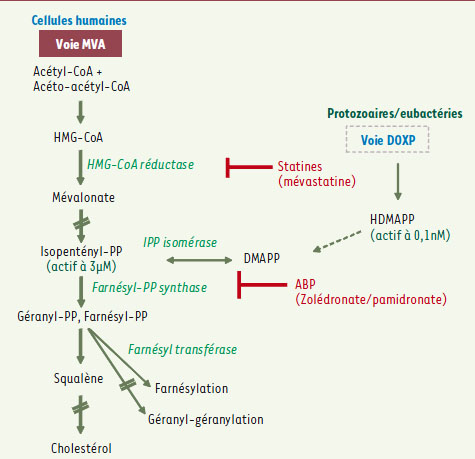
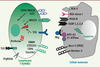
 | Figure 2.
Voies de biosynthèse des isoprénoïdes produisant des PAg. Chez les protozoaires et les eubactéries, la voie DOXP (1-déoxy-D-xylulose-5-phosphate) produit de l’HDMAPP (4-hydroxy-diméthylallyl pyrophosphate) qui active les T Vγ9Vδ2 à des concentrations de 100 pM et confère une très grande sensibilité aux cellules infectées. Dans les cellules eucaryotes animales, les archébactéries et certaines eubactéries, la voie du mévalonate (MVA) produit de l’IPP (isopentényl pyrophosphate) qui n’active les T Vγ9Vδ2 qu’à des concentrations 104 fois supérieures. Les antibiphosphonates (ABP) comme le zolédronate ou le pamidronate inhibent la farnésylpyrophosphate synthase (FPP-synthase), ce qui a pour effet d’augmenter la concentration de phosphoantigène IPP et en conséquence la reconnaissance par les T Vγ9Vδ2. Les statines comme la mévastatine inhibent l’HMG-CoA réductase et réduisent la concentration d’IPP. Les ABP sont utilisées classiquement dans le traitement des affections osseuses malignes. |
Les PAg microbiens ont servi de modèle pour la recherche d’analogues synthétiques capables d’activer les T Vγ9Vδ2. De puissants PAg de synthèse sont maintenant disponibles et produits en conditions GMP (good manufacturing procedure), par exemple le BrHPP (Bromohydrine-pyrophosphate ou Phosphostim™, Innate Pharma, Marseille, France) ou le C-HDMAPP (Picostim™) [
6]. Les aminobiphosphonates (ABP)4 inhibiteurs de la voie du mévalonate sont d’autres analogues de synthèse qui déclenchent indirectement la production d’IPP intracellulaire et activent ainsi les lymphocytes γδ (Figure 2). Cependant, si le traitement de cellules tumorales par ABP amplifie leur lyse par les T Vγ9Vδ2 [
7], cet effet est abrogé par les statines [
8]. La présence d’interleukine (IL)-2 est indispensable à l’expansion ex vivo ou in vivo des T Vγ9Vδ2 provoqué par les PAg. Synapse immunologique et activation des T Vγ9Vδ2 Les PAg sont reconnus par le lymphocyte Tγδ à l’occasion de contacts étroits avec la cellule cible (contacts formant une synapse immunologique). La capacité d’adhérence et de déformabilité des T Vγ9Vδ2 pour explorer la surface de leur cible est remarquable. Le mode de présentation de l’IPP demeure inconnu. On suspecte sa présentation par un complexe membranaire de F1-ATPase/apoA-1, une modification de structures membranaires, ou la production d’un conjugué de stockage (APPPI) 5 [
9]. En plus de la reconnaissance des PAg par le TCRγδ, d’autres molécules complètent l’interaction entre l’effecteur et sa cible. Des récepteurs NK (NKR activateurs ou inhibiteurs) caractéristiques de l’immunité innée sont exprimés à la surface des T Vγ9Vδ2. Les NKR activateurs NKG2D reconnaissent des molécules de stress exprimées par certaines cellules tumorales (Figure 3). De surcroît, les mécanismes de lyse médiés par les T Vγ9Vδ2 impliquent la molécule d’adhérence DNAM-1 (DNAX accessory molecule-1), une glycoprotéine initialement décrite à la surface des cellules NK [
10]. La capacité fonctionnelle effectrice des T Vγ9Vδ2 correspond à l’intégration de tous ces signaux qui modulent leur activation et conditionnent la lyse de la cellule cible (Figure 3).
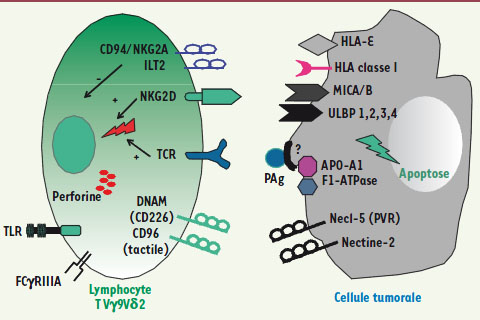
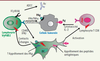
 | Figure 3.
Molécules impliquées dans la reconnaissance des cellules tumorales par les T Vγ9Vδ2. Outre la reconnaissance des PAg par le TCRγδ, d’autres molécules complètent l’interaction entre l’effecteur et sa cible. Les NKR activateurs NKG2D peuvent reconnaître des molécules de stress comme MICA/MICB (MHC class I chain-related A and B) ou UL16 binding protein 1-4 (ULBP). Les T Vγ9Vδ2 amplifiés peuvent également présenter des NKR inhibiteurs, comme CD94/NKG2A ou B (ligands CMH I, HLA-E). Des récepteurs aux TLR (toll-like receptor) comme TLR3 reconnaissent des signaux de danger. DNAM-1 (DNAX accessory molecule-1) interagit avec ses ligands Nectine-2 et Necl-5 (poliovirus receptor, PVR). CD96 est un récepteur additionnel de Necl-5. |
Après une stimulation antigénique, les T Vγ9Vδ2 sécrètent de fortes quantités de cytokines pro-inflammatoires [interféron (IFN)γ et tumor necrosis factor (TNF)-α], surexpriment le récepteur de l’IL-2 et se différencient en cellules cytotoxiques. Après activation, leurs granules lytiques s’orientent en direction du point de contact focal avec leur cible dans laquelle ils déversent des granzymes A/B grâce à l’action de perforines [
11]. Les lymphocytes T régulateurs FoxP3+ s’opposent à la stimulation des T Vγ9Vδ2. À l’inverse, lorsqu’elles sont activées par des PAg puissants et donc en supériorité numérique, les cellules T Vγ9Vδ2 préviennent l’expansion et l’effet suppresseur des lymphocytes T régulateurs [
12]. La formation de la synapse et l’adaptation fonctionnelle des T Vγ9Vδ2 nécessitent un remodelage rapide de leur cytosquelette. L’amplification des T Vγ9Vδ2 Les PAg de synthèse et les aminobiphosphonates ont été évalués pour leur aptitude à induire l’expansion in vitro ou in vivo de T Vγ9Vδ2. Un protocole d’expansion basé sur un traitement des cellules mononucléées sanguines par une dose unique de Phosphostim™ et l’adjonction régulière d’IL-2 a été standardisé dans le cadre de collaborations entre la société Innate Pharma et des laboratoires académiques [
13]. Il permet l’obtention de plusieurs milliards de cellules T Vγ9Vδ2 en 15 jours à partir de 100 ml de sang dans des conditions compatibles avec leur usage clinique. Ces cellules expriment un phénotype intermédiaire entre celui de cellules mémoires centrales et d’effecteurs mémoires Th1 (Figure 4). L’application du procédé à des cellules issues de sang de patients atteints d’une tumeur hépatique ou d’une tumeur rénale permet de générer des cellules présentant majoritairement un phénotype effecteur mémoire Th1 [ 7,
14] et des capacités fonctionnelles évoluant au cours de la culture. Les lymphocytes amplifiés expriment les récepteurs de chimiokines CXCR3 et CCR5 qui permettront leur migration vers les sites inflammatoires. En fonction de leur microenvironnement d’origine ou des cytokines ajoutées au cours de la culture, les T Vγ9Vδ2 d’origine sanguine ou tumorale peuvent présenter un phénotype différencié et des capacités de migration différentes [ 14]. En présence d’IL-15, les cellules produites peuvent exprimer à nouveau l’antigène CD45RA 6 en fin de culture (T EMRA). Ces T EMRA expriment le récepteur CD16 (ou FcγRIII) qui confère aux T Vγ9Vδ2 une capacité d’ADCC ( antibody-dependent cell-mediated cytotoxicity). Ce mécanisme amplifie la lyse des cellules cibles en présence d’anticorps spécifiques [
15].
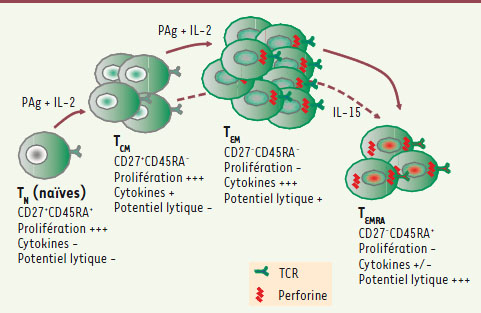
 | Figure 4.
Phénotypes et caractéristiques fonctionnelles principales des sous-populations de cellules T Vγ9Vδ2 en culture. TN : lymphocytes naïfs, TCM : lymphocytes à mémoire centraux, TEM : lymphocytes effecteurs à mémoire, TEMRA : lymphocytes à mémoire en différenciation terminale. |
|
Utilisation des lymphocytes T Vγ9Vδ2 en thérapeutique anticancéreuse Arguments précliniques pour l’utilisation thérapeutique des T Vγ9Vδ2 Les arguments directs ou indirects de la participation des T Vγ9Vδ2 au contrôle immunitaire des cellules tumorales sont nombreux et variés. Des lymphocytes Tγδ ont été détectés parmi les lymphocytes infiltrant des tumeurs solides [
16] et dans des liquides d’ascite [ 8]. L’augmentation de leur nombre dans ces infiltrats a été rapportée lors des réponses thérapeutiques à une BCG-thérapie. Progressivement, des données se sont accumulées montrant que des lignées de lymphomes ou de myélome reconnues et lysées par les Tγδ étaient également capables d’entraîner leur expansion ex vivo. Les lignées établies à partir de tumeurs solides sont également sensibles à la lyse in vitro par les cellules T Vγ9Vδ2. Cette reconnaissance a initialement été établie à partir de cellules de carcinomes œsophagiens [
17] puis étendue à bien d’autres types histologiques de tumeur [ 7]. Des cellules T Vγ9Vδ2 clonées à partir de liquide d’ascite chez un patient atteint d’un carcinome colorectal sont capables de lyser des lignées allogéniques de carcinome colique sans affecter des fibroblastes coliques normaux [ 8]. Des expériences de même nature ont été faites avec des T Vγ9Vδ2 amplifiées à l’aide de Phosphostim™ puis exposées à des cellules isolées de patients atteints de carcinome rénal ; elles ont entraîné une lyse des cellules tumorales autologues maintenues en culture plus importante que la lyse des cellules rénales normales [
18]. Plus récemment, notre groupe a montré que des T Vγ9Vδ2 autologues lysent les cellules d’hépatocarcinome primaire ou issues de métastase hépatique de carcinome colorectal isolées rapidement à partir de biopsies tumorales, et ceci sans affecter les cellules saines autologues correspondantes [ 7]. Dans la logique de ces travaux, des expériences de transfert adoptif de T Vγ9Vδ2 humains ont également été réalisés chez des souris immunodéficientes greffées avec des tumeurs humaines. Ces traitements administrés conjointement à de l’IL-2 et répétés se sont montrés efficaces sur le volume tumoral et la survie des souris, et l’infiltration des tumeurs par les cellules injectées a pu être détectée [
19]. L’efficacité des Tγδ à lyser les cellules tumorales ex vivo, leur efficacité sur un large panel de tumeurs sans qu’il soit nécessaire de connaître l’antigène de tumeur ou le contexte du CMH du patient, leur expansion à partir d’un simple prélèvement sanguin sont autant d’arguments justifiant des essais cliniques centrés sur l’activation des T Vγ9Vδ2. Essais cliniques d’immunothérapie centrés sur l’activation de T Vγ9Vδ2 Il n’y a actuellement que très peu d’essais cliniques visant à activer ou amplifier les T Vγ9Vδ2 chez des patients atteints de cancer. Ces stratégies d’immunothérapie sont menées soit en utilisant des agonistes de grade clinique, soit par transfert adoptif de ces cellules. Le premier essai utilisant des agonistes a été réalisé en Allemagne et incluait 19 patients atteints de lymphome non hodgkinien (LNH) ou de myélome multiple [
20]. Tous étaient en rechute de leur maladie. L’essai combinait des injections intraveineuses (IV) de pamidronate, un ABP, et d’IL-2. Trois patients ont présenté une réponse objective partielle et deux une stabilisation. Un essai clinique fondé sur le même principe a été mené chez des patients atteints de cancers de la prostate hormono-indépendants [
21]. Dix-huit patients ayant une tumeur métastatique ont été traités par du zolédronate IV et 9 d’entre eux ont reçu des injections sous-cutanées d’IL-2. Trois réponses objectives et 5 stabilisations ont été observées. Une corrélation entre le pourcentage de Tγδ périphériques, les taux sériques d’un indicateur d’apoptose (TRAIL, TNF-related-apoptosis-inducing-ligand) et la chute du marqueur sanguin du cancer de la prostate (PSA, prostate specific antigen) a été établie. De la même manière, deux essais ont été menés avec le Phosphostim™ en combinaison avec de l’IL-2. Il s’agissait d’études de phase I conduites en escalade de dose d’une part chez 28 patients présentant pour la majorité d’entre eux un cancer du rein métastatique, et d’autre part chez des patients en rechute d’un lymphome. La bonne tolérance du produit et l’amplification de la population T Vγ9Vδ2 avec une relation dose-effet ont été démontrées. L’étude a permis de définir la dose retenue pour la poursuite actuelle du développement du Phosphostim™ dans des essais de phase II dans les carcinomes rénaux ainsi que dans les lymphomes folliculaires dans le cadre d’un essai en association avec l’anticorps thérapeutique Rituxan™ [36]. Par ailleurs, deux essais de thérapie cellulaire par transfert adoptif de Tγδ ont été réalisés chez des patients atteints de carcinomes rénaux. Dans le premier, 7 patients ont été inclus et ont reçu 6 à 12 injections IV de 0, 3 à 3 milliards de Tγδ sur une durée de 12 semaines [
22]. Sur les 5 patients qui ont pu être évalués, 3 ont présenté une réponse objective. L’autre essai a été réalisé à Nantes chez 10 patients dont 6 ont présenté une stabilisation [
23]. Les injections répétées de Tγδ ont été bien tolérées jusqu’à la dose limitante de 8 milliards de cellules. L’étude rapporte que pour inclure 10 patients, 36 patients ont été préinclus. Pour 17 d’entre eux l’amplification ex vivo des T Vγ9Vδ2 n’a pas pu être obtenue avec le protocole standardisé. La non-réponse de certains patients aux PAg est une difficulté qui devra être surmontée pour avancer dans l’expérimentation clinique des T Vγ9Vδ2. Il est important de poursuivre la recherche immunologique en clinique humaine malgré sa complexité [
24]. Les cellules dendritiques au secours des Tγδ des patients non répondeurs À l’issue de ces essais cliniques pionniers, de nombreuses questions doivent être résolues pour optimiser l’impact des T Vγ9Vδ2 en cancérologie. Les patients non répondeurs aux PAg ou aux ABP représentent un de ces obstacles. Des hypothèses ont été formulées pour expliquer cette absence de réponse et sont à l’étude : l’induction d’une anergie par des lymphocytes T régulateurs [
25], l’existence d’une anomalie des T Vγ9Vδ2 ou l’épuisement des sous-populations T Vγ9Vδ2 mémoires [
26] chez des patients cancéreux. Pour pallier les difficultés d’expansion des T Vγ9Vδ2, des essais en présence de cytokines comme l’IL-15 [ 14] ou l’IL-21 [
27] sont évalués, mais une voie particulièrement prometteuse semble celle de leur costimulation par des cellules dendritiques. Les cellules dendritiques jouent un rôle d’interface entre l’immunité innée et l’immunité adaptative et des échanges réciproques de signaux et de cytokines entre les deux types cellulaires permettent l’amplification des Tγδ [
28] (Figure 5). Ces échanges permettent également la maturation des cellules dendritiques qui peuvent ainsi enclencher une réponse spécifique [ 28]. La réponse spécifique T CD8 est amplifiée par la présence de T Vγ9Vδ2 [
29].
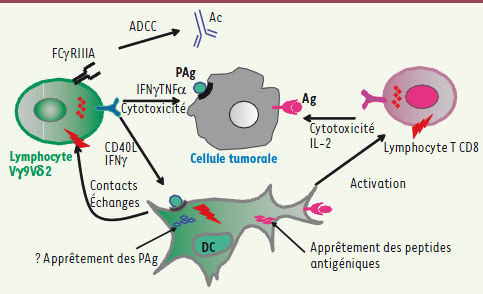
 | Figure 5.
Fonctions des T Vγ9Vδ2 dans la réponse antitumorale. Des échanges réciproques de signaux et de cytokines favorisent l’amplification des T Vγ9Vδ2 et la maturation des cellules dendritiques (DC). Les DC une fois matures sont capables d’apprêter les peptides antigéniques et d’activer les lymphocytes Tαβ spécifiques d’antigène (T CD8). Les T Vγ9Vδ2 produisent des cytokines Th1 et sont capables de lyser les cellules tumorales par reconnaissance des PAg qu’elles expriment. Les T Vγ9Vδ2 participent à la cytotoxicité cellulaire médiée par les anticorps (ADCC). Les flèches rouges correspondent à un signal d’activation. |
Il faut préciser aussi que dans certaines conditions d’activation, les T Vγ9Vδ2 sont capables de trogocytose, un mécanisme actif et rapide, mais encore mal connu, qui leur permet de capturer des fragments de membrane de leurs cibles et de s’approprier ainsi leurs molécules membranaires [
30]. Ce mécanisme a été décrit comme impliqué dans le contrôle de l’activation des cellules NK [
31]. On peut suggérer qu’il participe également à l’acquisition de fonctions présentatrices d’antigènes par les T Vγ9Vδ2 permettant ainsi l’activation d’une réponse spécifique Tαβ [
32]. Une voie alternative pour améliorer l’utilisation de ces effecteurs en immunothérapie sera de prévenir les effets inhibiteurs des lymphocytes T régulateurs [12]. Pour cela, une lymphodéplétion de nature similaire à celle employée pour révéler l’efficacité d’un transfert adoptif de Tαβ pourrait être envisagée [2]. |
Conclusion : les Tγδ : une étape clé pour un ciblage immunologique des cellules tumorales Les T Vγ9Vδ2 sont donc d’importantes cellules effectrices cytotoxiques de l’immunité antitumorale. Elles sécrètent des cytokines et échangent des fragments de membranes avec leurs cellules cibles qui leur présentent des PAg. Elles peuvent participer à la différenciation des cellules initiatrices de la réponse adaptative et nous rappellent ainsi que systèmes immunitaires inné et adaptatif ont un fonctionnement intégré et interdépendant. Pour améliorer l’efficacité des immunothérapies, il est indispensable d’orchestrer de façon optimale l’activité de cellules effectrices distinctes. Transfert adoptif, vaccination et anticorps thérapeutiques peuvent être combinés, afin de relayer les chimiothérapies ou radiothérapies immunogènes par l’immunociblage des tumeurs [
33,
34]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Catros-Quemener V, Bouet F, Genetet N. Immunité antitumorale et thérapies cellulaires du cancer. Med Sci (Paris) 2003; 19 : 43–53. 2. Dudley ME, Wunderlich JR, Yang JC, et al. Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J Clin Oncol 2005; 23 : 2346–57. 3. Hayday AC. Gamma-delta cells: a right time and a right place for a conserved third way of protection. Annu Rev Immunol 2000; 18 : 975–1026. 4. Constant P, Davodeau F, Peyrat MA, et al. Stimulation of human gamma delta T cells by nonpeptidic mycobacterial ligands. Science 1994; 264 : 267–70. 5. Gober HJ, Kistowska M, Angman L, et al. Human T cell receptor γδ cells recognize endogenous mevalonate metabolites in tumor cells. J Exp Med 2003; 197 : 163–8. 6. Boedec A, Sicard H, Dessolin J, et al. Synthesis and biological activity of phosphonate analogues and geometric isomers of the highly potent phosphoantigen (E)-1-hydroxy- 2-methylbut-2-enyl 4-diphosphate. J Med Chem 2008; 51 : 1747–54. 7. Bouet-Toussaint F, Cabillic F, Toutirais O, et al. Vγ9Vδ2 T cells-mediated recognition of human solid tumors. Potential for immunotherapy of hepatocellular and colorectal carcinomas. Cancer Immunol Immunother 2008; 57 : 531–9. 8. Corvaisier M, Moreau-Aubry A, Diez E, et al. Vγ9Vδ2 T cell response to colon carcinoma cells. J Immunol 2005; 175 : 5481–8. 9. Scotet E, Martinez LO, Grant E, et al. Tumor recognition following Vγ9Vδ2T cell receptor interactions with a surface F1-ATPase-related structure and apolipoprotein A-I. Immunity 2005; 22 : 71–80. 10. Toutirais O, Cabillic F, Le Friec G, et al. DNAX accessory molecule-1 (CD226) promotes human hepatocellular carcinoma cell lysis by Vγ9Vδ2 T cells. Eur J Immunol 2009; 39 : 1361–8. 11. Bonneville M, Scotet E. Human Vgamma9Vdelta2 T cells: promising new leads for immunotherapy of infections and tumors. Curr Opin Immunol 2006; 18 : 539–46. 12. Gong G, Shao L, Wang Y, et al. Phosphoantigen-activated V gamma 2V delta 2 T cells antagonize IL-2-induced CD4+CD25+Foxp3+ T regulatory cells in mycobacterial infection. Blood 2009; 113 : 837–45. 13. Salot S, Laplace C, Saiagh S, et al. Large scale expansion of gamma9delta2 T lymphocytes: Innacell gammadelta cell therapy product. J Immunol Methods 2007; 326 : 63–75. 14. Viey E, Lucas C, Romagne F, et al. Chemokine receptors expression and migration potential of tumor-infiltrating and peripheral-expanded Vgamma9Vdelta2 T cells from renal cell carcinoma patients. J Immunother 2008; 31 : 313–23. 15. Gertner-Dardenne J, Bonnafous C, Bezombes C, et al. Bromohydrin pyrophosphate enhances antibody-dependent cell-mediated cytotoxicity induced by therapeutic antibodies. Blood 2009; 113 : 4875–84. 16. Zocchi MR, Ferrarini M, Rugarli C. Selective lysis of the autologous tumor by delta TCS1+ gamma/delta+ tumor-infiltrating lymphocytes from human lung carcinomas. Eur J Immunol 1990; 20 : 2685–9. 17. Thomas ML, Samant UC, Deshpande RK, et al. γδT cells lyse autologous and allogenic oesophageal tumours : involvement of heat-shock proteins in the tumour cell lysis. Cancer Immunol Immunother 2000; 48 : 653–9. 18. Viey E, Fromont G, Escudier B, et al. Phosphostim™ activated-γδ T cells kill autologous metastatic renal cell carcinoma. J Immunol 2005; 174 : 1338–47. 19. Zheng BJ, Chan KW, IM S, et al. Anti-tumor effects of human peripheral γδ T cells in a mouse tumor model. Int J Cancer 2001; 92 : 421–5. 20. Wilhem M, Kunzmann V, Eckstein S, et al. γδ T cells for immune therapy of patients with lymphoid malignancies. Blood 2003; 102 : 200–6. 21. Dieli F, Vermijlen D, Fulfaro F, et al. Targeting human gammadelta T cells with zoledronate and interleukin-2 for immunotherapy of hormone-refractory prostate cancer. Cancer Res 2007; 67 : 7450–7. 22. Kobayashi H, Tanaka Y, Yagi J, et al. Safety profile and anti-tumor effects of adoptive immunotherapy using gamma-delta T cells against advanced renal cell carcinoma: a pilot study. Cancer Immunol Immunother 2007; 56 : 469–76. 23. Bennouna J, Bompas E, Neidhardt EM, et al. Phase-I study of Innacell gammadeltatrade mark, an autologous cell-therapy product highly enriched in gamma9delta2 T lymphocytes, in combination with IL-2, in patients with metastatic renal cell carcinoma. Cancer Immunol Immunother 2008; 57 : 1599–609. 24. Banchereau J. Grandeur et servitude de l’immunologie humaine. Med Sci (Paris) 2008; 24 : 783–6. 25. Li L, Wu CY. CD4+ CD25+ Treg cells inhibit human memory gammadelta T cells to produce IFN-gamma in response to M. tuberculosis antigen ESAT-6. Blood 2008; 111 : 5629–36. 26. Sicard H, Ingoure S, Luciani B, et al.
In vivo immunomanipulation of V gamma 9V delta 2 T cells with a synthetic phosphoantigen in a preclinical nonhuman primate model. J Immunol 2005; 175 : 5471–80. 27. Thedrez A, Harly C, Morice A, et al. IL-21-mediated potentiation of antitumor cytolytic and proinflammatory responses of human Vgamma9Vdelta2 T cells for adoptive immunotherapy. J Immunol 2009; 182 : 3423–31. 28. Thedrez A, Sabourin C, Gertner J, et al. Self/non-self discrimination by human gammadelta T cells: simple solutions for a complex issue ? Immunol Rev 2007; 215 : 123–35. 29. Takahara M, Miyai M, Tomiyama M, et al. Copulsing tumor antigen-pulsed dendritic cells with zoledronate efficiently enhance the expansion of tumor antigen-specific CD8+ T cells via Vgamma9gammadelta T cell activation. J Leukoc Biol 2008; 83 : 742–54. 30. Espinosa E, Tabiasco J, Hudrisier D, et al. Synaptic transfer by human gamma delta T cells stimulated with soluble or cellular antigens. J Immunol 2002; 168 : 6336–43. 31. Caumartin J, Favier B, Daouya M, et al. Trogocytosis-based generation of suppressive NK cells. EMBO J 2007; 26 : 1423–33. 32. Brandes M, Willimann K, Bioley G, et al. Cross-presenting human gammadelta T cells induce robust CD8+ alphabeta T cell responses. Proc Natl Acad Sci USA 2009; 106 : 2307–12. 33. Zitvogel L, Apetoh L, Ghiringhelli F, et al. The anticancer immune response: indispensable for therapeutic success ? J Clin Invest 2008; 118 : 1991–2001. 34. Chouaib S, El Hage F, Benlalam H, et al. Immunothérapie du cancer : espoirs et réalités. Med Sci (Paris) 2006; 22 : 755–9. 35. Le Deist F, de Saint Basile G, Rieux-Laucat F, Hivroz C, Fischer A. Anomalies d’expression du complexe récepteur T de l’antigène CD3 et déficits immunitaires. Med Sci (Paris) 2007; 23 : 161–6. |