| |
| Med Sci (Paris). 2010 February; 26(2): 159–164. Published online 2010 February 15. doi: 10.1051/medsci/2010262159.Un virus tapi dans l’ombre : les bases moléculaires de la latence du VIH-1 Partie I : la physiologie de la latence du VIH-1 Christian Schwartz,1,2* Valentin Le Douce,1 Thomas Cherrier,1 Laetitia Redel,1 Céline Marban,1 Dominique Aunis,1 and Olivier Rohr1,2 1Inserm Unité 575, Physiopathologie du système nerveux central, Institut de virologie, 3 rue Koeberlé, 67000 Strasbourg, France 2IUT de Schiltigheim, 1 allée d’Athènes, 67300 Schiltigheim, France |
Depuis l’identification de l’agent causal du syndrome d’immunodéficience acquise (Sida), un rétrovirus baptisé VIH-1 (pour virus de l’immunodéficience humaine 1), par les prix Nobel de médecine 2008 F. Barré-Sinoussi et L. Montagnier à l’Institut Pasteur [
1], tous les efforts de recherche se sont concentrés sur des stratégies de traitement et de prévention de cette infection. Aucun vaccin préventif ou thérapeutique n’a, à ce jour, fait preuve d’une réelle efficacité, au point que de nombreuses voix dans le monde de la science appellent à un retour aux fondamentaux de la biologie, cherchant à mieux comprendre le fonctionnement de notre système immunitaire confronté à ce virus pour le moins déroutant [
2]. En revanche, depuis 1996, un traitement à base de molécules antivirales est efficace. Ce traitement entraîne l’augmentation du taux de lymphocytes T CD4+, la principale cible du virus, à des valeurs proches de la normale et diminue la charge virale qui devient indétectable par les techniques alors utilisées [
3,
4]. Malheureusement, même en cas d’observance stricte pendant de nombreuses années, l’arrêt du traitement coïncidait avec une détection à nouveau positive du virus, mettant à mal les prédictions des premiers modèles basés sur la demi-vie des différents types cellulaires infectés et qui annonçaient une éradication complète du virus après trois années de traitement [4]. Or, l’un des principaux obstacles à l’éradication du virus est l’existence de virions intégrés sous forme latente dans les principales cibles cellulaires. Dans cette première partie, nous nous focaliserons sur les mécanismes moléculaires impliqués dans l’établissement et le maintien de la latence virale. Celle-ci est définie par la persistance du virus dans une cellule hôte sans production de virions. |
Mise en évidence de la latence du VIH-1 Le VIH-1 est un lentivirus de la famille des rétrovirus dont l’information génétique, codée sous forme d’ARN, est rétrotranscrite en ADN double brin avant d’être intégrée dans le génome de la cellule hôte. Il a rapidement été établi que certains virus pouvaient s’intégrer de manière latente dans les lymphocytes T CD4+ de patients infectés et non traités. Cet événement, bien que rare puisque concernant une cellule sur un million, est d’importance car il expliquait la persistance de ces virus dans l’organisme malgré les thérapeutiques antivirales utilisées. L’hypothèse de la constitution de réservoirs pour le virus a alors été proposée [
5,
6]. Ce concept de réservoir a pris toute son importance peu de temps après l’introduction de la multithérapie active en 1996, quand plusieurs auteurs ont démontré la persistance du virus, qui s’était intégré de manière latente dans des cellules T CD4+, chez des patients traités par au moins trois molécules antirétrovirales2 (ce que l’on désigne par le terme HAART pour highly active anti retroviral therapy), ruinant alors les espoirs fondés sur l’éradication totale du virus [
7–
9]. Depuis lors, il a été montré que d’autres types cellulaires que les lymphocytes T CD4+ pouvaient servir de réservoir du VIH-1 [
32] : c’est le cas des cellules de la lignée monocyte-macrophage [
10] dont les cellules microgliales qui sont les macrophages résidants du système nerveux central [
11], et des cellules dendritiques [
12]. |
Les mécanismes moléculaires à l’origine de la latence virale L’établissement de la latence virale Deux modalités différentes interviennent dans le processus de la latence selon qu’elle est mise en place avant ou après l’intégration de l’ADN viral du VIH-1 dans le génome de la cellule hôte. La première, dite latence préintégrative, survient, comme son nom l’indique, avant l’intégration de l’ADN dans le génome de la cellule infectée. Elle est très fréquemment observée dans les cellules T CD4 + naïves [
13], mais s’avère être très labile et ne perdure pas longtemps dans la cellule hôte. Elle n’est donc pas cliniquement importante dans la mesure où elle ne peut expliquer la persistance à long terme du virus, et donc la réapparition d’une virémie détectable après l’arrêt de la multithérapie. Toutefois, certains travaux réalisés in vivo ont montré que cette population n’était pas sans importance dans la formation des réservoirs viraux [
14]. En effet, bien que faiblement infectées, les cellules naïves sont néanmoins porteuses du virus. C’est le second type de latence, post-intégrative, qui explique le mieux la persistance à long terme du virus dans les réservoirs cellulaires. Ses bases moléculaires commencent à être connues mais des zones d’ombre subsistent. Dans les lymphocytes T CD4 +, il semble acquis que l’établissement de cette latence ne se fait pas dans les cellules naïves mais dans des cellules activées qui retournent à l’état de repos, rejoignant le groupe des cellules T CD4 + mémoires [ 7,
15]. Quant au lieu d’intégration dans le génome de la cellule hôte, des données initiales suggéraient que le provirus s’intégrait dans des zones hétérochromatiniennes. Dans la mesure où les gènes localisés dans ces zones sont silencieux, cette observation expliquait en même temps le mécanisme de l’établissement et du maintien de la latence virale. Des travaux plus récents montrent que l’intégration se fait préférentiellement dans des régions transcriptionnellement actives [
16]. Ces auteurs ont en effet montré, en utilisant la technique de PCR inverse, que sur 74 sites d’intégration analysés dans des cellules T CD4 + mémoires prélevées chez 16 patients, 93 % se trouvaient dans des introns de gènes transcriptionnellement actifs. Cette découverte, qui a été confirmée dans un modèle cellulaire de latence virale (cellules Jurkat ou J-LAT), pose un problème, dans la mesure où il est apparemment paradoxal qu’un génome intégré dans un gène transcriptionnellement très actif puisse être silencieux. Comment, dès lors, expliquer l’établissement de la latence virale alors que le provirus est localisé dans de l’euchromatine ? Les mécanismes sous-jacents à l’établissement de la latence virale, dans ce cas de figure, font appel à l’interférence transcriptionnelle [
17,
18] (voir Encadré).

Le maintien de la latence virale Une fois l’ADN proviral intégré et la latence établie, des mécanismes assurant le maintien de celle-ci vont entrer en jeu, qui expliquent la persistance à long terme du virus. De tels mécanismes reposent essentiellement sur l’organisation chromatinienne.En effet, la structure de la chromatine, selon qu’elle est plus ou moins condensée, intervient dans le statut plus ou moins actif de la transcription. Il a été montré par ailleurs que l’organisation chromatinienne du génome du VIH-1, quel que soit le site d’intégration viral, était toujours la même, avec notamment une organisation nucléosomale particulière au niveau du promoteur [
19] (Figure 1).Cette organisation en nucléosomes permet la compaction de la chromatine et empêche la machinerie transcriptionnelle de base et les facteurs transcriptionnels d’accéder facilement à l’ADN du promoteur afin d’y initier la transcription [
31]. L’état de compaction de la chromatine résulte d’une dynamique entre des facteurs favorisant la condensation et ceux la défavorisant. La structure compactée ou condensée est associée à des modifications post-traductionnelles des molécules d’histones, notamment les histones H3 et H4 [
20, 31]. Ces modifications peuvent être de cinq types (acétylation, méthylation, phosphorylation, sumoylation et ubiquitinylation) et c’est la combinaison de ces modifications qui constitue un code histone qui sera traduit en un état inactif ou actif de la chromatine [
21,
33] (Figure 1).
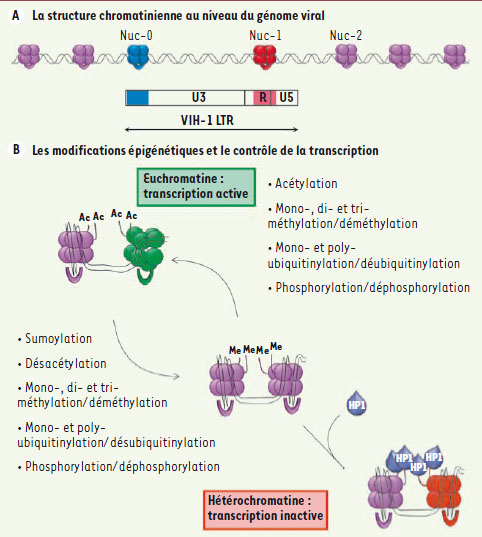
 | Figure 1.
Relation entre la structure de la chromatine et la transcription du génome viral. A. La structure chromatinienne au niveau du génome viral. Deux nucléosomes, nuc0 et nuc1, sont positionnés de manière précise dans le LTR du provirus VIH-1. Le nucléosome nuc1, localisé au niveau du site d’initiation de la transcription, peut être remodelé/perturbé par l’activité de molécules modifiant la structure de la chromatine [ 19]. B. Les modifications épigénétiques et le contrôle de la transcription. La régulation de la transcription des gènes est influencée par l’état de compaction de la chromatine. Ainsi, l’hétérochromatine, qui correspond à de la chromatine compacte, va empêcher la transcription des gènes alors que l’euchromatine, la forme relâchée, va favoriser celle-ci. Le passage d’une forme de chromatine à l’autre est réalisé grâce aux modifications épigénétiques, représentant le code histone. Les modifications épigénétiques associées à un état transcriptionnellement inactif vont permettre le recrutement des protéines de l’hétérochromatine (HP1) qui vont alors structurer la chromatine en hétérochromatine. |
Ce contrôle épigénétique de la structure de la chromatine est ainsi très important et constitue donc un moyen de régulation de l’expression des gènes en général, et de la latence virale en particulier. Les histones des nucléosomes nuc0 et nuc1 du promoteur du VIH-1 sont constitutivement déacétylées dans toutes les lignées cellulaires servant à modéliser la latence virale, suggérant fortement l’intervention d’enzymes douées d’activité déacétylase. Parmi les facteurs permettant le recrutement de ces dernières, nous pouvons citer l’homodimère p50-p50, LSF1, YY1 et le récepteur de l’hormone thyroïdienne. Ce recrutement se fait via des sites distincts sur le promoteur du VIH-1 [
22]. Par ailleurs, des données récentes [
23] obtenues dans les lymphocytes T font état du recrutement d’un complexe de protéines ayant des activités déacétylase et méthyltransférase au niveau du promoteur proximal du VIH-1. Ce recrutement est associé à des modifications épigénétiques considérées comme des marques répressives, avec notamment la triméthylation de la lysine 9 de l’histone H3 qui suit sa déacétylation, modifications à l’origine du recrutement des facteurs de la famille HP1 (heterochromatin protein 1) [23]. Un recrutement des activités déacétylases a aussi été décrit dans les cellules microgliales qui constituent également un réservoir pour le VIH-1 (Figure 2). Les mécanismes moléculaires à l’origine de l’établissement et du maintien de la latence virale dans ce type de cellules font appel à un cofacteur du facteur de transcription COUP-TF (chicken ovalbumin uptream promoter transcription factor) : CTIP2 (COUP-TF-interacting protein 2). Ce facteur intervient à la fois au cours de la phase précoce et au niveau de la phase tardive de la transcription du VIH-1 [
24,
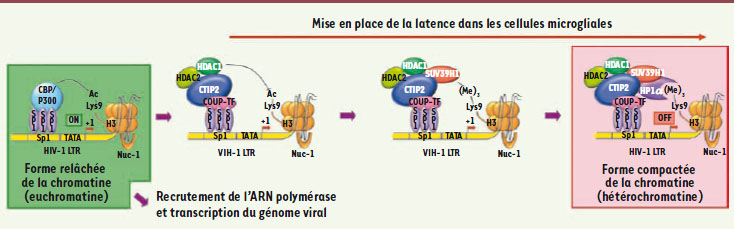
25]. L’action de CTIP2 passe par une interaction avec les facteurs COUP-TF et Sp1 au niveau des trois sites Sp1 du LTR (long terminal repeat) du VIH-1, qui pourra ainsi recruter un important complexe de protéines comprenant des histones déacétylases (HDAC de classe 1 et 2), une méthyltransférase (SUV 39H1) et des protéines HP1, afin de compacter la chromatine qui sera alors transcriptionnellement inactive.
 | Figure 2.
Mise en place de la latence dans les cellules microgliales. Le complexe protéique recruté par CTIP-2 au niveau des sites sp1 du promoteur du VIH-1 dans les cellules microgliales est composé des déacétylases HDAC1 et 2, de l’histone méthyltransférase SUV 39H1 et des protéines HP1. Dans un état transcriptionnellement actif, la lysine 9 de l’histone H3 est acétylée grâce au complexe CBP/p300 recruté au niveau des sites sp1. Ce complexe peut être déplacé par CTIP-2, au niveau de ces mêmes sites, qui recrute alors le complexe de manière séquentielle, avec tout d’abord les désacétylases HDAC1 et 2 qui déacétylent les histones à proximité du promoteur, dont la lysine 9 de l’histone H3 de nuc1. Puis l’histone méthyltransférase est recrutée, et ajoute trois groupements méthyl sur cette lysine. Enfin, les protéines HP1 sont recrutées et induisent une compaction de la chromatine par stabilisation du nucléosome nuc1. |
Il est intéressant de noter l’existence de couplages entre les phénomènes impliqués dans l’établissement et le maintien de la latence virale. Ainsi, des activités déacétylases et méthyltransférases sont associées à l’activité de l’ARN polymérase II, capable d’initier et d’assurer l’élongation préférentielle du gène de l’hôte grâce au mécanisme de l’interférence transcriptionnelle. Le recrutement par l’ARN polymérase II des complexes enzymatiques, qui sont à l’origine des modifications épigénétiques assurant la formation de l’hétérochromatine, va empêcher une deuxième transcription de l’ADN. Il s’agirait en fait d’un mécanisme plus général consistant à empêcher la transcription des promoteurs cryptiques, dont le promoteur du VIH-1 présent dans le provirus intégré dans le génome de l’hôte n’est qu’un cas particulier [18,
26]. |
Comment passer d’une cellule infectée productive à un état latent ? Bien que de nombreux mécanismes aient été mis à jour dans l’établissement et le maintien de la latence virale, plusieurs questions restent encore sans réponse. Ainsi, il est essentiel, d’un point de vue conceptuel, d’appréhender les processus impliqués dans l’établissement et le maintien de la latence du VIH-1 qui surviennent lorsque les lymphocytes T CD4+ actifs retournent à l’état de lymphocytes T CD4+ mémoires au repos. En d’autres termes, qu’est-ce qui détermine le passage d’une cellule active infectée de manière productive à une cellule quiescente contenant un provirus intégré transcriptionnellement silencieux et constituant ainsi un réservoir viral ? Plusieurs pistes sont actuellement proposées. Ainsi, l’interférence transcriptionnelle peut expliquer en partie l’établissement de la latence virale mais n’explique pas entièrement son maintien, bien que certaines données très récentes le suggèrent [18]. Mais pourquoi alors seules certaines cellules actives retournent à l’état de repos et contiennent le VIH-1 sous forme de provirus latent ? Des oscillations dans l’expression de NF-KB, qui intervient dans la dynamique de l’expression des gènes, ou les fluctuations stochastiques de Tat, pourraient aussi être à l’origine de la répression du provirus en inhibant notamment l’initiation de la transcription [
27,
28]. Weinberger et al. ont notamment montré, de manière très élégante, l’importance de la boucle de rétroaction positive impliquant Tat dans la destinée des cellules infectées par le VIH-1 [
29]. Toute perturbation tendant à affaiblir la force de cette boucle accroît la probabilité pour une cellule infectée de changer de destin et ainsi de devenir infectée de manière latente. Cela permettrait d’expliquer pourquoi certaines cellules entrent en latence. La probabilité de cet événement, bien que rare (1 sur 106 ou 107), serait ainsi augmentée. Il sera intéressant dans un avenir proche d’identifier les conditions physiologiques pouvant affaiblir cette boucle. Certains auteurs ont suggéré que des modifications épigénétiques seraient suffisantes pour diminuer le niveau de Tat (reflétant ainsi l’affaiblissement de cette boucle transcriptionnelle impliquant Tat), et donc favoriser l’entrée en latence du VIH-1 [
30]. |
La persistance à long terme de cellules réservoirs infectées de manière latente par le VIH-1 est un fait communément accepté par les scientifiques et les cliniciens. Ces réservoirs constituent un important obstacle à l’éradication du VIH-1 parce qu’ils sont inaccessibles à la fois au système immunitaire et aux molécules utilisées dans le cadre d’une multithérapie active. La compréhension des mécanismes moléculaires contrôlant l’établissement et le maintien de la latence cellulaire est donc indispensable étant donné les importantes implications thérapeutiques qui en découlent. Il apparaît que ces processus sont multifactoriels (interférence transcriptionnelle, organisation chromatinienne en nucléosomes, modifications épigénétiques). De plus, le site d’intégration est aussi un élément important à considérer. Ainsi, l’intégration du provirus dans un environnement chromatinien répresseur pourrait expliquer à la fois l’établissement et le maintien de la latence virale, alors que son intégration dans des régions transcriptionnellement actives fait appel à l’interférence transcriptionnelle. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Barre-Sinoussi F, Chermann JC, Rey F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science 1983; 220 : 868–71. 2. Medzhitov R, Littman D. HIV immunology needs a new direction. Nature 2008; 455 : 591. 3. Hammer SM, Squires KE, Hughes MD, et al. A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less. AIDS clinical trials group 320 study team. N Engl J Med 1997; 337 : 725–33. 4. Perelson AS, Essunger P, Cao Y, et al. Decay characteristics of HIV-1-infected compartments during combination therapy. Nature 1997; 387 : 188–91. 5. Chun TW, Finzi D, Margolick J, et al.
In vivo fate of HIV-1-infected T cells: quantitative analysis of the transition to stable latency. Nat Med 1995; 1 : 1284–90. 6. Piatak M Jr, Saag MS, Yang LC, et al. High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR. Science 1993; 259 : 1749–54. 7. Chun TW, Carruth L, Finzi D, et al. Quantification of latent tissue reservoirs and total body viral load in HIV-1 infection. Nature 1997; 387 : 183–8. 8. Finzi D, Hermankova M, Pierson T, et al. Identification of a reservoir for HIV-1 in patients on highly active antiretroviral therapy. Science 1997; 278 : 1295–300. 9. Wong JK, Hezareh M, Gunthard HF, et al. Recovery of replication-competent HIV despite prolonged suppression of plasma viremia. Science 1997; 278 : 1291–5. 10. Bailey JR, Sedaghat AR, Kieffer T, et al. Residual human immunodeficiency virus type 1 viremia in some patients on antiretroviral therapy is dominated by a small number of invariant clones rarely found in circulating CD4+ T cells. J Virol 2006; 80 : 6441–57. 11. Barber SA, Gama L, Dudaronek JM, et al. Mechanism for the establishment of transcriptional HIV latency in the brain in a simian immunodeficiency virus-macaque model. J Infect Dis 2006; 193 : 963–70. 12. Keele BF, Tazi L, Gartner S, et al. Characterization of the follicular dendritic cell reservoir of human immunodeficiency virus type 1. J Virol 2008; 82 : 5548–61. 13. Zack JA, Arrigo SJ, Weitsman SR, et al. HIV-1 entry into quiescent primary lymphocytes: molecular analysis reveals a labile, latent viral structure. Cell 1990; 61 : 213–22. 14. Haase AT, Henry K, Zupancic M, et al. Quantitative image analysis of HIV-1 infection in lymphoid tissue. Science 1996; 274 : 985–9. 15. Stevenson M, Stanwick TL, Dempsey MP, Lamonica CA. HIV-1 replication is controlled at the level of T cell activation and proviral integration. Embo J 1990; 9 : 1551–60. 16. Han Y, Lassen K, Monie D, et al. Resting CD4+ T cells from human immunodeficiency virus type 1 (HIV-1)-infected individuals carry integrated HIV-1 genomes within actively transcribed host genes. J Virol 2004; 78 : 6122–33. 17. Lassen K, Han Y, Zhou Y, et al. The multifactorial nature of HIV-1 latency. Trends Mol Med 2004; 10 : 525–31. 18. Lenasi T, Contreras X, Peterlin BM. Transcriptional interference antagonizes proviral gene expression to promote HIV latency. Cell Host Microbe 2008; 4 : 123–33. 19. Van Lint C. Role of chromatin in HIV-1 transcriptional regulation. Adv Pharmacol 2000; 48 : 121–60. 20. Wurtele H, Li Q, Zhou H, et al. L’acétylation des histones : un nouveau maillon de la chaîne d’assemblage du nucléosome. Med Sci (Paris) 2009; 25 : 121–2. 21. Peterson CL, Laniel MA. Histones and histone modifications. Curr Biol 2004; 14 : R546–51. 22. Williams SA, Greene WC. Regulation of HIV-1 latency by T-cell activation. Cytokine 2007; 39 : 63–74. 23. Du Chene I, Basyuk E, Lin YL, et al. Suv39H1 and HP1gamma are responsible for chromatin-mediated HIV-1 transcriptional silencing and post-integration latency. Embo J 2007; 26 : 424–35. 24. Marban C, Suzanne S, Dequiedt F, et al. Recruitment of chromatin-modifying enzymes by CTIP2 promotes HIV-1 transcriptional silencing. Embo J 2007; 26 : 412–23. 25. Rohr O, Lecestre D, Chasserot-Golaz S, et al. Recruitment of Tat to heterochromatin protein HP1 via interaction with CTIP2 inhibits human immunodeficiency virus type 1 replication in microglial cells. J Virol 2003; 77 : 5415–27. 26. Li B, Carey M, Workman JL. The role of chromatin during transcription. Cell 2007; 128 : 707–19. 27. Nelson DE, Ihekwaba AE, Elliott M, et al. Oscillations in NF-kappaB signaling control the dynamics of gene expression. Science 2004; 306 : 704–8. 28. Weinberger LS, Burnett JC, Toettcher JE, et al. Stochastic gene expression in a lentiviral positive-feedback loop: HIV-1 Tat fluctuations drive phenotypic diversity. Cell 2005; 122 : 169–82. 29. Weinberger LS, Dar RD, Simpson ML. Transient-mediated fate determination in a transcriptional circuit of HIV. Nat Genet 2008; 40 : 466–70. 30. Pearson R, Kim YK, Hokello J, et al. Epigenetic silencing of human immunodeficiency virus (HIV) transcription by formation of restrictive chromatin structures at the viral long terminal repeat drives the progressive entry of HIV into latency. J Virol 2008; 82 : 12291–303. 31. Bertin A, Mangenot S. Structure et dynamique de la particule cœur du nucléosome. Med Sci (Paris) 2008; 24 : 715–9. 32. Estaquier J, Hurtrel B. Sanctuaire du virus de l’immunodéficience humaine et mécanismes d’échappement. Med Sci (Paris) 2008; 24 : 1055–60. 33. Ray-Gallet D, Gérard A, Polo S, Almouzni G. Variations sur le thème du code histone. Med Sci (Paris) 2005; 21 : 384–9. |