| |
| Med Sci (Paris). 2010 February; 26(2): 153–158. Published online 2010 February 15. doi: 10.1051/medsci/2010262153.Infections à Clostridium difficile
Catherine Eckert1* and Frédéric Barbut2 1Laboratoire « Clostridium difficile » associé au CNR des bactéries anaérobies et du botulisme, Université Pierre et Marie Curie, Paris VI, Faculté de
édecine Saint-Antoine, Laboratoire de bactériologie, 27, rue de Chaligny, 75571 Paris Cedex 12, France 2Laboratoire « Clostridium difficile » associé au CNR des bactéries anaérobies et du botulisme, Université Pierre et Marie Curie, Paris VI, France 3UHLIN, hôpital Saint-Antoine, Assistance publique-hôpitaux de Paris, Paris, France |
La première description de C. difficile date de 1935 lorsque Hall et O’Toole isolent cette bactérie anaérobie à Gram positif dans des selles de nouveau-nés. Son rôle dans les colites pseudo-membraneuses (CPM) ne sera démontré que beaucoup plus tard, en 1978. Dès lors, l’intérêt porté à cette bactérie n’a cessé d’augmenter. Le début du millénaire a notamment été marqué par la description, d’abord au Canada et aux États-Unis puis en Europe, d’épidémies de formes sévères d’infections liées à C. difficile, caractérisées par une mortalité élevée et une moins bonne réponse au traitement par métronidazole. Ces épidémies ont été reliées à l’émergence d’un clone particulièrement virulent de C. difficile appelé 027 et à sa rapide dissémination à travers le monde. |
Physiopathologie des infections liées à C. difficile
La première étape de la physiopathologie des infections liées à C. difficile est une perturbation de la flore digestive anaérobie de barrière, souvent liée à un traitement antibiotique, qui va permettre à C. difficile de s’implanter et de se multiplier. Cette colonisation du tube digestif de l’hôte par C. difficile met en jeu différentes adhésines et probablement des enzymes hydrolytiques et protéolytiques. Les protéines de surface décrites à ce jour sont les protéines flagellaires FliC et FliD, les protéines de la couche S (P47 et P36), la protéine Cwp66, la protéine de choc thermique GroEL ou encore la protéine de liaison à la fibronectine Fbp68. La cystéine protéase Cwp84, décrite plus récemment, pourrait contribuer in vivo à la dégradation du tissu de l’hôte et à la dissémination de l’infection [
1]. La seconde étape repose sur la production par les souches toxinogènes de C. difficile des toxines A (ou TcdA) et B (ou TcdB) qui sont dotées à la fois de propriétés entérotoxiques et cytotoxiques et qui agissent en synergie. Des données récentes, utilisant des mutants de toxines, suggèrent que seule TcdB serait un facteur de virulence essentiel [
2]. TcdB et TcdA sont des glucosyltransférases qui catalysent la monoglucosylation de la thréonine en 35/37 des petites GTPases Rho, Rac et Cdc42 des cellules cibles [
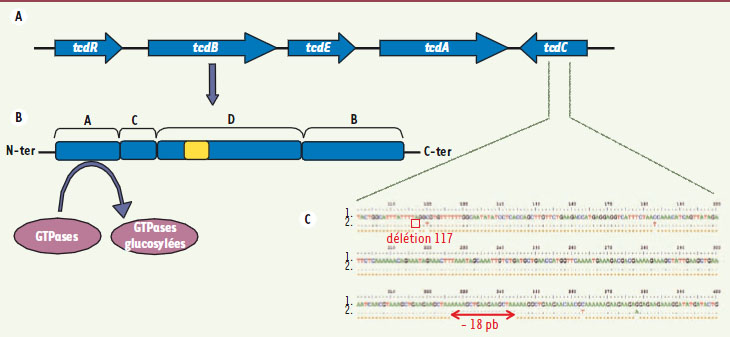
3]. L’inactivation de ces protéines impliquées dans plusieurs voies de signalisation et dans la régulation du cytosquelette d’actine (dépolymérisation des filaments d’actine) aboutit à la mort cellulaire. TcdA et TcdB détruisent les jonctions serrées des entérocytes, induisent une réaction inflammatoire intense avec recrutement de polynucléaires au niveau de la lamina propria et sont responsables des lésions intestinales aboutissant à la nécrose des entérocytes. TcdA et TcdB sont codées respectivement par les gènes tcdA et tcdB qui forment avec trois gènes accessoires (tcdC, tcdE, tcdR) un locus de pathogénicité PaLoc de 19,6 kb (Figure 1). Parmi les gènes accessoires, tcdC code pour un répresseur de la transcription de tcdB et tcdA et tcdR pour une protéine qui jouerait le rôle d’un facteur sigma alternatif [
4].
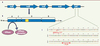 | Figure 1.
Locus de pathogénicité (PaLoc) de C. difficile, structure de TcdB et séquence partielle de tcdC. A. Locus de pathogénicité. Les gènes tcdA et tcdB qui codent respectivement pour la toxine A et la toxine B forment avec le gène régulateur positif de la transcription des toxines tcdR, le gène régulateur négatif tcdC et le gène tcdE un locus de pathogénicité de 19,6 kb. La synthèse des toxines est médiée par différents signaux de l’environnement. Les flèches indiquent le sens de la transcription. B. Représentation schématique de TcdB d’après Jank et al. [3]. TcdB possède un domaine amino-terminal à activité glucosyltransférase (A ou biological activity), un domaine cystéine protéase (C ou cutting), un domaine de translocation (D ou delivery) incluant une région hydrophobe (en jaune) et un domaine de liaison au récepteur (B ou binding). C. Séquence d’une partie du gène tcdC de la souche VPI10463 (1) et d’une souche épidémique 027 (2). La souche épidémique 027 est caractérisée par la présence d’une délétion non spécifique de 18 pb et d’une délétion ponctuelle en position 117 introduisant un codon stop prématuré. |
Environ 6 à 10 % des souches de C. difficile possèdent une toxine supplémentaire appelée toxine binaire (ou CDT). Décrite pour la première fois en 1988 chez une souche de C. difficile isolée d’une patiente atteinte d’une forme sévère de colite pseudo-membraneuse, cette toxine possède une activité ADP ribosyl-transférase spécifique de l’actine [
5]. CDT est composée de deux sous-unités CDTa (partie enzymatique) et CDTb (partie ligand) codées respectivement par les gènes cdtA et cdtB. Ces deux gènes forment avec un troisième gène cdtR le CdtLoc. cdtR code pour une protéine régulatrice de la famille LytTR nécessaire à l’expression optimale de CDT [
6]. Cette toxine pourrait potentialiser les effets cytotoxiques des toxines A et B et serait plus souvent associée à des formes sévères d’infections liées à C. difficile[
7]. Des facteurs liés à l’hôte, notamment des paramètres de l’immunité, interviennent également dans la physiopathologie de ces infections. Il a été montré qu’après colonisation par C. difficile, les patients qui développent une infection ont un taux d’anticorps sériques anti-toxine A significativement plus faible que les patients qui restent porteurs asymptomatiques [
8]. Par ailleurs, une élévation du titre d’anticorps dirigés contre la toxine A lors d’un premier épisode de diarrhée à C. difficile est associée à une protection contre les récidives [
9]. |
Présentation clinique des infections liées à C. difficile
Les infections liées à C. difficile surviennent généralement au cours d’un traitement antibiotique ou dans les deux semaines suivant son arrêt. Le tableau clinique est très variable ; il va de la diarrhée banale aqueuse, non sanglante sans retentissement sur l’état général, jusqu’à un tableau de colite pseudo-membraneuse pouvant se compliquer de perforation colique ou de mégacôlon toxique [
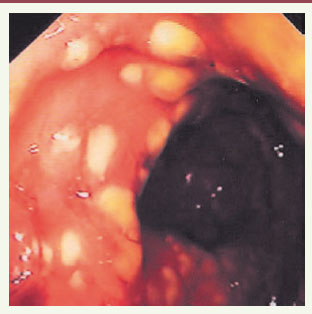
10]. La colite pseudo-membraneuse se manifeste de façon bruyante par une diarrhée profuse souvent accompagnée de fièvre (dans 75 % des cas), de douleurs abdominales (dans 70 % des cas) ainsi que de signes de déshydratation. La présence de plaques jaunâtres, friables, éparses ou confluentes (pseudo-membranes) au niveau du côlon et/ou du rectum, détectée par l’endoscopie, est caractéristique de ces colites (Figure 2). Les complications possibles sont le choc septique, le mégacôlon toxique (dilatation massive du côlon) ou la perforation digestive. Une forme atypique d’iléus sans diarrhée préalable peut parfois se voir. D’autres formes ont également été décrites, notamment des bactériémies, des abcès ou des arthrites réactionnelles. Les infections liées à C. difficile ont également été associées aux manifestations cliniques récurrentes des maladies inflammatoires du côlon (maladie de Crohn, rectocolite hémorragique). Moins de 3 % des adultes sont porteurs sains de souches de C. difficile.
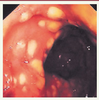 | Figure 2.
Colite pseudomembraneuse : aspect endoscopique. On observe les caractéristiques plaques jaunâtres typiques de pseudomembranes(© L. Beaugerie). |
Un des aspects caractéristiques de ces infections est le taux élevé de récidives : celles-ci surviennent dans les deux mois chez environ 20 % des patients après un premier épisode, et chez 60 % de ceux qui ont fait une première récidive. |
Épidémiologie des infections liées à C. difficile
En France, en milieu hospitalier, l’incidence des infections liées à C. difficile varie habituellement de 1 à 10 cas pour 1 000 admissions. Elle dépend de la nature des services, de la pression antibiotique, des mesures d’isolement instaurées dans chaque hôpital et de la sensibilisation des cliniciens à prescrire une recherche de C. difficile chez les patients présentant une diarrhée post-antibiotique. Les infections diagnostiquées à l’hôpital sont d’origine nosocomiale dans plus de 70 % des cas et surviennent volontiers sous forme d’épidémies, notamment dans les services à risque (réanimation, maladies infectieuses, hématologie et gériatrie). L’acquisition nosocomiale de C. difficile est plus fréquente que ne l’est l’infection. Lors d’une étude prospective, McFarland et al. ont montré que 21 % des patients hospitalisés acquièrent C. difficile au cours de leur hospitalisation et que parmi ceux-ci, 37 % développent une diarrhée liée à ce germe [
11]. La facilité d’acquisition de cet entéropathogène en milieu hospitalier peut s’expliquer par (1) la très importante dissémination des souches dans l’environnement des patients souffrant d’une diarrhée à C. difficile, (2) la résistance et la persistance des spores de C. difficile dans l’environnement, (3) la promiscuité des patients, (4) la fréquence du manuportage, (5) la pression antibiotique et (6) la pression de sélection. La mortalité imputable aux infections liées à C. difficile varie de 0,6 à 1,5 % mais peut atteindre 35 à 50 % en cas de complications de colite pseudomembraneuse. Depuis 2003, de nombreux pays dont les États-Unis et le Canada ont constaté (1) une augmentation importante de l’incidence des infections à C. difficile, notamment chez les patients de plus de 65 ans, (2) une augmentation de la sévérité des formes cliniques de ces infections et de la mortalité et (3) une moins bonne réponse aux traitements par métronidazole. Un clone particulièrement virulent de C. difficile appelé 027 est à l’origine de ces épidémies [
12]. Cette souche « hypervirulente » et source d’épidémies est apparue en Europe en 2005 et en France à partir de mars 2006 quand la première épidémie a été détectée dans le Nord de la France. Elle a été retrouvée dans plusieurs établissements de santé du Nord Pas-de-Calais et de trois autres départements (Somme, Rhône, Moselle). Depuis avril 2007, la présence de cette souche a été confirmée dans plusieurs autres régions françaises. Ce clone épidémique est maintenant bien caractérisé : il s’agit d’une souche productrice de toxines sécrétant la toxine binaire et appartenant au PCR-ribotype « 027 » ou au pulsotype NAP1 (en référence à son profil en électrophorèse en champ pulsé). Celle-ci présente par ailleurs une résistance à de nombreux antibiotiques dont les nouvelles fluoroquinolones (moxifloxacine, lévofloxacine) et l’érythromycine. La plus grande virulence de cette souche serait liée à une hyperproduction des toxines A et B (quantité environ vingt fois plus importante que celle sécrétée par les souches habituelles de C. difficile) et/ou à la présence de la toxine binaire [
13]. Sur le plan génétique, cette souche présente, en plus d’une délétion de 18 pb, une délétion ponctuelle en position 117 dans le gène tcdC
(Figure 1). Cette dernière serait à l’origine de l’hyperproduction in vitro des toxines A et B. Si les infections liées à C. difficile sont généralement considérées comme des infections typiquement hospitalières, l’émergence d’infections, parfois sévères, a été décrite en milieu communautaire et chez des personnes ne présentant aucun des facteurs de risque classiques [
14]. Ces infections communautaires sont probablement sous-estimées. Une étude prospective portant sur 266 adultes traités par antibiotiques par leur médecin de ville a permis d’estimer que l’incidence des diarrhées post-antibiotiques à C. difficile d’origine communautaire est de 2 700 cas (1 150-5 400) pour 100 000 traitements antibiotiques, soit environ 1 620 000 cas d’infections liées à C. difficile par an en France [
15]. Actuellement, un nouveau clone de PCR-ribotype 078 semble émerger dans plusieurs pays, notamment en France. Les infections dues à cette souche sont responsables de diarrhées sévères d’origine plus souvent communautaire et survenant chez des patients plus jeunes que celles dues à la souche épidémique 027 [
16]. |
Diagnostic des infections liées à C. difficile
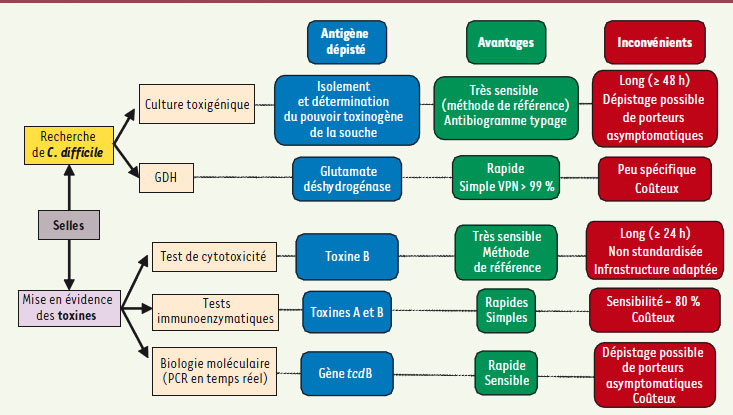
C. difficile est le principal entéropathogène responsable de diarrhées infectieuses nosocomiales chez l’adulte. La stratégie recommandée repose sur la recherche unique et systématique de C. difficile dans toutes les coprocultures de patients adultes prescrites au-delà du troisième jour d’hospitalisation (diarrhée nosocomiale). L’application d’une telle stratégie systématique permet d’améliorer le diagnostic de 24 % par rapport à une recherche faite uniquement à partir d’une prescription médicale. Le diagnostic endoscopique repose sur la mise en évidence de pseudomembranes, au niveau du côlon et du rectum. C’est un examen long, invasif et peu sensible : les pseudomembranes ne sont pas présentes au début de la maladie ni en cas de diarrhée simple associée aux antibiotiques. Le diagnostic bactériologique repose soit sur la mise en évidence des toxines directement dans les selles diarrhéiques, soit sur l’isolement d’une souche toxinogène (Figure 3) [
17]. La méthode de référence, longue et nécessitant une infrastructure adaptée, est le test de cytotoxicité des selles (mise en évidence d’un effet cytopathogène d’un filtrat de selles sur des cultures cellulaires). Les tests immunoenzymatiques (tests classiques ELISA en plaque de 96 puits ou tests unitaires immunochromatographiques) dépistent soit la toxine A seule, soit les toxines A et B simultanément. Depuis l’émergence de souches toxine A négative-toxine B positive (A-B+) dont la prévalence varie de 1 % à 10 % selon les pays, la détection des deux toxines est maintenant recommandée. Ces tests sont fréquemment utilisés par les laboratoires : ils sont rapides, faciles d’utilisation et leur spécificité est supérieure à 95 %. Néanmoins, leur sensibilité n’est que de l’ordre de 80 %. La culture toxigénique consiste à isoler C. difficile sur des milieux sélectifs puis à déterminer in vitro le caractère toxinogène de la souche. Cette méthode est très sensible mais longue et ne peut répondre à des situations d’urgence. L’intérêt de la culture de C. difficile repose également sur la possibilité de caractériser les souches (typage moléculaire, antibiogramme). Plus récemment, des techniques de PCR (polymerase chain reaction) en temps réel (détectant le gène tcdB) ont été commercialisées en Europe et évaluées chez des patients suspects d’infections liées à C. difficile. Ces techniques représentent une alternative intéressante par leur rapidité, leur sensibilité supérieure à celle des tests immunoenzymatiques et leur excellente spécificité [
18]. Enfin, certains tests immunoenzymatiques permettent la mise en évidence dans les selles d’une enzyme spécifique de C. difficile, la glutamate deshydrogénase ou GDH. Ces tests présentent une excellente sensibilité et une valeur prédictive négative en général supérieure à 99 %, permettant d’écarter le diagnotic d’infections liées à C. difficile en cas de résultat négatif. En revanche, un résultat positif ne permet pas de prédire le caractère toxinogène de la souche et devra être confirmé par un test dépistant les toxines.
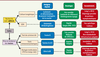 | Figure 3.
Les différentes méthodes de diagnostic, leurs avantages et leurs inconvénients. VPN : valeur prédictive négative. |
D’un point de vue biologique, une hyperleucocytose, une hypoalbuminémie ou une augmentation sérique de la CRP (C reactive protein) ou du lactate peuvent être observées dans les formes les plus sévères de colite. |
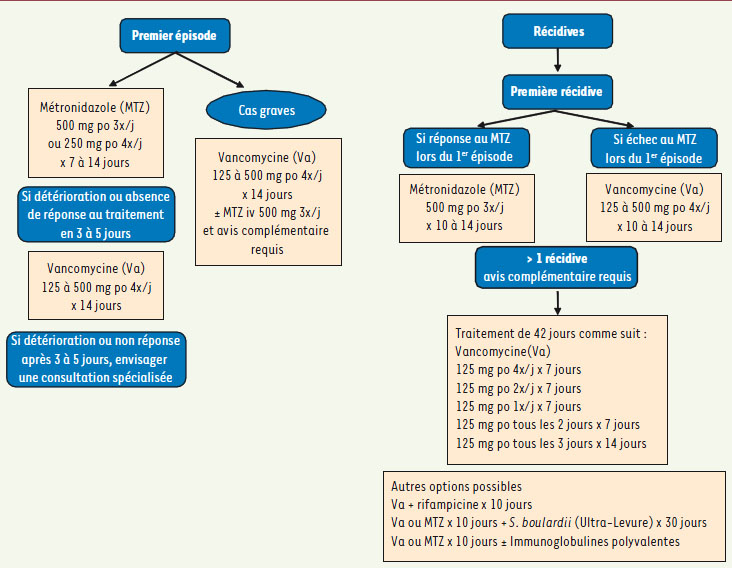
La réhydratation du patient et l’arrêt du traitement antibiotique ou son remplacement par un antibiotique à moindre risque sont les premières mesures à mettre en place. Ces mesures simples suffisent à obtenir une amélioration clinique dans 25 % des cas. Si l’antibiotique responsable ne peut être arrêté ou modifié ou si les symptômes persistent, le traitement des infections liées à C. difficile repose alors sur l’administration par voie orale de métronidazole et/ou de vancomycine (Figure 4) [
19,
20]. Le métronidazole est en général donné en première intention dans les cas sans signes de gravité alors que la vancomycine est plutôt réservée aux formes sévères. La résistance in vitro de C. difficile à ces molécules reste exceptionnelle et aucun échec thérapeutique n’a été, à ce jour, lié à une diminution de sensibilité des souches de C difficile au métronidazole ou à la vancomycine. L’hospitalisation en réanimation ou en chirurgie peut parfois s’avérer nécessaire en cas de forme compliquée. Il n’existe pas de consensus pour le traitement des récidives.
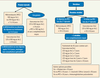 | Figure 4.
Algorithme du traitement des infections liées à C. difficile chez l’adulte. D’après le Haut conseil de santé publique (http://www.hcsp.fr/hcspi/docspdf/avisrapports/hcspa20080620_Cdifficile.pdf) et le Conseil du médicament Québec (http://www.cdm.gouv.qc.ca/site/download.php ?f=915ba949272c189cb6cf7a8a0f7bef5e) ; po : per os ; iv : intraveineuse. |
De nombreux traitements antibiotiques sont en développement ou à l’essai pour le traitement des infections liées à C. difficile (nitazoxanide, rifaximine, ramoplanine, tinidazole, OPT-80) [
21]. D’autres stratégies sont également à l’étude : molécules qui lient les toxines de C. difficile (tolevamer), probiotiques, immunoglobulines, vaccins, biothérapie de l’incontinence fécale. Seule l’amélioration des signes cliniques rend compte de l’efficacité du traitement. Le contrôle microbiologique après traitement est inutile car environ 30 % des patients restent porteurs de C. difficile ou de ses toxines à l’issue d’un traitement pourtant jugé efficace. La prévention des infections repose tout d’abord sur le bon usage des antibiotiques. La diminution de la consommation de certaines classes d’antibiotiques particulièrement à risque d’entraîner une infection à C. difficile (céphalosporines, clindamycine, amoxicilline associée au clavulanate, nouvelles fluoroquinolones) a été corrélée dans plusieurs études à une diminution d’incidence des infections liées à C. difficile. Les mesures essentielles pour prévenir la transmission croisée comprennent l’isolement géographique du patient infecté, le lavage des mains (les solutions hydro-alcooliques sont inefficaces sur les spores, seul le lavage des mains à l’eau et au savon est efficace par un effet mécanique), les précautions contact (port de gants, surblouse) ainsi que la désinfection de l’environnement à l’aide de produits sporicides (eau de javel à 0,5 %). Enfin, il faut insister sur l’information des patients et l’éducation du personnel. |
Les infections liées à C. difficile connaissent un regain d’intérêt depuis quelques années, lié notamment à l’émergence du clone de PCR-ribotype 027 hypervirulent et à l’origine d’épidémies entraînant une augmentation importante de l’incidence et de la sévérité des infections liées à C. difficile. La description de plus en plus fréquente d’infections d’origine communautaire est également un facteur préoccupant. Il est à noter que l’impact clinico-économique de ces infections nosocomiales est important puisque le surcoût varie de 1 666 à 5 867 euros par infection. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Janoir C, Pechine S, Grosdidier C, et al. Cwp84, a surface-associated protein of Clostridium difficile, is a cysteine protease with degrading activity on extracellular matrix proteins. J Bacteriol 2007; 189 : 7174–80. 2. Lyras D, O’Connor JR, Howarth PM, et al. Toxin B is essential for virulence of Clostridium difficile.
Nature 2009; 458 : 1176–9. 3. Jank T, Aktories K. Structure and mode of action of clostridial glucosylating toxins: the ABCD model. Trends Microbiol 2008; 16 : 222–9. 4. Dupuy B, Govind R, Antunes A, et al.
Clostridium difficile toxin synthesis is negatively regulated by TcdC. J Med Microbiol 2008; 57 : 685–9. 5. Popoff MR, Rubin EJ, Gill DM, et al. Actin-specific ADP-ribosyltransferase produced by a Clostridium difficile strain. Infect Immun 1988; 56 : 2299–306. 6. Carter GP, Lyras D, Allen DL, et al. Binary toxin production in Clostridium difficile is regulated by CdtR, a LytTR family response regulator. J Bacteriol 2007; 189 : 7290–301. 7. Barbut F, Decre D, Lalande V, et al. Clinical features of Clostridium difficile-associated diarrhoea due to binary toxin (actin-specific ADP-ribosyltransferase)-producing strains. J Med Microbiol 2005; 54 : 181–5. 8. Kyne L, Warny M, Qamar A, et al. Asymptomatic carriage of Clostridium difficile and serum levels of IgG antibody against toxin A. N Engl J Med 2000; 342 : 390–7. 9. Kyne L, Warny M, Qamar A, et al. Association between antibody response to toxin A and protection against recurrent Clostridium difficile diarrhoea. Lancet 2001; 357 : 189–93. 10. Barbut F, Beaugerie L, Petit JC. Clostridium difficile et pathologie digestive. EMC (Elsevier Masson Paris), Maladies infectieuses 2008; 8–038–H–20. 11. McFarland LV, Mulligan ME, Kwok RY, et al. Nosocomial acquisition of Clostridium difficile infection. N Engl J Med 1989; 320 : 204–10. 12. Kuijper EJ, Coignard B, Tull P. Emergence of Clostridium difficile-associated disease in North America and Europe. Clin Microbiol Infect 2006; 12 Suppl 6 : 2–18. 13. Warny M, Pepin J, Fang A, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet 2005; 366 : 1079–84. 14. Wilcox MH, Mooney L, Bendall R, et al. A case-control study of community-associated Clostridium difficile infection. J Antimicrob Chemother 2008; 62 : 388–96. 15. Beaugerie L, Flahault A, Barbut F, et al. Antibiotic-associated diarrhoea and Clostridium difficile in the community. Aliment Pharmacol Ther 2003; 17 : 905–12. 16. Goorhuis A, Bakker D, Corver J, et al. Emergence of Clostridium difficile infection due to a new hypervirulent strain, polymerase chain reaction ribotype 078. Clin Infect Dis 2008; 47 : 1162–70. 17. Bartlett JG, Gerding DN. Clinical recognition and diagnosis of Clostridium difficile infection. Clin Infect Dis 2008; 46 (suppl 1) : S12–8. 18. Barbut F, Braun M, Burghoffer B, et al. Rapid diagnosis of toxigenic strains of Clostridium difficile in diarrheal stools by real-time PCR.
J Clin Microbiol 2009; 47 : 1276–7. 19. Gerding DN, Muto CA, Owens RC Jr. Treatment of Clostridium difficile infection. Clin Infect Dis 2008; 46 (suppl 1) : S32–42. 20. Zar FA, Bakkanagari SR, Moorthi KM, et al. A comparison of vancomycin and metronidazole for the treatment of Clostridium difficile-associated diarrhea, stratified by disease severity. Clin Infect Dis 2007; 45 : 302–7. 21. McFarland LV. Renewed interest in a difficult disease. Clostridium difficile infections: epidemiology and current treatment strategies. Curr Opin Gastroenterol 2009; 25 : 24–35. |