| |
| Med Sci (Paris). 2010 February; 26(2): 139–142. Published online 2010 February 15. doi: 10.1051/medsci/2010262139.La chromatine façonne le fuseau mitotique Céline Pugieux and François Nédélec* Laboratoire Européen de biologie moléculaire (EMBL), Meyerhofstrasse 1, 69117 Heidelberg, Allemagne MeSH keywords: Animaux, Polarité de la cellule, Chromatine, ultrastructure, Ségrégation des chromosomes, Dynéines, antagonistes et inhibiteurs , physiologie, Humains, Souris, Microtubules, Ovocytes, Pliage des protéines |
Les microtubules (fibres de tubuline) sont l’un des constituants majeurs du squelette de la cellule. Leur autoassemblage présente une dynamique particulière qui permet à la cellule de répondre rapidement aux signaux intra- et extracellulaires. Ils sont nécessaires, entre autres, au transport cytoplasmique, à la migration et à la division. Des composés, comme le taxol ou le docetaxel, sont utilisés en chimiothérapie contre certains cancers, car, en perturbant la dynamique des microtubules, ils permettent de cibler les cellules qui se divisent. |
Fuseau mitotique : symétrie en miroir mais forme variable Pour se diviser, la cellule eucaryote génère et organise des microtubules en une structure symétrique bipolaire, appelée fuseau mitotique [
1]. Le rôle d’un tel fuseau est de répartir les chromosomes équitablement afin de prévenir toute aneuploïdie (un nombre anormal de chromosomes) dans les cellules filles. Pour accomplir cette tâche, un fuseau doit être symétrique : il faut qu’il soit invariant par une symétrie miroir suivant un plan qui le partage en son milieu. Au plan moléculaire, cette symétrie correspond à des chevauchements antiparallèles entre microtubules dans la région centrale du fuseau, créés par des molécules qui organisent et lient les microtubules entre eux. Si - sauf rares exceptions - tous les fuseaux sont bien symétriques, leur forme est par contre variable. Chez les animaux, les fuseaux mitotiques ressemblent à des losanges ; les deux extrémités pointues, appelées pôles, sont situées symétriquement de chaque côté du plan de symétrie. Les pôles sont, en partie, organisés par les centrosomes, mais ces organites ne sont pas essentiels à la formation d’un fuseau mitotique. Quant aux fuseaux de cellules végétales, ils ont une forme rectangulaire, sans pôles et sans centrosomes. Enfin, en plus de ces considérations de symétrie et de forme, un fuseau mitotique est aussi caractérisé par sa taille (longueur, largeur) qui varie d’un organisme à un autre, ou d’un type cellulaire à un autre. |
Le rôle de la chromatine dans la nucléation des microtubules Les recherches récentes ont permis d’éclairer les mécanismes de formation du fuseau mitotique. On comprend mieux comment les microtubules sont générés lorsque la cellule entre en phase mitotique, et les protéines qui organisent les microtubules ont été identifiées. Parmi celles-ci, les moteurs moléculaires comme les kinésines et la dynéine sont des acteurs essentiels. Ce sont des motrices miniatures qui se déplacent de manière directionnelle le long des microtubules en utilisant l’ATP comme source d’énergie. En particulier, une kinésine importante appelée Eg5 forme les ponts qui organisent les chevauchements antiparallèles des microtubules. La dynéine est aussi une motrice, mais elle se déplace sur les microtubules dans le sens opposé par rapport à Eg5. Elle participe à l’organisation des pôles du fuseau dans les cellules animales. Les ovocytes matures non fertilisés (communément appelés oeufs) de la grenouille Xenopus laevis sont naturellement arrêtés en métaphase 2 de la méiose et organisent leurs fuseaux en l’absence de centrosomes [
2]. Ce système a permis de démontrer que le fuseau se forme autour de l’ADN car la chromatine génère la majorité des microtubules [
3]. Cette nucléation spatialement restreinte est la conséquence de la phosphorylation locale d’une petite protéine appelé Ran par une kinase associée à la chromatine [
4]. Pour obtenir leurs résultats, Heald et al. avaient utilisé des billes d’un diamètre de 2,8 µm, recouvertes d’ADN. L’ADN, une fois incubé dans un extrait d’œufs de xénope, s’organise en chromatine et est ainsi capable d’induire la formation de fuseaux mitotiques. Notre approche a été similaire [3] mais une étape supplémentaire de microfabrication nous a permis de contrôler l’adhésion des billes, et de choisir ainsi la géométrie de la chromatine autour de laquelle les fuseaux se forment. Il ne restait plus qu’à corréler la quantité et la géométrie de la chromatine avec la symétrie et les dimensions des fuseaux mitotiques pour apprendre comment la chromatine « façonne » le fuseau mitotique [
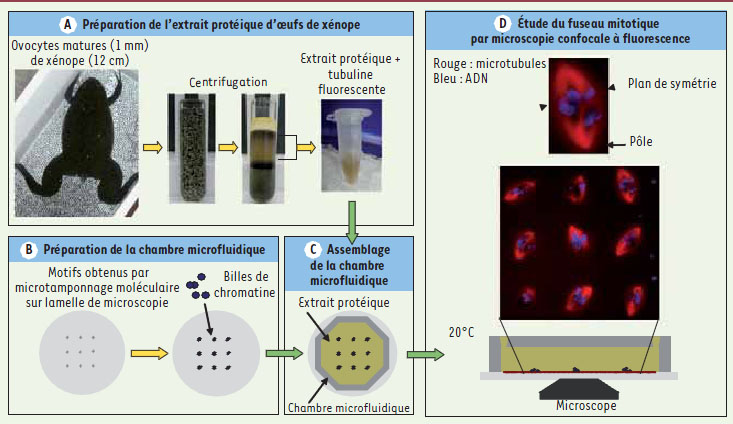
5]. En pratique, le motif de chromatine obtenu par microtamponnage est enfermé dans une chambre microfluidique qui est remplie d’extraits protéiques. La formation des fuseaux est observée par microscopie confocale (Figure 1).
 | Figure 1.
Formation de fuseaux mitotiques in vitro. A. Un extrait protéique est préparé à partir d’œufs de xénope. Les œufs sont collectés ; leur enveloppe de protection gélatineuse est dissoute ; ils sont centrifugés. La fraction cytosolique est alors collectée puis conservée sur glace. B. Des billes de chromatine sont fixées à un motif obtenu par microtamponnage moléculaire. C. L’ensemble est ensuite enfermé dans une chambre microfluidique en polymère. Cette chambre est alors remplie avec l’extrait protéique fraîchement préparé, contenant de la tubuline fluorescente (pour visualiser les microtubules) ainsi qu’un marqueur d’ADN. D. Le résultat est visualisé à l’aide d’un microscope confocal thermorégulé à 20ºC. |
|
Influence de la géométrie de la chromatine sur la symétrie des fuseaux : démonstration expérimentale Le dispositif expérimental fut validé avec un motif de disques de 15 µm de diamètre. Sur chaque disque, la quantité totale d’ADN était de 6 pg, ce qui correspond environ à la charge d’un fuseau mitotique chez X. laevis [
6]. Les fuseaux produits avaient une longueur moyenne de 31,76 ± 4,03 µm (n = 300), ce qui correspond bien à la longueur des fuseaux chez l’animal [
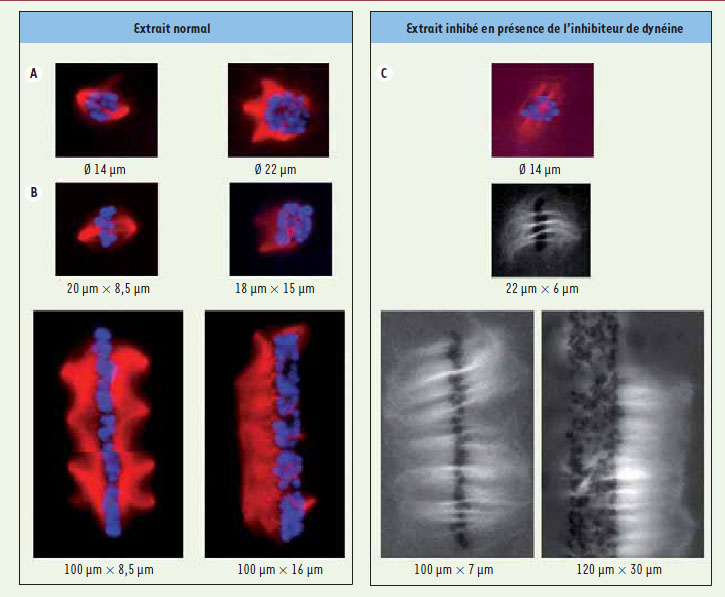
7]. Nous avons ensuite modifié la charge d’ADN par bille, pour changer la quantité de chromatine à géométrie constante. En multipliant ainsi par cinq la quantité d’ADN, les fuseaux ont atteint une longueur de 35,30 ± 4,01 µm, soit une augmentation de 10 %. La quantité de chromatine influence donc la longueur du fuseau, mais c’est un effet mineur comparé à ce que nous avons observé ensuite en changeant la géométrie de la chromatine. Pour changer la géométrie de la chromatine, nous avons d’abord fait varier le diamètre des disques (Figure 2A). Les fuseaux bipolaires se forment de manière fiable entre 14 et 18 µm, et leur longueur augmente de manière linéaire en fonction du diamètre du disque de chromatine. Lorsque le diamètre est inférieur à 8 µm, la nucléation de microtubules est insuffisante et il n’y a pas formation de fuseau. Sur des disques de plus de 20 µm, les structures sont multipolaires (Figure 2A). Il est aussi possible de changer le motif adhésif sur lequel les billes de chromatine sont immobilisées. Les fuseaux se forment aussi si la chromatine est rectangulaire (Figure 2B), mais il y a des limites à ne pas dépasser. Si la barre est trop longue, une multitude de pôles se forment, tous les 23,11 ± 6,33 µm en moyenne, et les fuseaux, croisés et imbriqués, sont inopérants. Si la barre de chromatine dépasse une largeur de 13 µm, les microtubules se retrouvent tous du même côté ! En variant la géométrie de la chromatine, nous avons ainsi révélé la capacité de la chromatine à façonner le fuseau mais également une adaptabilité limitée des mécanismes d’organisation des microtubules face à des distributions anormales de chromatine. Lorsque la bipolarité du fuseau ne peut s’établir durablement, des structures asymétriques ou multipolaires sont produites. Par exemple, lorsque la chromatine est trop large, le chevauchement, qui est normalement organisé par Eg5, ne se fait pas et la structure ne devient pas symétrique.
 | Figure 2.
Fuseaux mitotiques obtenus sur différents motifs de chromatine. Fuseaux et autres structures sont obtenus sur des motifs circulaires (A) et rectangulaires(B) de différentes dimensions (bleu : ADN, rouge : microtubules). C. Structures obtenues sur les mêmes motifs de chromatine, mais en présence d’un inhibiteur de la dynéine, ce qui empêche la formation de pôles (couleurs comme A et B. Les images en noir et blanc ne montrent que les microtubules, mais l’ombre des billes est visible). |
|
Le fuseau sans pôles des plantes ou comment ségréger une charge importante d’ADN Ces résultats permettent d’estimer la charge maximale de chromatine qui peut être ségrégée par un fuseau mitotique. En effet, ils montrent que, quelle que soit sa forme (cercle, rectangle), les dimensions qui caractérisent cette forme (rayon, longueur et largeur) doivent être en dessous d’un certain seuil. Au-delà de ces seuils, les structures produites n’ont pas la symétrie miroir nécessaire pour répartir équitablement les chromosomes. De manière remarquable, il est possible d’imiter un fuseau mitotique végétal, en ajoutant une protéine appelée p50 à l’extrait de xénope, ce qui empêche la dynéine d’organiser les pôles du fuseau (Figure 2C). Dans ces conditions, la longueur d’une barre de chromatine n’est plus un facteur limitant ! Même sur des barres de chromatine de plus de 100 µm, les microtubules s’organisent de manière parfaitement symétrique. Même si le seuil sur la largeur existe toujours, cela montre que, toutes choses égales par ailleurs, un fuseau sans pôle a une capacité supérieure à celle d’un fuseau avec pôles. Cela peut être avantageux, et effectivement, cette stratégie a prévalu pour les plantes à graines au cours de l’évolution. Ces plantes ont perdu à la fois centrosomes [
8] et dynéine [
9], qui sont nécessaires aux deux mécanismes connus de formation des pôles. Leurs fuseaux sans pôle peuvent accommoder des génomes énormes. Certaines plantes contiennent jusqu’à 260 pg d’ADN par noyau, soit une charge à ségréger 40 fois plus importante que celle d’une cellule de xénope ou d’Homme. |
Et maintenant le fuseau en équation… En conclusion, à géométrie égale, la variation de la masse de chromatine influence peu la longueur du fuseau. Par contre, la modification de la géométrie a un effet linéaire sur la longueur des fuseaux, quand elle ne détruit pas purement et simplement la symétrie du fuseau. Pour finir, la méthode développée présente deux autres avancées techniques majeures qui sont d’une part la possibilité de filmer la dynamique de formation des fuseaux mitotiques in vitro, et d’autre part l’obtention d’un très grand nombre de structures à chaque expérience. Ce seront des avantages décisifs dans la phase de recherche qui s’ouvre maintenant, dont le but est de décrire quantitativement l’assemblage du fuseau mitotique à l’aide d’un modèle mathématique. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous remercions Stéphanie Blandin, Ludovic Brun et Laure Plantard pour leur relecture du document. Le laboratoire de F. Nedelec à l’EMBL est financé par BioMS (www.bioms.de), par la fondation Volkswagen et par le programme Human Frontier Science, contrat RGY84.
|
1. Castro A, Vigneron S, Lorca T, Labbé JC. La mitose sous surveillance. Med Sci (Paris) 2003; 19 : 309–17. 2. Terret ME, Wassmann K. Le point faible méiotique : la première division. Med Sci (Paris) 2008; 24 : 197–203. 3. Heald R, Tournebize R, Blank T, et al. Self-organization of microtubules into bipolar spindles around artificial chromosomes in Xenopus egg extracts. Nature 1996; 382 : 420–5. 4. Athale CA, Dinarina A, Mora-Coral M., et al. Regulation of microtubule dynamics by reaction cascades around chromosomes. Science 2008; 322 : 1243–7. 5. Dinarina A, Pugieux C, Mora Corral M, et al. Chromatin shapes the mitotic spindle. Cell 2009; 138 : 502–13. 6. Thiébaud CH, Fischberg M. DNA content in the genus Xenopus. Chromosoma 1977; 59 : 253–7. 7. Gatlin JC, Matov A, Groen AC, et al. Spindle fusion requires Dynein-mediated sliding of oppositely oriented microtubules. Curr Biol 2009; 19 : 287–96. 8. Bornens M, Azimzadeh J. Origin and evolution of the centrosome. Adv Exp Med Biol 2007; 607 : 119–29. 9. Wickstead B, Gull K. Dyneins across eukaryotes: a comparative genomic analysis. Traffic 2007; 8 : 1708–21. |