| |
| Med Sci (Paris). 2010 February; 26(2): 137–139. Published online 2010 February 15. doi: 10.1051/medsci/2010262137.Une cytokine chimérique au secours des maladies auto-immunes Moutih Rafei1 and Jacques Galipeau2* 1Institut de recherche en immunothérapie du cancer, Université de Montréal, CP 6128, Succursale centre-ville, Montréal, Québec, H3C 3J7 Canada 2Division d’hématologie/oncologie, Hôpital général juif, Université McGill, 3755, chemin de la Côte Sainte-Catherine, Montréal, Québec, H3T 1E2 Canada MeSH keywords: Animaux, Maladies auto-immunes, traitement médicamenteux, Lymphocytes B, effets des médicaments et des substances chimiques, immunologie, transplantation , Cytokines, pharmacologie, usage thérapeutique, Modèles animaux de maladie humaine, Évaluation préclinique de médicament, Encéphalomyélite auto-immune expérimentale, thérapie, Humains, Immunothérapie adoptive |
Bifonctionnalité synergique d’une cytokine chimérique GM-CSF - IL-2 Les cytokines, notamment le granulocyte colony-stimulating factor (G-CSF) et le granulocyte-macrophage colony-stimulating factor (GM-CSF), l’interféron (IFN)-α et l’interleukine-(IL) 2, sont régulièrement utilisées à des fins thérapeutiques en oncologie et, plus particulièrement, dans le traitement du mélanome et de l’hypernéphrome (ou cancer du rein à cellules claires) [
1]. Par ailleurs, les interférons et les interleukines sont prisés pour leurs propriétés immunostimulatrices, utiles pour bloquer le développement des tumeurs et pouvant, à l’occasion, entraîner leur régression. Ces données nous ont amenés à proposer le concept selon lequel une cytokine chimérique née de la fusion de deux protéines immunostimulatrices distinctes - une fusokine douée d’une bifonctionnalité synergique - serait capable de stimuler simultanément les réponses immunes innées et adaptives. En effet, nous avons déjà démontré que la fusion du GM-CSF à l’IL-2 (GIFT2) confère à cette protéine chimérique des propriétés pro-inflammatoires [
2]. Forts de ce succès, nous avons produit une fusokine GIFT de seconde génération mariant le GM-CSF à l’IL-15 (GIFT15). Comme l’IL-15 a été décrite comme stimulant fortement l’immunité innée, nous nous attendions à ce que GIFT15 soit pro-inflammatoire. À notre grande surprise, son action s’est avérée plutôt fortement immunosuppressive [
3]. En effet, une analyse de la fonctionnalité de GIFT15 a démontré que cette fusokine se lie au récepteur de l’IL-15 et déclenche une signalisation aberrante en aval caractérisée par une hyperactivation de STAT3 [3]. Toutes les cellules ayant un rôle dans l’immunité, qu’elles soient lymphoïdes ou myéloïdes, qui arborent le récepteur de l’IL-15 perdent leur capacité à participer à une réaction immune normale quand elles sont exposées à GIFT15. Ces effets ont été testés chez des souris possédant un système immunitaire intact et chez lesquelles des cellules tumorales humaines ont été greffées. Contrairement aux souris qui n’ont pas reçu de GIFT15, qui ont rejeté le greffon cellulaire, les animaux traités avec la fusokine ont toléré la greffe tumorale [3]. Ces résultats suggèrent que GIFT15 exerce une fonction suppressive de l’alloréactivité lors de greffes tissulaires non apparentées, voire permet même de tolérer des xénogreffes. |
Effet thérapeutique de la fusokine GM-CSF - IL-15 dans les maladies auto-immunes Ce résultat prometteur nous a incités à tester l’effet de GIFT15 dans le traitement de maladies auto-immunes associées causées par l’activation de cellules T autoréactives. Tel est le cas de la sclérose en plaques [
4]. Plusieurs stratégies sont utilisées dans le traitement de cette maladie : l’interféron β (IFN-β), l’acétate de glatiramère, le mitoxantrone et le natalizumab1, [4,
11]. Toutefois, en dépit des résultats encourageants chez les patients, l’efficacité de ces thérapies est partielle, atténuant la progression de la maladie. Une approche de thérapie cellulaire (testée dans des modèles animaux) consiste à administrer des cellules suppressives telles que les cellules T régulatrices [
5], qui peuvent exercer un effet suppressif persistant en provoquant la sécrétion, chez l’hôte, de facteurs inhibiteurs sans induire d’effets secondaires [5]. Les lymphocytes B suppresseurs (désignés aujourd’hui sous le nom de cellules B reg) possèdent aussi une excellente capacité à inhiber l’inflammation due à leur sécrétion d’IL-10, une cytokine anti-inflammatoire [
6]. Par exemple, l’induction d’une encéphalite allergique expérimentale (EAE), un modèle animal de sclérose en plaques, chez des souris déficientes en lymphocytes B, entraîne une pathologie plus sévère que celle qui est observée chez des souris dont le nombre de lymphocytes B est normal [
7]. Dans ce dernier cas, le transfert adoptif de lymphocytes B normaux chez ces souris a amélioré leur état clinique tandis que le transfert de cellules B déficientes en IL-10 n’a eu aucun effet thérapeutique [7]. Malheureusement, l’utilisation de cellules B reg chez l’homme est difficile car ces cellules sont présentes en très faible nombre chez l’humain. De plus, il n’existe actuellement aucune méthode permettant de les amplifier in vitro [
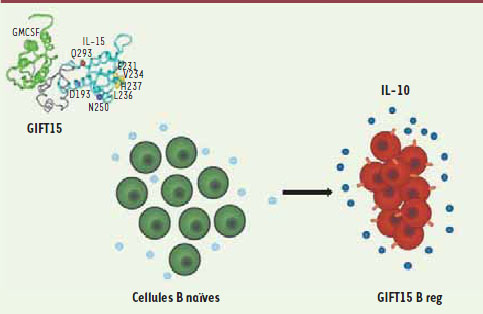
8]. Nous avons observé que la fusokine chimère GIFT15 transforme les lymphocytes B naïfs en cellules suppressives B reg (Figure 1). Les cellules B reg exercent, comme les cellules T reg mieux connues, un rôle immunosuppresseur, mais elles s’en distinguent par leur abondante production d’IL-10 [
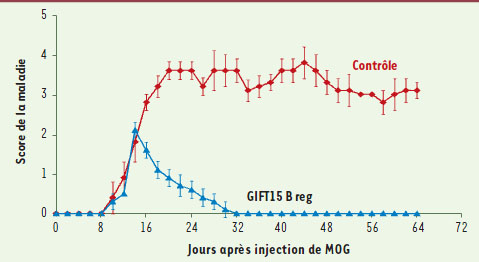
9]. L’idée d’utiliser GIFT15 pour amplifier une population de B reg qui pourrait être ensuite être administrée comme une thérapie cellulaire autologue nous paraissait séduisante, et nous avons testé cette stratégie et l’effet pharmaceutique des B reg ainsi obtenus dans un modèle murin de sclérose en plaques [9]. Une seule injection par voie intraveineuse d’un million de cellules B reg chez des souris souffrant d’encéphalite allergique entraîne une rémission complète et durable chez virtuellement toutes les souris traitées (Figure 2). Cet effet clinique est toutefois dépendant à la fois de la production d’IL-10 et de l’expression du complexe majeur d’histocompatibilité de classe II par les B reg [9].
 | Figure 1.
La genèse de lymphocytes B reg par la fusokine GIFT15.
|
 | Figure 2.
Effet thérapeutique des lymphocytes B reg. L’injection par voie intraveineuse de cellules B reg amplifiées in vitro par la fusokine GIFT15 bloque le développement de la pathologie immune dans un modèle animal de sclérose en plaques. MOG : myelin oligodendrocyte glycoprotein. |
|
Conclusion et perspectives Nous avons montré que GIFT15 stimule la genèse ex vivo d’un produit cellulaire autologue dérivé de lymphocytes B qui possède un effet immunosuppresseur important dans un modèle murin de sclérose en plaques. Rien n’interdit d’envisager que cette même plateforme pharmaceutique de thérapie cellulaire pourrait être fort utile en vue des traitements d’autres pathologies hyperimmunes comme le lupus, la maladie de Crohn, l’arthrite inflammatoire (polyarthrite rhumatoïde) et le rejet immun d’allogreffes. Une avancée conceptuelle importante réside dans l’observation que la création d’une fusokine chimérique résultant du mariage forcé de deux cytokines dotées de propriétés biochimiques distinctes aboutit à une protéine dont les effets biochimiques sont inattendus et contre-intuitifs ; d’autres molécules de ce type sont en cours de développement [
10]. Ce type d’approche pharmacologique visant à confondre Dame Nature pourrait être fructueux pour la conceptualisation et la mise au point de molécules consœurs susceptibles de moduler l’immunité à des fins thérapeutiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. McDermott DF. Immunotherapy of metastatic renal cell carcinoma. Cancer 2009; 115 (suppl 10) : 2298–305. 2. Stagg J, Wu JH, Bougamin N, et al. Granulocyte-macrophage colony-stimulating factor and interleukin-2 fusion of cDNA for cancer gene immunotherapy. Cancer Res 2004; 64 : 8795–99. 3. Rafei M, Wu JH, Annabi B, et al. A GMCSF and IL15 Fusokine Leads to paradoxical immunosuppression in vivo via asymetrical JAK/STAT signaling through the IL15 receptor complex. Blood 2007; 109 : 2234–42. 4. Hartung HP, Bar-Or A, Zoukos Y. What do we know about the mechanism of action of disease-modifying treatments in MS ? J Neurol 2004; 251 (suppl 5) : v12–29. 5. Stern JN, Keskin DB, Zhang H, et al. Amino acid copolymerspecific IL-10-secreting regulatory T-cells that ameliorate autoimmune diseases in mice. Proc Natl Acad Sci USA 2008; 105 : 5172–6. 6. Neta R, Salvin SB. Specific suppression of delayed hypersensitivity: the possible presence of a suppressor B cell in the regulation of delayed hypersensitivity. J Immunol 1974; 113 : 1716–25. 7. Fillatreau S, Sweenie CH, McGeachy MJ, et al. B cells regulate autoimmunity by provision of IL-10. Nat Immunol 2002; 3 : 944–50. 8. Bouaziz JD, Yanaba K, Tedder TF. Regulatory B cells as inhibitors of immune responses and inflammation. Immunol Rev 2008; 224 : 201–14. 9. Rafei M, Hsieh J, Zehntner S, et al. A granulocyte-macrophage colony-stimulating factor and interleukin-15 fusokine induces a regulatory B cell population with immune suppressive properties. Nat Med 2009; 15 : 1038–45. 10. Rafei M, Campeau PM, Wu JH, et al. Selective inhibition of CCR2 expressing lymphomyeloid cells in experimental autoimmune encephalomyelitis by a GM-CSF-MCP1 fusokine. J Immunol 2009; 182 : 2620–7. 11. Papeix C, Lubetzki C. Anticorps monoclonaux dans la sclérose en plaques. Med Sci 2009; 25 : 1113–5. |