| |
| Med Sci (Paris). 2010 February; 26(2): 119–120. Published online 2010 February 15. doi: 10.1051/medsci/2010262119.B7-H6 : un nouveau signal d’alarme pour les cellules natural killer
Myriam Baratin1* and Éric Vivier2 1Centre d’immunologie de Marseille-Luminy, CNRS-Inserm-Université de la Méditerranée, Campus de Luminy, Case 906, 13288 Marseille, France 2Centre d’immunologie de Marseille-Luminy, CNRS-Inserm, Hôpital de la Conception, 147, boulevard Baille, 13385 Marseille Cedex 5, France MeSH keywords: Antigène CD80, immunologie, Antigènes B7, Humains, Surveillance immunologique, Cellules tueuses naturelles, Modèles immunologiques, Sous-famille K des récepteurs de cellules NK de type lectine, Récepteur-3 de déclenchement de cytotoxicité naturelle, Tumeurs, Récepteurs de cellules tueuses naturelles |
L’hypothèse selon laquelle il existe une résistance immunologique aux tumeurs a été émise dès le début du XXe siècle par Erlich. Cette idée fut reprise à la fin des années 1950 par Thomas et Burnet qui ont postulé l’existence d’une surveillance immunitaire garantissant l’élimination des cellules cancéreuses et plus généralement de toute cellule anormale. Ce concept qui, à l’origine, impliquait les effecteurs du système immunitaire adaptatif a été mis à mal par différentes observations faites dans plusieurs modèles de souris immunodéficientes [
1]. Cependant la caractérisation de molécules induites en réponse au stress cellulaire a suggéré que la première ligne de défense contre les tumeurs pouvait être assurée par les effecteurs de l’immunité innée, tels que les lymphocytes T γδ, les macrophages mais également les cellules natural killer (NK). Ces dernières ont d’ailleurs été identifiées il y a plus de 35 ans comme des lymphocytes capables de tuer certaines cellules cancéreuses sans immunisation spécifique préalable [
2]. Depuis, de nombreuses études chez la souris ont montré que les cellules NK étaient impliquées dans l’éradication de tumeurs transplantées mais aussi spontanées [
3]. Chez l’homme, la plupart des données leur attribuant un rôle antitumoral proviennent d’études conduites in vitro. La fonction des cellules NK n’est cependant pas limitée à la détection des cellules tumorales puisque leur spectre d’action inclut les cellules infectées par différents pathogènes tels que des virus ou des parasites. En outre, les cellules NK jouent un rôle important dans la mise en place et la régulation de la réponse immunitaire adaptative grâce à leur mobilisation précoce en réponse à l’inflammation et à la production de chimiokines et de cytokines [
4]. |
Récepteurs activateurs et inhibiteurs des cellules NK Les mécanismes moléculaires permettant aux cellules NK de distinguer une cellule stressée d’une cellule saine reposent sur un ensemble de récepteurs activateurs et inhibiteurs dont l’engagement va moduler leur activation [
5]. Dès le début des années 1990, il a été établi que les cellules NK reconnaissaient les molécules d’histocompatibilité de classe I (CMH I) par l’intermédiaire de récepteurs de surface qui inhibent leur activité. Ainsi les cellules saines exprimant constitutivement ces molécules sont protégées des cellules NK alors que des cellules dont l’expression du MHC I est déficiente, comme certaines cellules tumorales ou infectées, sont sensibles à leur attaque [
6]. Par la suite, la découverte de récepteurs comme les NCR (natural cytotoxicity receptor), NKG2D ou encore DNAM-1 (DNAX accessory molecule-1) a montré que l’activité des cellules NK dépendait également de l’intégration de signaux activateurs [
7]. Alors que de nombreux ligands ont été identifiés pour NKG2D et DNAM-1, la nature des ligands des NCR n’est toujours pas clairement définie. Pourtant les 3 membres des NCR, NKp30, NKp46 et NKp44 jouent un rôle prépondérant dans la reconnaissance des cellules tumorales comme l’ont montré différents travaux [
8]. Une meilleure compréhension de l’implication des cellules NK dans la surveillance antitumorale nécessite donc l’identification de ces ligands. |
B7-H6, un nouveau ligand de NKp30 Dans ce cadre nous venons de caractériser un ligand tumoral de NKp30 [
9]. Cette protéine de 51 kDa référencée sous le nom DKFZp686O24166 a pour proches homologues B7-H1 et B7-H3, deux membres de la famille B7. L’organisation de DKFZp686O24166 est semblable à celle des membres de cette famille B7 [
10] puisque c’est une protéine transmembranaire de type I possédant deux domaines immunoglobuline (Ig) dans sa partie extracellulaire qui sont codés par deux exons séparés par un intron en phase 1. Parallèlement, NKp30 présente une homologie avec CTLA-4, le récepteur des deux membres fondateurs de la famille B7. Ces observations ont donc conduit à considérer DKFZp686O24166 comme un nouveau membre de la famille B7 et à le dénommer B7-H6. Nous avons montré par la suite que l’engagement de NKp30 par B7-H6 est fonctionnel puisque des transfectants exprimant B7-H6 induisent l’activation de cellules NK alors que des transfectants exprimant B7-H1 restent sans effet. En outre, la cytotoxicité résultant de cette activation est inhibée par la protéine de fusion NKp30-Fc et par des anticorps anti-NKp30 bloquants. |
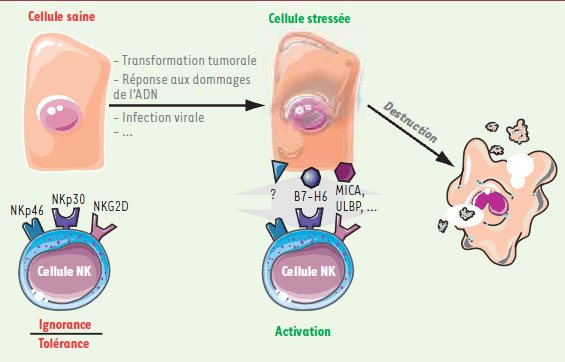
B7-H6, un signal d’alerte précoce du développement tumoral ? La distribution tissulaire de B7-H6 évoque le profil d’expression d’une molécule d’alerte. En effet aucun des 48 tissus sains testés, ni même les cellules mononucléées du sang périphérique n’expriment B7-H6 de manière détectable. En revanche B7-H6 est présente à la surface de nombreuses lignées tumorales d’origine tissulaire variée, tels que des lymphomes, des mélanomes ou encore des carcinomes. Par ailleurs cette expression est corrélée à l’intensité d’activation des cellules NK. L’expression de B7-H6 a pu être détectée également sur des cellules d’hémopathies malignes au moment du diagnostic. Les données obtenues jusqu’à présent suggèrent donc que B7-H6 est exprimée en réponse au stress cellulaire que constitue la transformation tumorale et fournirait alors un système d’alarme pour les cellules NK (Figure 1). D’autres molécules reconnues par les cellules NK présentent des caractéristiques semblables. Ainsi les nombreux ligands de NKG2D sont induits en réponse à différents types de stress tels que l’infection virale, le choc thermique ou encore l’exposition à des produits microbiens, et agissent comme autant de signaux de danger pour alerter les cellules NK [
11]. Les membres de la famille B7 sont des molécules de costimulation qui modulent la réponse immunitaire en la stimulant ou au contraire en l’inhibant afin de prévenir les dommages tissulaires liés à une réponse exacerbée [
12]. Différentes études ont montré que ce système de régulation pouvait être détourné par des cellules cancéreuses. Par exemple, la surexpression de B7-H1 par des tumeurs a été associée à une altération de la surveillance immunitaire [
13]. Afin d’établir comment la molécule B7-H6 pourrait influencer la réponse antitumorale des cellules NK, des études complémentaires doivent être menées pour explorer la régulation de son expression, sa distribution à la surface de tumeurs primaires mais également la corrélation entre son expression et la progression tumorale. Ces données devraient participer à une meilleure compréhension du rôle des cellules NK dans la surveillance immunitaire des cellules cancéreuses et pourraient constituer la base de nouvelles stratégies antitumorales.
 | Figure 1.
Les récepteurs activateurs des cellules NK constituent un système de détection des cellules anormales. En réponse à un stress comme une infection virale, un choc thermique ou encore un événement de transformation, la cellule peut exprimer certains ligands reconnus par les récepteurs activateurs des cellules NK. La cellule stressée sera alorséliminée par ces effecteurs. MICA : MHC class I chain-related molecule A ; ULBP : UL16-binding protein. |
|
M. Baratin déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. E. Vivier déclare être membre fondateur de Innate-Pharma.
|
1. Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol 2004; 22 : 329–60. 2. Kiessling R, Klein E, Wigzell H. « Natural » killer cells in the mouse. I. Cytotoxic cells with specificity for mouse Moloney leukemia cells. Specificity and distribution according to genotype. Eur J Immunol 1975; 5 : 112–7. 3. Wu J, Lanier LL. Natural killer cells and cancer. Adv Cancer Res 2003; 90 : 127–56. 4. Vivier E, Tomasello E, Baratin M, Walzer T, Ugolini S. Functions of natural killer cells. Nat Immunol 2008; 9 : 503–10. 5. Vivier E, Nunes JA, Vely F. Natural killer cell signaling pathways. Science 2004; 306 : 1517–9. 6. Karre K, Ljunggren HG, Piontek G, Kiessling R. Selective rejection of H-2-deficient lymphoma variants suggests alternative immune defence strategy. Nature 1986; 319 : 675–8. 7. Bottino C, Castriconi R, Moretta L, Moretta A. Cellular ligands of activating NK receptors. Trends Immunol 2005; 26 : 221–6. 8. Moretta A, Bottino C, Vitale M, et al. Activating receptors and coreceptors involved in human natural killer cell-mediated cytolysis. Annu Rev Immunol 2001; 19 : 197–223. 9. Brandt CS, Baratin M, Yi EC, et al. The B7 family member B7-H6 is a tumor cell ligand for the activating natural killer cell receptor NKp30 in humans. J Exp Med 2009; 206 : 1495–503. 10. Olive D. Corécepteurs lymphocytaires. Med Sci (Paris) 2006; 22 : 1069–74. 11. Nausch N, Cerwenka A. NKG2D ligands in tumor immunity. Oncogene 2008; 27 : 5944–58. 12. Greenwald RJ, Freeman GJ, Sharpe AH. The B7 family revisited. Annu Rev Immunol 2005; 23 : 515–48. 13. Wintterle S, Schreiner B, Mitsdoerffer M, et al. Expression of the B7-related molecule B7-H1 by glioma cells: a potential mechanism of immune paralysis. Cancer Res 2003; 63 : 7462–7. |