| |
| Med Sci (Paris). 2010 January; 26(1): 89–94. Published online 2010 January 15. doi: 10.1051/medsci/201026189.Lasers thermiques et cicatrisation cutanée Serge Mordon,1,2* Alexandre Capon,3 Nathalie Fournier,4 and Gwen Iarmarcovai5 1Inserm U 703, Université Lille Nord de France, 52, rue du Docteur Yersin, 59120 Loos, France 2CHRU, Lille, France 3Service de chirurgie plastique et réparatrice, CHRU, Lille, France 4Centre laser dermatologique, Clapiers, France 5Service de chirurgie plastique et réparatrice, APHM, Marseille, France |
La réparation des blessures cutanées est l’un des processus biologiques les plus complexes qui se produisent au cours de la vie humaine [
1]. Après une blessure, de multiples voies biologiques sont immédiatement activées et interviennent de façon synchrone pour réparer le tissu lésé [
2,
3]. Cela met en jeu la prolifération de plusieurs tissus (épithélial, conjonctif, endothélial) afin de restituer la barrière cutanée le plus rapidement possible. Au début du développement, le tissu fœtal lésé peut être complètement recréé, sans fibrose, selon un processus qui ressemble à la régénération [
4]. En revanche, chez l’homme adulte, cette réparation conduit à la formation de tissu fibreux appelé cicatrice. La cicatrisation se déroule généralement en trois phases : phase inflammatoire, phase de prolifération et de formation du tissu et enfin phase de remodelage tissulaire [
5]. La cicatrisation cutanée est malheureusement un processus imprévisible. Si elle se déroule le plus souvent sans complication chez les sujets sains, elle est parfois source d’anomalies : cicatrisation excessive (botryomycome, chéloïdes), de mauvaise qualité (cicatrices rétractiles) ou déficitaire (plaies chroniques) [
6–
8]. Dans ces cas, la guérison est caractérisée par le dépôt de grandes quantités de matrice extracellulaire et par des altérations de la vascularisation locale et de la prolifération des cellules. |
Cicatrisation des plaies chez les mammifères : un frein à la régénération La capacité qu’a l’organisme de régénérer des parties lésées ou amputées varie beaucoup d’une espèce à l’autre. C’est ainsi que les amphibiens urodèles comme la salamandre ont conservé cette capacité de régénération [
9]. Chez cette espèce, la première phase de la régénération après amputation resssemble par certains aspects à la guérison d’une plaie chez les mammifères. Dans les deux cas, il y a activation des macrophages, formation d’un caillot de sang, migration et multiplication des cellules du derme. Chez les mammifères, ces processus conduisent à la cicatrisation de la plaie. Mais, chez les urodèles, l’ordre auquel appartiennent les salamandres, une seconde phase est enclenchée au cours de laquelle différentes cellules (fibroblastes, cellules musculaires, ostéoblastes, cellules de Schwann, etc.) se dédifférencient en cellules souches. Ces cellules souches migrent au niveau du plan d’amputation et prolifèrent pour former un amas de cellules redevenues pluripotentes. C’est à partir de cet amas que la « repousse » du membre ou de l’organe va s’effectuer, les cellules se spécialisant à nouveau pour produire les différentes composantes de l’organisme [
10]. Contrairement aux urodèles, les mammifères ont une capacité très limitée de régénération de leurs organes ou tissus. Les blessures se réparent par simple cicatrisation et l’amputation d’un membre est irréversible [
11]. Pourquoi l’homme a-t-il perdu cette capacité de régénération ? Cela reste un mystère. Les mammifères ont cependant conservé une grande partie de la machinerie moléculaire utilisée par les urodèles, mais leur potentiel de régénération est limité. Cela semble être en partie le résultat de la rapide interposition de fibrose, qui empêche la régénération tissulaire ultérieure. Cette rapide formation « cicatricielle » confère un avantage de survie parce qu’elle prévient les maladies infectieuses en empêchant les microorganismes d’envahir la plaie. Manipuler le processus de réparation des plaies chez les mammifères afin de permettre un processus de régénération nécessite probablement de pouvoir ralentir l’installation rapide de la fibrose pour permettre aux cellules souches multipotentes et/ou aux progéniteurs d’induire une régénération tissulaire plutôt que la formation de cicatrices. Récemment, différentes équipes ont cherché à bloquer la formation de cicatrices, en particulier en diminuant la production de TGF-β1 (transforming growth factor) ou en augmentant la production de TGF-β3, voire en agissant sur d’autres médiateurs pro-inflammatoires [4,
12–
14]. Le TGF-β1 agit en augmentant la réponse immunitaire par chimiotaxie, en favorisant la contraction de la plaie par les myofibroblastes et en induisant une ré-épithélialisation rapide ; le TGF-β3 quant à lui favorise plutôt la différenciation cellulaire et une meilleure organisation tissulaire au site de la blessure [
13]. Bien que d’énormes progrès aient été accomplis dans l’identification de la myriade de facteurs impliqués dans les conditions normales et pathologiques de la réparation tissulaire, ces résultats n’ont pas abouti à des avancées thérapeutiques substantielles. Il est maintenant admis qu’un agent chimique seul, par exemple un facteur de croissance, a seulement un impact modéré sur la réparation des plaies en clinique ; cela s’explique probablement par la plasticité et la redondance des composants des processus de réparation de la blessure ou par la dégradation rapide des facteurs dans la plaie [
15]. Cependant, de récents résultats suggèrent que des changements de l’environnement physique (thermique ou mécanique) de la plaie peuvent modifier le processus de cicatrisation [
16–
18]. Des travaux récents au moyen de lasers thermiques ont clairement montré qu’il devenait possible d’obtenir un quasi-processus de régénération de la plaie [
19]. |
La cicatrisation cutanée assistée par lasers Les premiers travaux sur l’amélioration de la cicatrisation cutanée par laser datent d’une vingtaine d’années : Abergel utilisa un laser Nd:YAG 1,06 µm pour la « soudure » cutanée [
20]. Mais il est vite apparu difficile de souder la peau comme on soude les vaisseaux [
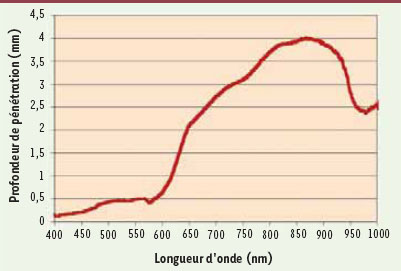
21]. Car même si Abergel remarque une accélération du processus de cicatrisation et une amélioration de l’aspect de la cicatrice, la résistance de la plaie à la traction dans les premiers jours reste très faible et très inférieure à celle des plaies suturées par fils. De plus, l’énergie nécessaire pour obtenir une soudure cutanée demande une importante élévation de la température tissulaire, étape obligatoire pour obtenir la dénaturation et l’interdigitation des fibres de collagène. Les conséquences en sont inévitablement la coagulation tissulaire et la nécrose par brûlure qui ralentissent la cicatrisation et dégradent sa qualité. Les travaux se sont donc naturellement orientés vers l’utilisation de paramètres lasers différents, qui ne sont pas susceptibles d’endommager la structure tissulaire, mais agissent uniquement sur la modification de la réponse inflammatoire et par conséquent sur le processus cicatriciel. À ce jour, deux lasers différents sont utilisés : le laser à colorant pulsé qui émet à une longueur d’onde de 585 nm et le laser diode qui émet à 810 nm. C’est dans la zone qui s’étend entre 650 et 950 nm que l’absorption par l’eau est la plus faible et cette zone sera donc la plus propice à une illumination en profondeur (Figure 1).  | Figure 1.
Profondeur de pénétration dans la peau de la lumière (en mm) en fonction de la longueur d’onde (nm) (d’après [
26]). |
|
Résultats des études cliniques La technique par laser à colorant pulsé L’amélioration de la réponse cicatricielle au moyen du laser à colorant pulsé (PDL) a fait l’objet de plusieurs évaluations cliniques. En 2003, Nouri et al. ont procédé à une évaluation sur 11 patients (phototype I-IV 1) dont les plaies avaient nécessité une suture, présentant des cicatrices linéaires de plus de 2 cm [
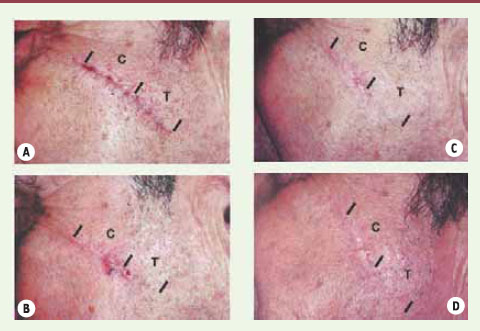
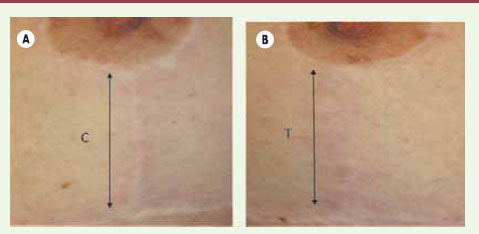
22]. Immédiatement après le retrait des fils de suture, pour chaque patient, la moitié de la cicatrice était traitée à trois reprises sur une période de 6 mois (délai de 4 à 10 semaines entre chaque séance) avec le laser PDL (Cynosure, Inc, Chelmsford, MA) 585 nm (450 µs, spot : 10-mm, 3,5 J/cm² avec 10 % de chevauchement), l’autre moitié servant de contrôle. L’évaluation était réalisée par un observateur indépendant qui quantifiait le résultat au moyen de l’échelle de Vancouver (VSS), échelle qui prend en compte la pigmentation, la vascularisation, la flexibilité et la hauteur de la cicatrice et un score prenant en compte l’apparence esthétique (1 à 10). Un mois après la dernière séance, l’analyse finale de la cicatrice a révélé une différence significative entre les zones traitées et non traitées (Figure 2). L’analyse a montré une amélioration de 54 % du score mesuré par la VSS entre le premier traitement et le score final pour la partie traitée au laser PDL contre 10 % pour la zone contrôle. En ce qui concerne l’apparence esthétique de la cicatrice, les scores obtenus étaient de 7,3 pour la partie traitée au laser et 5,2 pour la partie contrôle.  | Figure 2.
Traitement par laser à colorant pulsé 585 nm (450 µs, diamètre : 10 mm, 3,5 J/cm²). Photographies de la cicatrice le jour de l’enlèvement de la suture (A), un mois après le premier traitement laser (B), un mois après le deuxième traitement laser (C), et lors de l’évaluation finale à un mois après le 3 e traitement (D). La moitié traitée (T) et la moitié contrôle (C) sont indiquées (d’après [ 18]). |
En 2006, Conologue et al. ont réalisé une évaluation chez 16 patients (11 hommes et 5 femmes - phototype de I à IV) présentant des cicatrices linéaires postopératoires de plus de 2 cm. Comme pour l’étude précédente, une seule moitié de la cicatrice était traitée avec un laser PDL émettant à 595 nm (Vbeam laser, Candela Corporation, Wayland, MA) avec un spot de 7 mm, une impulsion de 1,5 ms et une fluence de 8,0 J/cm² [
23]. Des critères d’évaluation clinique semblables à ceux de l’étude précédente montrent que 1 mois après 3 séances de laser débutées immédiatement après le retrait des fils de suture, la VSS est améliorée de 60 % pour la zone traitée par laser contre 3 % pour la zone contrôle. Le gain est doublé pour le score concernant l’aspect esthétique dans la zone traitée par laser. Les études histologiques des zones traitées par laser montrent que le nombre des fibroblastes est similaire à celui de la peau normale, avec un alignement multidirectionnel normal des fibres de collagène et une présence importante de fibres d’élastine. Ces études semblent donc confirmer que le laser à colorant pulsé peut améliorer le processus de cicatrisation. La technique par laser diode LASH Activation des protéines HSP70 de choc thermique La technique LASH a été mise au point à Lille. Les premiers travaux expérimentaux ont été réalisés en 2000 chez le rat Hairless et ont montré que des sutures chirurgicales traitées par un laser diode 810 nm permettaient d’obtenir des cicatrices nettement moins visibles (voire totalement inexistantes) que chez les rats contrôles [
24]. Une analyse histologique a confirmé l’accélération du processus cicatriciel et l’analyse tensiométrique a montré une meilleure résistance mécanique des plaies traitées par laser par rapport aux contrôles. L’irradiation laser appliquée dans l’épiderme et le derme entraîne une augmentation modérée de la température tissulaire, provoquant l’activation des protéines de stress (HSP70, heat shock protein) [
25]. Ces HSP 70 modulent le processus de réaction inflammatoire [26] et sont nécessaires à la cicatrisation [
27]. Leur absence compromet ce processus [
28,
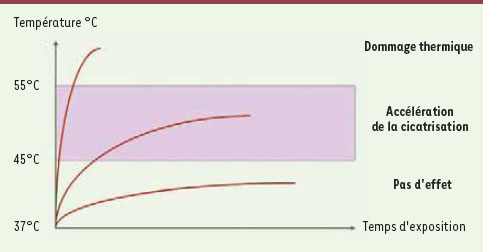
29]. Bien évidemment, dans le cas d’une action thermique, le choix des paramètres est critique afin d’obtenir une température optimale, comme l’illustre la Figure 3 [
30]. Les différents travaux de l’équipe de Jansen ont cependant bien montré que le laser permettait d’obtenir l’induction de HSP 70 dans une gamme de température allant de 45°C à 55°C [
31]. Souil a pu constater que l’expression de HSP 70 constitutive est principalement limitée à la couche supérieure de l’épiderme. Le chauffage par le laser accroît cette expression dans l’épiderme et induit la synthèse de novo de cette protéine dans d’autres structures de la peau, notamment autour des vaisseaux sanguins, dans les follicules pileux et les glandes sébacées [25]. Cette réponse au choc thermique pourrait être responsable de la production accrue de facteurs de croissance et en particulier pourrait conduire à la modification du profil d’expression du TGF-β [
32,
33]. Certains auteurs ont ainsi remarqué que l’expression prédominante du TGF-β3 par rapport à celle du TGF-β1 et du TGF-β2 conduit à une amélioration de la cicatrisation cutanée [
34,
35]. En effet, la différence la plus significative entre les tissus normaux et les tissus cicatriciels semble être liée à l’orientation de la matrice de collagène et à la fibrose résultante [
17].  | Figure 3.
Gamme de température requise pour obtenir la production de HSP 70 (d’après [ 26, 31]). |
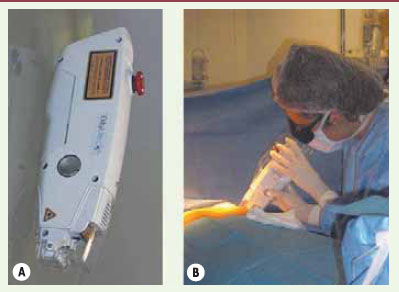
Cette approche originale de cicatrisation cutanée assistée par une diode-laser de 810 nm a été évaluée chez des patients de phototypes I-IV (selon la classification de Fitzpatrick) pour lesquels une intervention de chirurgie plastique (hors visage) était programmée, notamment dans le cas de cicatrices longues et linéaires telles qu’on en observe lors d’abdominoplastie ou de réduction mammaire. Le système laser (Ekkylite, Ekkyo, Aix-en-Provence) est un laser diode 810 nm portatif (Figure 4). Ce laser n’est utilisé qu’à la fin de l’intervention chirurgicale, immédiatement après la fermeture de l’incision opératoire. Ce laser délivre un spot rectangulaire de 20 mm par 4 mm. Ce spot est déplacé par l’opérateur afin de traiter la totalité de l’incision. Ainsi, une incision de 20 centimètres nécessite une durée de traitement de l’ordre de 2 minutes.
 | Figure 4.
Laser portatif développé par la société Ekkyo (Aix-en-Provence, France). Ce laser émet un faisceau de 4 mm par 20 mm (A). Ce faisceau est appliqué le long de l’incision immédiatement après fermeture (B). Les paramètres typiquement utilisés sont : longueur d’onde : 810 nm, puissance : 8 W, fluence : 80 à 130 J/cm². |
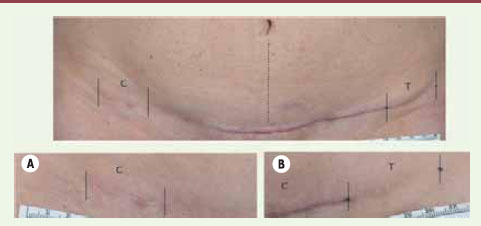
Dans une étude pilote menée sur 15 patients (14 femmes et un homme phototype I à IV), une différence significative a été observée à 12 mois à la dose 80-130 J/cm², basée sur une comparaison de cicatrices traitées et non traitées par laser. Aucune complication n’a été enregistrée [19]. L’apparence évaluée avec l’échelle VSS montre une amélioration significative comme l’illustrent les Figures 5 et 6. 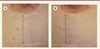 | Figure 5.
Traitement par laser diode 810 nm (technique LASH). Sein, cicatrice verticale chez une femme de 35 ans. A. Sein droit non traité. B. Sein gauche traité par laser (résultats à 12 mois). Les parties traitées (T) et contrôles (C) sont indiquées. Le laser a été appliqué le long de l’incision immédiatement après suture (T) avec une fluence de 110 J/cm². |
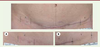 | Figure 6.
Traitement par laser diode 810 nm (technique LASH). Abdominoplastie, femme de 47 ans. A. Zone non traitée. B. Zone traitée par laser (résultat à 12 mois). Les parties traitées (T) et contrôles (C) sont indiquées. Le laser a été appliqué le long de l’incision immédiatement après suture (T) avec une fluence de 130 J/cm². |
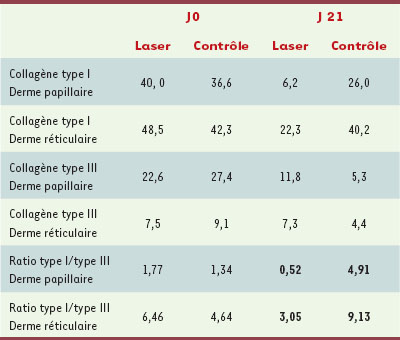
Le rôle des collagènes de type I et III Plus récemment, des études histologiques réalisées chez des patients ont analysé plus particulièrement l’expression des collagènes de type I et III et de la fibronectine. Les collagènes de type I et de type III étaient révélés par immunohistochimie sur coupes après inclusion en paraffine avec des anticorps polyclonaux anti-collagène I et anti-collagène de type III 2. La fibronectine était révélée dans les mêmes conditions aprè s marquage avec un anticorps monoclonal anti-fibronectine. L’expression du collagène de type I, de type III, et de la fibronectine a été quantifiée par analyse d’images à l’aide du logiciel LEICA QWIN (Leica Microsystèmes SAS, Nanterre, France) et exprimée en pourcentage de surface occupée dans le derme papillaire ou réticulaire. Ces études ont pu montrer une très nette diminution du collagène de type I et de la fibronectine dans les cicatrices traitées par laser alors que c’est le collagène de type III qui diminue dans les cicatrices contrôles (Tableau I) [
36].
 | Tableau I.
Quantification du collagène de type I et type III dans des plaies traitées par laser diode 810 nm ou des plaies contrôles. La valeur du rapport collagène type I : type III est plus faible dans les plaies traitées par laser. Expression en pourcentage de surface occupée par la protéine (d’après [ 36]). |
Ces observations sont en accord avec différents travaux qui montrent bien que la valeur du rapport entre les collagènes de type I et de type III joue un rôle déterminant dans le processus de formation de la cicatrice [
37–
40]. Les processus cicatriciels pathologiques sont systématiquement associés à une valeur élevée du rapport type I-type III alors qu’une valeur faible conduit à un processus de régénération (scarless healing dans la littérature anglo-saxonne) [
41,
42]. Récemment, l’équipe de Laubach a montré aussi qu’il n’y avait pas de signe de dégradation du collagène de type III 3 mois après le traitement par laser [
43]. |
Une cicatrice de mauvaise qualité est invalidante tant sur le plan fonctionnel qu’esthétique. Les effets thermiques induits par la lumière monochromatique d’un laser peuvent moduler la réponse cicatricielle. Les deux techniques actuellement proposées : (1) le laser à colorant pulsé (PDL) et (2) le laser infrarouge (810 nm, technique LASH) sont différentes à la fois par le type de laser et le mode de traitement. Elles conduisent cependant à des résultats cliniques indiscutables. Différentes évaluations cliniques en cours devraient confirmer l’intérêt d’appliquer au plus tôt un traitement laser afin de modifier le processus de réponse inflammatoire, d’améliorer l’aspect des cicatrices et éventuellement de prévenir leurs complications. |
S. Mordon et A. Capon déclarent avoir une participation financière dans le capital de l’entreprise EKKYO et avoir participé à des interventions ponctuelles pour l’entreprise EKKYO. G. Iarmarcovai déclare avoir des liens durables avec l’entreprise EKKYO. N. Fournier déclare avoir participé à des interventions ponctuelles pour l’entreprise EKKYO.
|
Footnotes |
1. Moulin V, Goulet F, Berthod F, et al. Le génie tissulaire au service de la compréhension du vivant. Med Sci (Paris) 2003; 19 : 1003–10. 2. Rhett JM, Ghatnekar GS, Palatinus JA, et al. Novel therapies for scar reduction and regenerative healing of skin wounds. Trends Biotechnol 2008 : 26 : 173–80. 3. Gerbault O. Cicatrisation cutanée. In : Techniques chirurgicales. Chirurgie plastique reconstructrice et esthétique. Encycl Med Chir, Paris Elsevier 1999 : 45–010. 4. Ferguson MW, O’Kane S. Scar-free healing: from embryonic mechanisms to adult therapeutic intervention. Philos Trans R Soc Lond B Biol Sci 2004; 359 : 839–50. 5. Fournier N, Mordon S. Nonablative remodeling with a 1,540 nm erbium:glass laser. Dermatol Surg 2005; 31 : 1227–35. 6. Tuan TL, Nichter LS. The molecular basis of keloid and hypertrophic scar formation. Mol Med Today 1998; 4 : 19–24. 7. Köse O, Waseem A. Keloids and hypertrophic scars: are they two different sides of the same coin ? Dermatol Surg 2008; 34 : 336–46. 8. Senet P. Physiopathology of normal cutaneous cicatrization and in leg ulcer. Ann Dermatol Venereol 2001; suppl : 5–8. 9. Vriz S. nAG sur la piste de la médecine régénérative. Med Sci (Paris) 2008; 24 : 244–5. 10. Roy S, Levesque M. Limb regeneration in axolotl: is it superhealing ? Sci World J 2006; 6 (suppl 1) : 12–25. 11. Aberdam D. Réparer ou régénérer, il faut choisir. Med Sci (Paris) 2007; 23 : 791–3. 12. Kuo YR, Wu WS, Jeng SF, et al. Suppressed TGF-beta1 expression is correlated with up-regulation of matrix metalloproteinase-13 in keloid regression after flashlamp pulsed-dye laser treatment. Lasers Surg Med 2005; 36 : 38–42. 13. Schrementi ME, Ferreira AM, Zender C, DiPietro LA. Site-specific production of TGF-beta in oral mucosal and cutaneous wounds. Wound Repair Regen 2008; 16 : 80–6. 14. Vozenin-Brotons MC, Mauviel A. Comment modéliser les événements de la fibrose cutanée ? Med Sci (Paris) 2006; 22 : 172–7. 15. Gurtner GC, Werner S, Barrandon Y, Longaker MT. Wound repair and regeneration. Nature 2008; 453 : 314–21. 16. Alster TS, West TB. Treatment of scars: a review. Ann Plast Surg 1997; 39 : 418–32. 17. Mustoe TA, Cooter RD, Gold MH, et al. International clinical recommendations on scar management. Plast Reconstr Surg 2002; 110 : 560–71. 18. Aarabi S, Bhatt KA, Shi Y, et al. Mechanical load initiates hypertrophic scar formation through decreased cellular apoptosis. FASEB J 2007; 21 : 3250–61. 19. Capon AC, Gossé AR, Iarmarcovai GN, et al. Scar prevention by laser-assisted scar healing (LASH): a pilot study using an 810-nm diode-laser system. Lasers Surg Med 2008; 40 : 443–5. 20. Abergel RP, Meeker CA, Dwyer RM, et al. Nonthermal effects of ND:YAG laser on biological functions of human skin fibroblasts in culture. Lasers Surg Med 1984; 3 : 279–84. 21. Mordon SR, Martinot VL, Mitchell VA. End-to-end microvascular anastomoses with a 1.9µm diode laser. J Clin Laser Med Surg 1995; 13 : 357–61. 22. Nouri K, Jimenez GP, Harrison-Balestra C, Elgart GW. 585-nm pulsed dye laser in the treatment of surgical scars starting on the suture removal day. Dermatol Surg 2003; 29 : 65–73. 23. Conologue TD, Norwood C. Treatment of surgical scars with the cryogen-cooled 595 nm pulsed dye laser starting on the day of suture removal. Dermatol Surg 2006; 32 : 13–20. 24. Capon A, Souil E, Gauthier B, et al. Laser assisted skin closure (LASC) by using a 815-nm diode-laser system accelerates and improves wound healing. Lasers Surg Med 2001; 28 : 168–75. 25. Souil E, Capon A, Mordon S, et al. Treatment with 815-nm diode laser induces long-lasting expression of 72-kDa heat shock protein in normal rat skin. Br J Dermatol 2001; 144 : 260–6. 26. Klosterhalfen B, Klinge U, Tietze L, et al. Expression of heat shock protein 70 (HSP70) at the interface of polymer-implants in vivo. J Mater Sci Mater Med 2000; 11 : 175–81. 27. Shukla A, Dubey MP, Srivastava R, Srivastava BS. Differential expression of proteins during healing of cutaneous wounds in experimental normal and chronic models. Biochem Biophys Res Commun 1998; 244 : 434–9. 28. Oberringer M, Baum HP, Jung V, et al. Differential expression of heat shock protein 70 in well healing and chronic human wound tissue. Biochem Biophys Res Commun 1995; 214 : 1009–14. 29. Atalay M, Oksala N, Lappalainen J, et al. Heat shock proteins in diabetes and wound healing. Curr Protein Pept Sci 2009; 10 : 85–95. 30. Capon, A. Suture cutanée assistée par laser : étude des mécanismes d’accélération de la cicatrisation sur modèle animal et sur peau humaine. In : École doctorale biologie santé. Lille : Université de Lille 2, 2003. 31. Wilmink GJ, Opalenik SR, Beckham JT, et al. Molecular imaging-assisted optimization of hsp70 expression during laser-induced thermal preconditioning for wound repair enhancement. J Invest Dermatol 2009; 129 : 205–16. 32. Capon A, Mordon S. Can thermal lasers promote skin wound healing ? Am J Clin Dermatol 2003; 4 : 1–12. 33. Hantash BM, Ubeid AA, Chang H, Kafi R, Renton B. Bipolar fractional radiofrequency treatment induces neoelastogenesis and neocollagenesis. Lasers Surg Med 2009; 41 : 1–9. 34. Shah M, Foreman DM, Ferguson MW. Neutralising antibody to TGF-beta 1,2 reduces cutaneous scarring in adult rodents. J Cell Sci 1994; 107 : 1137–57. 35. Shah M, Foreman DM, Ferguson MW. Neutralisation of TGF-beta 1 and TGF-beta 2 or exogenous addition of TGF-beta 3 to cutaneous rat wounds reduces scarring. J Cell Sci 1995; 108 : 985–1002. 36. Fournier N, et al. Ultrastructural changes elicited by laser-assisted skin healing using an 810nm diode-laser system. In : 29th Annual meeting of The American Society for laser Medicine and Surgery. Washington, USA : Lasers in Surgery and Medicine, 2009. 37. Abergel RP, Pizzurro D, Meeker CA, et al. Biochemical composition of the connective tissue in keloids and analysis of collagen metabolism in keloid fibroblast cultures. J Invest Dermatol 1985; 84 : 384–90. 38. Uitto J, Perejda AJ, Abergel RP, et al. Altered steady-state ratio of type I/III procollagen mRNAs correlates with selectively increased type I procollagen biosynthesis in cultured keloid fibroblasts. Proc Natl Acad Sci USA 1985; 82 : 5935–9. 39. Friedman DW, Boyd CD, Mackenzie JW, et al. Regulation of collagen gene expression in keloids and hypertrophic scars. J Surg Res 1993; 55 : 214–22. 40. Wolfram D, Tzankov A, Pülzl P, Piza-Katzer H. Hypertrophic scars and keloids: a review of their pathophysiology, risk factors, and therapeutic management. Dermatol Surg 2009; 35 : 171–81. 41. David-Raoudi M, Tranchepain F, Deschrevel B, et al. Differential effects of hyaluronan and its fragments on fibroblasts: relation to wound healing. Wound Repair Regen 2008; 16 : 274–87. 42. Cuttle L, Nataatmadja M, Fraser JF, et al. Collagen in the scarless fetal skin wound: detection with picrosirius-polarization. Wound Repair Regen 2005; 13 : 198–204. 43. Laubach HJ, Tannous Z, Anderson RR, Manstein D. Skin responses to fractional photothermolysis. Lasers Surg Med 2006; 38 : 142–9. |