| |
| Med Sci (Paris). 2010 January; 26(1): 83–88. Published online 2010 January 15. doi: 10.1051/medsci/201026183.La polarisation des macrophages, le noeud gordien des infections bactériennes ? Jean-Louis Mege* and Christian Capo Unité de recherche sur les maladies infectieuses transmissibles et émergentes, CNRS-IRD UMR 6236, Université de la Méditerranée, Faculté de médecine, 27, boulevard Jean Moulin, 13385 Marseille Cedex 5, France |
Les monocytes circulants et les macrophages tissulaires sont des cellules myéloïdes en charge de prévenir toutes sortes d’infections microbiennes. Les macrophages résidents sont des sentinelles qui servent de première ligne d’alerte en reconnaissant divers motifs bactériens conservés et ubiquitaires [lipopolysaccharide (LPS), lipoarabinomannane] grâce à un nombre limité de récepteurs non-opsoniques [
31]. L’interaction des agents microbiens avec certains de ces récepteurs tels que l’intégrine CD11b/CD18 (CR3) conduit à leur phagocytose et, normalement, à leur élimination par la machinerie microbicide des macrophages. Ces macrophages sont également capables de présenter les produits de dégradation des agents microbiens (antigènes) aux lymphocytes T et jouent, à ce titre, un rôle important dans la réponse immune adaptative (spécifique). Cependant, certains agents infectieux ont mis au point des stratégies qui leur permettent de moduler l’activité microbicide des macrophages, affectant ainsi la réponse de l’hôte à l’infection. Les propriétés fonctionnelles des macrophages varient selon leur distribution tissulaire et leur état d’activation. Il a été montré dans les années 1970 que les macrophages deviennent pleinement microbicides lorsqu’ils sont exposés à deux signaux successifs, une cytokine de type 1, par exemple l’interféron (IFN)-γ ou le tumor necrosis factor (TNF) et un produit bactérien comme le LPS mais il est apparu par la suite que l’activation des macrophages par d’autres molécules conduit à un tableau quelque peu différent. Une classification M1/M2 des macrophages a été proposée ces dernières années sur le modèle de la polarisation lymphocytaire Th1/Th2 [
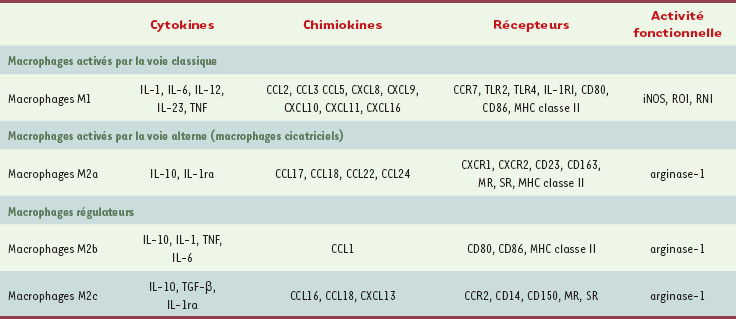
1,
2]. Les macrophages activés par la voie classique (cytokines de type 1 et produits microbiens) sont appelés macrophages M1 et ceux qui sont activés par des voies alternatives sont appelés macrophages M2. Macrophages M1 et M2 diffèrent en termes de récepteurs membranaires, de synthèse de cytokines et d’activité fonctionnelle (Tableau I). Alors que les macrophages M1 sont inflammatoires et microbicides, les macrophages M2 modulent la réponse immune (macrophages M2a et M2c) et sont faiblement microbicides. Les macrophages M2 incluent au moins trois sous-populations : les macrophages M2a induits par l’interleukine (IL)-4 et l’IL-13, les macrophages M2b induits par les complexes immuns, les agonistes des toll-like receptors (TLR) ou les récepteurs de l’IL-1 et les macrophages M2c induits par l’IL-10 et les hormones glucocorticoïdes [
3]. En réalité, cette notion de polarisation M1/M2 des macrophages recouvre un continuum d’états fonctionnels. Les macrophages peuvent ainsi être, dans un premier temps, inflammatoires avant de participer à la résolution de l’inflammation, ce qui suggère que les changements fonctionnels des macrophages résultent de modifications de leur microenvironnement [
32]. Très récemment, Mosser et Edwards, se fondant sur les propriétés de maintien de l’homéostasie des macrophages, ont proposé une nouvelle classification : macrophages activés par la voie classique, macrophages de la cicatrisation et macrophages régulateurs [
4]. Par ailleurs, la plupart des travaux ont considéré que les réponses des monocytes et des macrophages aux signaux de polarisation mettent en jeu des mécanismes similaires, ce qui justifiait l’emploi du terme macrophage M1/M2 pour désigner indistinctement les monocytes et les macrophages. Les études transcriptomiques récentes émanant de différentes équipes, y compris la nôtre, montrent que la réponse des monocytes est distincte de celle des macrophages et que leur polarisation n’est pas aussi affirmée que celle des macrophages [
5]. Leur présence transitoire dans la circulation sanguine en est probablement la cause. Nous allons consacrer cette synthèse à l’étude de la polarisation des macrophages au cours des maladies infectieuses aiguës et chroniques ; les études évoquant les monocytes seront spécifiquement citées.
 | Tableau I.
Hétérogénéité des macrophages. La NO synthase inductible (iNOS) activée dans les macrophages M1 est responsable de la production des RNI (nitrogen reactive intermediates) impliqués, tout comme les ROI (oxygen reactive intermediates), dans l’activité microbicide des macrophages. L’arginase-1 redirige le métabolisme de la L-arginine vers la production d’ornithine et de polyamines, ce qui bloque la voie de l’iNOS et donc l’activité microbicide des macrophages. IL-1RI : récepteur de type I de l’IL-1 ; MHC classe II : molécules du système majeur d’histocompatibilité de classe II ; IL-1ra : antagoniste du récepteur de l’IL-1; MR : récepteur du mannose ; SR : récepteur scavenger ; TGF : transforming growth factor.
|
|
Programme commun de réponse des macrophages à l’infection Les cellules répondent à divers agents infectieux par un programme transcriptionnel commun. Une comparaison de 32 études montre qu’un ensemble de 511 gènes est affecté dans les cellules effectrices de la réponse innée en réponse à 77 agents pathogènes [
6]. Certains gènes codant des molécules inflammatoires ou de transduction du signal partagent une régulation commune avec les leucocytes humains stimulés par des bactéries à Gram positif ou négatif [
7]. La réponse transcriptionnelle des macrophages humains exposés à un grand nombre de bactéries présente également des similitudes [
8], mais aucune étude n’a été consacrée à la polarisation des macrophages en tant que telle. Nous avons récemment collecté et comparé les données transcriptionnelles provenant de plusieurs études à grande échelle, ce qui nous a permis d’isoler de nombreux gènes impliqués dans la polarisation M1 et un seul dans la polarisation M2. Ils incluent les gènes codant des cytokines et des chimiokines [
33] ainsi que leurs récepteurs et des molécules directement impliquées dans l’activité microbicide des macrophages ou qui codent des molécules de costimulation [3]. Il est probable que cette robuste réponse M1 corresponde à un signal commun d’alerte en présence d’agents infectieux. |
Polarisation M1 et contrôle des maladies infectieuses aiguës Le programme M1 des macrophages est en règle générale associé à la protection au cours des maladies infectieuses aiguës (Figure 1). À titre d’exemple, Listeria monocytogenes, l’agent de la listériose, induit un programme M1 qui prévient l’échappement des bactéries dans le cytosol et stimule leur lyse intracellulaire aussi bien in vitro qu’in vivo. Les souris déficientes en gènes codant l’IFN-γ ou le TNF, deux marqueurs canoniques de la polarisation M1, ou leurs récepteurs respectifs meurent de leur infection [
9]. Les salmonelles induisent une réponse M1 des macrophages associée au contrôle de l’infection. Durant la phase précoce de l’infection par Mycobacterium tuberculosis, les macrophages acquièrent un profil M1, ce qui est conforme aux données cliniques concernant les patients présentant une tuberculose active. D’autres maladies à mycobactéries telles que la maladie de Buruli (M. ulcerans) [
34] et les infections opportunistes (M. avium) sont aussi caractérisées et contrôlées par les macrophages M1. La phase aiguë des infections chlamydiales est elle aussi caractérisée par un profil protecteur M1 [3]. Enfin, les monocytes pourraient également connaître une polarisation M1 au cours des infections bactériennes aiguës comme cela a pu être évoqué pour les infections virales.
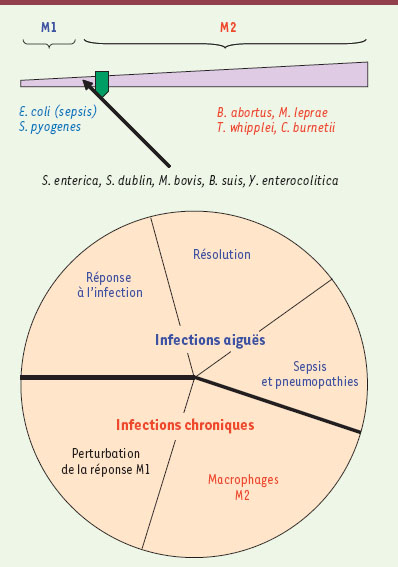
 | Figure 1.
Macrophages M1/M2 et infections bactériennes. La notion de macrophages M1/M2 recouvre un continuum d’états fonctionnels. Les macrophages quiescents ou répondant à un stimulus inflammatoire sont des macrophages légèrement M2. Ils servent de première ligne de défense contre les agents infectieux mais leur pouvoir microbicide est limité. Un double signal fourni par l’agent infectieux (tel que le LPS) et un élément de la réponse de l’hôte (tel que l’IFN-γ ou le TNF) est nécessaire à l’activation des macrophages en macrophages M1. Ces macrophages M1 dont le pouvoir lytique est élevé sont impliqués dans la réponse de l’hôte aux infections aiguës et la résolution de ces infections. Normalement, cet état M1 doit être transitoire, contrôlé par les cytokines de la réponse immunomodulatrice. Une polarisation M1 excessive conduit à des pathologies aiguës telles que le sepsis ou les pneumopathies dues à S. pyogenes (figurées en bleu). Pour qu’une infection devienne chronique, il faut que les agents pathogènes (S. enterica, S. dublin, M. bovis, B. suis, Y. enterocolitica) perturbent les effecteurs microbicides des macrophages M1 ou les voies métaboliques nécessaires à leur mise en place (en noir). Une seconde stratégie utilisée par les bactéries à développement intracellulaire (B. abortus, M. leprae, T. whipplei, C. burnetii) consiste à induire une polarisation M2 (en rouge) puisque le faible pouvoir microbicide des macrophages M2 en fait une niche protectrice pour les bactéries qui peuvent y survivre ou s’y répliquer. |
|
Polarisation M1 non contrôlée et pathogenèse infectieuse Si la polarisation M1 contrôle la phase aiguë de l’infection, elle peut être délétère si elle est excessive ou prolongée (Figure 1). Nous en donnons deux exemples. Escherichia coli provoque différentes infections aiguës, y compris le sepsis dont la réponse inflammatoire et immune exagérée conduit à des atteintes tissulaires importantes pouvant aller jusqu’à une défaillance multiviscérale et la mort du patient [
35]. La mortalité des patients avec sepsis sévère est corrélée avec la production en très large excès des cytokines de type 1 et des chimiokines par les phagocytes, ce qui conduit à l’activation de l’endothélium et contribue à la défaillance multiviscérale [
10]. Un modèle expérimental de péritonite induite chez le babouin confirme ces données puisque les babouins qui meurent de l’infection présentent un phénotype M1 alors que les babouins survivants présentent un phénotype mixte M1/M2 [3]. La réponse à l’infection par les streptocoques est généralement caractérisée par une réaction inflammatoire intense et une polarisation M1 des macrophages impliquant la voie TLR2 [
11]. Chez l’homme, S. pyogenes induit un profil M1 caractérisé par la surexpression des gènes codant plusieurs chimiokines [3]. Chez la souris, S. pyogenes stimule un programme inhabituel qui combine des caractéristiques M1 et M2 [
12] mais l’infection par S. pneumoniae qui conduit à une pneumonie mortelle est corrélée avec l’inflammation pulmonaire et la présence des macrophages M1 [
13]. |
Perturbation de la polarisation M1 par les bactéries pathogènes Afin que les bactéries intracellulaires puissent survivre dans les macrophages, elles se doivent de mettre en place des mécanismes inhibant l’activité microbicide de ces derniers. Une de leurs stratégies consiste à perturber la polarisation M1 (Figure 1). Différentes salmonelles [
36] ou mycobactéries neutralisent les effecteurs microbicides associés à la polarisation M1. C’est ainsi que Salmonella enterica sérotype typhimurium inhibe l’assemblage de la NADPH oxydase, un complexe enzymatique à l’origine des dérivés bactéricides de l’oxygène [
14]. De façon similaire, Mycobacterium bovis inhibe la formation de monoxyde d’azote (NO) et de ses dérivés bactéricides [
15]. Une autre stratégie mise en place par les bactéries pathogènes pour survivre dans les macrophages consiste à inhiber la production des cytokines de la réponse M1. C’est ainsi que Salmonella dublin inhibe la production de l’IL-18 et de l’IL-12p70 par les macrophages murins [
16] et que Brucella suis inhibe celle du TNF par les macrophages humains, ce qui conduit à une moindre production d’IL-12 [
17]. M. tuberculosis inhibe l’activation d’un facteur de transcription tel que NF-κB nécessaire à la mise en place d’une réponse inflammatoire [
18,
37] ou peut utiliser des stratégies indirectes : c’est ainsi que les macrophages sont incapables d’éliminer ces bactéries suite à l’inhibition de la transcription de gènes cibles de l’IFN-γ par un mécanisme impliquant l’IL-6 [
19], une cytokine classiquement associée à la polarisation M1 mais qui peut également la moduler via l’inhibition de gènes tels que celui qui code CXCL10 [
20]. La perturbation de la polarisation M1 des macrophages par les bactéries pathogènes peut aller jusqu’à une franche polarisation M2 avec toutes sortes d’états intermédiaires. Par exemple, Yersinia
enterocolitica stimule la polarisation M2 via des facteurs de virulence parfaitement identifiés puisque l’infection des macrophages par des bactéries déficientes pour ces facteurs conduit à une polarisation M1 [
21]. Coxiella burnetii est l’agent de la fièvre Q, une infection aiguë pouvant devenir chronique chez les patients immunodéprimés ou présentant une valvulopathie. Cette bactérie induit un programme M2 atypique puisque les macrophages, s’ils présentent bien diverses caractéristiques des macrophages M2, sécrètent néanmoins certaines cytokines associées à la polarisation M1 [
22]. On peut supposer que cette ambivalence M1/M2 contribue à l’évolution de la fièvre Q vers sa forme chronique. |
Polarisation M2 et maladies infectieuses chroniques L’évolution chronique des maladies infectieuses semble de plus en plus associée avec une reprogrammation des macrophages vers un profil M2 (Figure 1). La brucellose chronique est clairement associée à une polarisation M2 puisque la neutralisation de l’IL-10 et de l’IL-4 restaure un profil M1 et l’activité microbicide des macrophages [
23]. Les macrophages M2 sont également associés aux infections mycobactériennes chroniques : c’est ainsi que des macrophages M2 sont présents dans les lésions ulcéreuses précoces de la maladie de Buruli [
24, 34]. Dans les lésions lépromateuses, les macrophages produisent en excès de l’IL-10 [3] et LIR-7, un membre de la famille des leukocyte Ig-like receptors dont on a montré par ailleurs qu’il inhibe les réponses immunes innées en favorisant la production d’IL-10 par les monocytes et en déprimant leur potentiel microbicide [
25]. Il est cependant probable que la lèpre lépromateuse, considérée comme paradigmatique des réponses Th2, n’est pas associée à un pur profil M2 des macrophages puisque des marqueurs M1 avérés ou probables sont également exprimés dans les lésions lépromateuses [3]. Le rôle de la polarisation M2 des macrophages dans l’évolution chronique des maladies infectieuses semble mieux établi dans la maladie de Whipple et la fièvre Q. La maladie de Whipple, une maladie systémique rare et d’évolution chronique, est due à Tropheryma whipplei. Elle est associée à des infiltrats tissulaires de macrophages. Le comportement des monocytes et des macrophages à l’égard de T. whipplei est radicalement différent. Les monocytes, qui éliminent ces bactéries, présentent une polarisation M1 alors que les macrophages, qui autorisent la multiplication bactérienne, présentent un profil M2 [
26]. La comparaison par analyse transcriptionnelle à haut débit de ces cellules a permis d’identifier de nouveaux gènes candidats supports de la polarisation M1/M2, en particulier le gène codant l’IL-16. Une analyse fonctionnelle a pleinement confirmé le rôle joué par l’IL-16 dans la polarisation M2 des macrophages en réponse à T. whipplei. Cette polarisation M2 dans la maladie de Whipple a été confirmé sur la biopsie d’un patient puisque plusieurs marqueurs de cette polarisation sont fortement exprimés dans la lésion [
27]. L’évolution chronique de la fièvre Q implique, elle aussi, une polarisation M2 des macrophages. L’IL-10 est produite en excès par les monocytes de patients atteints d’une endocardite à C. burnetii, la forme majeure de la fièvre Q chronique et son taux est augmenté pendant la phase de chronicisation de la maladie [3]. Chez les souris qui surexpriment l’IL-10 dans le compartiment macrophagique, la charge bactérienne augmente dans les tissus avec une moindre quantité de granulomes. La réponse à C. burnetii des macrophages qui surexpriment l’IL-10 est clairement de type M2 [
28]. Ces résultats sont à rapprocher de ceux observés dans un autre modèle d’infection persistante à C. burnetii : les souris déficientes en vanine-1, une pantéthéinase ancrée dans la membrane qui contrôle l’inflammation tissulaire, présentent également un profil M2 de leurs macrophages [
29]. Nous avons montré récemment que l’ingestion de cellules apoptotiques par les monocytes et les macrophages est critique pour l’évolution chronique de la fièvre Q. En effet, l’ingestion de cellules apoptotiques par les monocytes et les macrophages conduit, après infection par C. burnetii, à un profil M2 et à une multiplication bactérienne. L’IFN-γ la prévient et reprogramme les monocytes et les macrophages vers un profil M1 [
30]. Comme ce sont les patients porteurs de valvulopathies et qui ont un taux important de leucocytes circulants apoptotiques qui présentent le risque le plus élevé de développer une endocardite à C. burnetii après avoir contracté une fièvre Q aiguë, il est probable que la polarisation M2 est associée avec l’évolution chronique de la fièvre Q en l’absence de médiateurs de type 1 de la réponse immune. |
Le concept de polarisation des macrophages recouvre un continuum d’états fonctionnels dont le caractère réversible souligne l’extrême plasticité de ces cellules engagées dans la réponse de l’organisme à l’agression microbienne. La signature M1 des macrophages est associée au contrôle des infections aiguës mais, exacerbée, elle peut être délétère. Différentes bactéries pathogènes préviennent la polarisation M1 ou promeuvent une polarisation M2 associée à la persistance bactérienne. Il apparaît maintenant que l’évolution chronique des maladies infectieuses est liée à une reprogrammation des macrophages vers des profils M2. L’étude de ces profils bénéficie des approches récentes de biologie systémique qui permettent de mettre en évidence différents types de signatures. Ce nouveau concept de polarisation fonctionnelle des macrophages pourrait être utile au diagnostic de certaines maladies infectieuses et, en particulier, à leur pronostic qui, en absence de critères objectifs, nécessite une couverture antibiotique systématique. Réorienter les réponses macrophagiques pourrait, en outre, constituer un nouvel angle d’attaque des maladies infectieuses
 . . |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Mantovani A, Sica A, Sozzani S, et al. The chemokine system in diverse forms of macrophage activation and polarization. Trends Immunol 2004; 25 : 677–86. 2. Gordon S. Alternative activation of macrophages. Nat Rev Immunol 2003; 3 : 23–35. 3. Benoît M, Desnues B, Mege JL. Macrophage polarization in bacterial infections. J Immunol 2008; 181 : 3733–9. 4. Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation Nat Rev Immunol 2008; 8 : 958–69. 5. Fernandez FO, Gordon S, Locati M, et al. Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization: new molecules and patterns of gene expression. J Immunol 2006; 177 : 7303–11. 6. Jenner RG, Young RA. Insights into host responses against pathogens from transcriptional profiling. Nat Rev Microbiol 2005; 3 : 281–94. 7. Boldrick JC, Alizadeh AA, Diehn M, et al. Stereotyped and specific gene expression programs in human innate immune responses to bacteria. Proc Natl Acad Sci USA 2002; 99 : 972–7. 8. Nau GJ, Richmond JF, Schlesinger A, et al. Human macrophage activation programs induced by bacterial pathogens. Proc Natl Acad Sci USA 2002; 99 : 1503–8. 9. Shaughnessy LM, Swanson JA. The role of the activated macrophage in clearing Listeria monocytogenes infection. Front Biosci 2007; 12 : 2683–92. 10. Bozza FA, Salluh JI, Japiassu AM, et al. 2007. Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis. Crit Care 2007; 11 : R49. 11. Kadioglu A, Andrew PW. The innate immune response to pneumococcal lung infection: the untold story. Trends Immunol 2004; 25 : 143–9. 12. Goldmann, O., von Kockritz-Blickwede M, Holtje C, et al. Transcriptome analysis of murine macrophages in response to infection with Streptococcus pyogenes reveals an unusual activation program. Infect Immun 2007; 75 : 4148–57. 13. Smith MW, Schmidt JE, Rehg JE, et al. Induction of pro- and anti-inflammatory molecules in a mouse model of pneumococcal pneumonia after influenza. Comp Med 2007; 57 : 82–9. 14. Vazquez-Torres A, Xu Y, Jones-Carson J, et al. Salmonella pathogenicity island 2-dependent evasion of the phagocyte NADPH oxidase. Science 2000; 287 : 1655–8. 15. Miller BH, Fratti RA, Poschet JF, et al. Mycobacteria inhibit nitric oxide synthase recruitment to phagosomes during macrophage infection. Infect Immun 2004; 72 : 2872–8. 16. Bost KL, Clements JD. Intracellular Salmonella dublin induces substantial secretion of the 40-kilodalton subunit of interleukin-12 (IL-12) but minimal secretion of IL-12 as a 70-kilodalton protein in murine macrophages. Infect Immun 1997; 65 : 3186–92. 17. Dornand J, Gross A, Lafont V, et al. The innate immune response against Brucella in humans. Vet Microbiol 2002; 90 : 383–94. 18. Pathak SK, Basu S, Basu KK, et al. Direct extracellular interaction between the early secreted antigen ESAT-6 of Mycobacterium tuberculosis and TLR2 inhibits TLR signaling in macrophages. Nat Immunol 2007; 8 : 610–8. 19. Ting LM, Kim AC, Cattamanchi A, et al. Mycobacterium tuberculosis inhibits IFN-g transcriptional responses without inhibiting activation of STAT1. J Immunol 1999; 163 : 3898–906. 20. Nagabhushanam V, Solache A, Ting LM, et al. Innate inhibition of adaptive immunity: Mycobacterium tuberculosis-induced IL-6 inhibits macrophage responses to IFN-g. J Immunol 2003; 171 : 4750–7. 21. Hoffmann R, van Erp K, Trulzsch K, et al. Transcriptional responses of murine macrophages to infection with Yersinia enterocolitica. Cell Microbiol 2004; 6 : 377–90. 22. Benoit M, Barbarat B, Bernard A, et al. Coxiella burnetii, the agent of Q fever, stimulates an atypical M2 activation program in human macrophages. Eur J Immunol 2008; 38 : 1065–70. 23. Fernandes DM, Jiang X, Jung JH, et al. Comparison of T cell cytokines in resistant and susceptible mice infected with virulent Brucella abortus strain 2308. FEMS Immunol Med Microbiol 1996; 16 : 193–203. 24. Kiszewski AE, Becerril E, Aguilar LD, et al. The local immune response in ulcerative lesions of Buruli disease. Clin Exp Immunol 2006; 143 : 445–51. 25. Bleharski JR, Li H, Meinken C, et al. Use of genetic profiling in leprosy to discriminate clinical forms of the disease. Science 2003; 301 : 1527–30. 26. Desnues B, Raoult D, Mege JL. IL-16 is critical for Tropheryma whipplei replication in Whipple’s disease. J Immunol 2005; 175 : 4575–82. 27. Desnues B, Lepidi H, Raoult D, et al. Whipple disease: intestinal infiltrating cells exhibit a transcriptional pattern of M2/alternatively activated macrophages. J Infect Dis 2005; : 1642–6. 28. Meghari S, Bechah Y, Capo C, et al. 2008. Persistent Coxiella burnetii infection in mice overexpressing IL-10: an efficient model for chronic Q fever pathogenesis. PLoS Pathog 2008; 4 : e23. 29. Meghari S, Berruyer C, Lepidi H, et al. Vanin-1 controls granuloma formation and macrophage polarization in Coxiella burnetii infection. Eur J Immunol 2007; 37 : 24–32. 30. Benoit M, Ghigo E, Capo C, et al. The uptake of apoptotic cells drives Coxiella burnetii replication and macrophage polarization: a model for Q fever endocarditis. PLoS Pathog 2008; 4 : e1000066. 31. Delneste Y, Beauvillain C, Jeannin P. Immunité naturelle. Structure et fonction des Toll-like receptors. Med Sci (Paris) 2007; 23 : 67–73. 32. Chazaud B, Chrétien F, Gherardi RK. Les macrophages régulent les différentes phases de la régénération musculaire. Med Sci (Paris) 2007; 23 : 794–7 33. Combadière B, Combadière C, Deterre P. Les chimiokines : un réseau sophistiqué de guidage cellulaire. Med Sci (Paris) 2007; 23 : 173–9. 34. Marsollier L, Aubry J, Milon G, Brodin P. Punaises aquatiques et transmission de Mycobacterium ulcerans. Med Sci (Paris) 2007; 23 : 572–5. 35. Aloulou M, Pinheiro da Silva F, Skurnik D, et al. Rôle néfaste du récepteur CD16 dans le sepsis. Med Sci 2008; 24 : 231–3. 36. Salez L, Malo D. Protagonistes de l’immunité innée dans les infections à salmonelles. Med Sci (Paris) 2004; 20 : 1119–24. 37. Pascussi JM, Vilarem MJ. Inflammation et métabolisme des médicaments. NF-kB et les xénorécepteurs CAR et PXR. Med Sci (Paris) 2008; 24 : 301–5. |


 .
.