| |
| Med Sci (Paris). 2010 January; 26(1): 31–33. Published online 2010 January 15. doi: 10.1051/medsci/201026131.Les microparticules endothéliales Un signal d’alarme pour le système immunitaire ? Fanny Angelot,* Estelle Seilles,* Philippe Saas,* and Francine Garnache-Ottou* Inserm UMR 645, Établissement français du sang, Bourgogne Franche-Comté, Université de Franche-Comté, 1, boulevard Alexander Fleming, BP1937, 25020 Besançon, France MeSH keywords: Animaux, Maladies auto-immunes, sang, immunologie, anatomopathologie, Microparticules membranaires, physiologie, Cytokines, sécrétion, Cellules dendritiques, Cellules endothéliales, Maladie du greffon contre l'hôte, Humains |
Les microparticules sont des fragments membranaires libérés par différents types cellulaires dans le compartiment vasculaire lors des processus d’activation ou d’apoptose. Les microparticules plaquettaires sont les plus abondantes dans la circulation sanguine. Cependant, des microparticules circulantes d’origine endothéliale, leucocytaire ou érythrocytaire sont aussi retrouvées. Les microparticules correspondent à des vésicules de taille comprise entre 0,1 et 1 µm. Elles expriment à leur surface les antigènes caractéristiques de la cellule dont elles sont issues, ainsi que la phosphatidylsérine. Longtemps considérées comme de simples débris cellulaires, elles exercent de véritables fonctions biologiques. En effet, de nombreux travaux ont montré que les microparticules sont porteuses d’une activité procoagulante par la présence à leur surface de phosphatidylsérine qui permet l’assemblage de complexes enzymatiques conduisant à la génération de thrombine [
1]. Par ailleurs, elles interviennent dans les interactions cellulaires et vont ainsi conférer de nouvelles propriétés à des cellules voisines [1,
2]. Certaines métalloprotéases matricielles identifiées au sein des microparticules issues de cellules endothéliales, tumorales ou plaquettaires sont de puissants stimulateurs de l’angiogenèse [
3]. Les microparticules présentent également des propriétés pro-inflammatoires : elles modifient l’expression membranaire des protéines d’adhérence augmentant ainsi le chimiotactisme des polynucléaires. |
Microparticules et conditions pathologiques De nombreuses pathologies sont associées à une détection accrue de microparticules circulantes [
4]. De façon générale, une élévation de microparticules circulantes est observée dans les situations prothrombotiques et inflammatoires, telles que les pathologies cardio-vasculaires incluant l’athérosclérose, les pathologies auto-immunes, mais aussi dans la maladie du greffon contre l’hôte après allogreffe de cellules hématopoïétiques, ou encore après transplantation rénale. Cependant, les techniques de quantification des microparticules circulantes ne sont pas encore standardisées et devront être optimisées afin de caractériser les différentes sous-populations de microparticules et mieux comprendre leur implication dans les processus pathologiques [
5]. |
Microparticules et cellules immunitaires Peu de travaux se sont intéressés à la capacité des microparticules à interagir avec les cellules du système immunitaire. Barbara Köppler et son équipe ont montré que les microparticules issues de cellules tumorales inhibent l’activation des lymphocytes B et induisent la synthèse d’interleukine 10 (IL-10) par les monocytes [
6]. Les cellules dendritiques jouent un rôle clé dans l’initiation des réponses immunitaires et les mécanismes concourant à l’activation de ces cellules sont de découverte récente [
7]. Les cellules dendritiques sont activées par les constituants des agents pathogènes, regroupés sous le terme de PAMP (pathogen-associated molecular pattern). Elles répondent aussi à des signaux endogènes libérés par notre organisme au cours de stress ou d’agression. Par analogie au PAMP, ces signaux ont été appelés DAMP (damage-associated molecular pattern) ou encore alarmines [
8]. Ces signaux « danger » sont reconnus par une famille de récepteurs, les PRR (pattern recognition receptors) exprimés par les différentes populations de cellules dendritiques. Ainsi, les cellules dendritiques plasmacytoïdes sécrètent de l’IFN(interféron)-α après stimulation de PRR endosomiques (TLR7/TLR9, Toll-like receptor) par les acides nucléiques viraux [
9]. L’implication des cellules dendritiques plasmacytoïdes commence à être suspectée dans la physiopathologie de maladies inflammatoires comme le psoriasis et le lupus systémique [
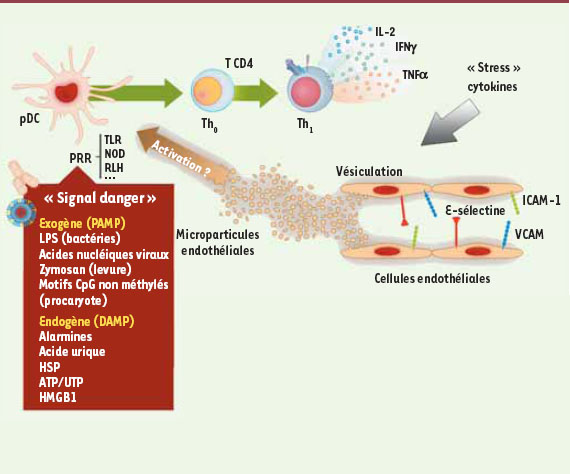
10], où l’on détecte un nombre élevé de microparticules endothéliales circulantes sont augmentées. Les microparticules endothéliales pourraient représenter une nouvelle alarmine à l’origine de l’activation inappropriée des cellules dendritiques plasmacytoïdes (Figure 1). Afin d’explorer cette hypothèse, nous avons montré la capacité des microparticules générées à partir de lignées cellulaires endothéliales à entraîner la maturation phénotypique des cellules dendritiques plasmacytoïdes [
11]. Ces cellules ainsi activées sécrètent des cytokines inflammatoires (IL-6 et IL-8) et induisent la prolifération des lymphocytes T CD4+ naïfs et leur polarisation vers un profil cytokinique de type Th1 (lymphocyte T auxiliaire) (Figure 1). Cet effet semble spécifique des microparticules endothéliales puisque des microparticules d’origine plaquettaire ou lymphocytaire n’ont pas ces capacités d’activation. Par ailleurs, les microparticules endothéliales n’activent pas les cellules dendritiques conventionnelles. Cette nouvelle voie d’activation des cellules dendritiques plasmacytoïdes pourrait être impliquée dans des situations inflammatoires associées à une production accrue de microparticules endothéliales.  | Figure 1.
Les microparticules endothéliales comme signaux de dangers endogènes à l’origine de l’activation des cellules dendritiques plasmacytoïdes. Dans des conditions d’inflammation ou de stress excessif, l’endothélium vasculaire libère de fortes quantités de microparticules endothéliales pouvant activer les cellules dendritiques plasmacytoïdes (pDC). Ces cellules, une fois activées, vont à leur tour stimuler les lymphocytes T CD4+ naïfs favorisant le développement d’une réponse inflammatoire (Th1 avec sécrétion d’IFN-γ et de TNF-α). Les microparticules endothéliales peuvent ainsi faire partie des signaux « danger » endogènes, appelés DAMP ou alarmines. Ces DAMP interagissent avec des récepteurs PRR, qui reconnaissent aussi les motifs moléculaires associés aux pathogènes (PAMP). Ces PRR comprennent entre autres les TLR, les récepteurs de la famille NOD ou encore les RLH. Quelques exemples de DAMP et de PAMP sont représentés. ATP : adénosine tri-phosphate ; CpG : cytosine-guanine dinucléotide ; HMGB1 : high mobility group box 1 ; HSP : heat shock protein ; LPS : lipopolysacharride ; pDC : cellule dendritique plasmacytoïde ; PRR : pattern recognition receptors ; RLH : retinoic-acid-inducible gene I-like helicases ; T : lymphocyte T ; TLR : Toll like receptor ; UTP : uridine tri-phosphate ; VCAM : vascular cell adhesion molecule ; ICAM : intercellular adhesion molecule. |
|
Contrôle de la libération de microparticules : une approche envisageable ? Les microparticules pourraient être la cible de stratégies pharmacologiques visant à moduler et contrôler leur libération afin de limiter l’activation inappropriée des cellules dendritiques plasmacytoïdes. Des équipes tentent actuellement de déterminer les processus intracellulaires à l’origine de la libération de microparticules [
12]. Le TNF-α (tumor necrosis factor), un puissant inducteur de la libération de microparticules endothéliales [1], pourrait être contrôlé par les biothérapies anti-TNF-α. La mise en place d’études de suivi biologique chez des patients traités par ces biothérapies devrait permettre d’évaluer l’impact de cette modulation sur les microparticules circulantes. En parallèle, une meilleure connaissance des mécanismes par lesquels les microparticules endothéliales interagissent avec les cellules dendritiques plasmacytoïdes est nécessaire avant d’envisager une modulation thérapeutique. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient Romain Bedel et Fabien Pelletier pour la Figure 1, et Claire Latruffe pour sa relecture.
|
1. Doeuvre L, Angles-Cano E. Des microparticules cellulaires dévoilent leur fonction fibrinolytique et protéolytique. Med Sci (Paris) 2009; 25 : 37–44. 2. Martinez MC, Larbret F, Zobairi F, et al. Transfer of differentiation signal by membrane microvesicles harboring hedgehog morphogens. Blood 2006; 108 : 3012–20. 3. Lacroix R, Sabatier F, Mialhe A, et al. Activation of plasminogen into plasmin at the surface of endothelial microparticles: a mechanism that modulates angiogenic properties of endothelial progenitor cells in vitro. Blood 2007; 110 : 2432–9. 4. Chironi GN, Boulanger CM, Simon A, et al. Endothelial microparticles in diseases. Cell Tissue Res 2009; 335 : 143–51. 5. Shet AS. Characterizing blood microparticles: technical aspects and challenges. Vasc Health Risk Manag 2008; 4 : 769–74. 6. Köppler B, Cohen C, Schlondorff D, et al. Differential mechanisms of microparticle transfer to B cells and monocytes: anti-inflammatory properties of microparticles. Eur J Immunol 2006; 36 : 648–60. 7. Maisnier-Patin K, Crabe S, Breton G, et al. Les cellules dendritiques transfectées avec de l’ARN messager : une approche prometteuse en immunothérapie. Med Sci (Paris) 2007; 23 : 279–84. 8. Kono H, Rock KL. How dying cells alert the immune system to danger. Nat Rev Immunol 2008; 8 : 279–89. 9. Gilliet M, Cao W, Liu YJ. Plasmacytoid dendritic cells: sensing nucleic acids in viral infection and autoimmune diseases. Nat Rev Immunol 2008; 8 : 594–606. 10. Banchereau J, Pascual V. Type I interferon in systemic lupus erythematosus and other autoimmune diseases. Immunity 2006; 25 : 383–92. 11. Angelot F, Seilles E, Biichle S, et al. Endothelial cell-derived microparticles induce plasmacytoid dendritic cell maturation: potential implications in inflammatory diseases. Haematologica 2009; 94 : 1502–12. 12. Simoncini S, Njock MS, Robert S, et al. TRAIL/Apo2L mediates the release of procoagulant endothelial microparticles induced by thrombin in vitro: a potential mechanism linking inflammation and coagulation. Circ Res 2009; 104 : 943–51. |