| |
| Med Sci (Paris). 2010 January; 26(1): 19–21. Published online 2010 January 15. doi: 10.1051/medsci/201026119.Maintien de la polarité épithéliale Identification de nouveaux protagonistes et d’une dynamique temporelle Patrick Laprise* Centre de recherche en cancérologie de l’Université Laval, CRCHUQ-Hôtel-Dieu, 9, rue McMahon, Québec (Québec) G1R 2J6, Canada MeSH keywords: Afrique, ethnologie, Afro-Américains, génétique, Population d'origine africaine, classification, Populations d'origine continentale, Groupes ethniques, Évolution moléculaire, Marqueurs génétiques, Variation génétique, Génétique médicale, Humains |
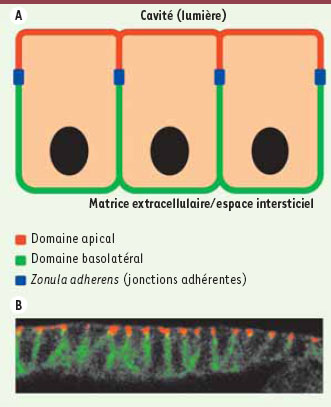
La sécrétion et le transport vectoriel effectués par les épithéliums simples sont essentiels à l’homéostasie humaine. L’absorption des nutriments par l’épithélium intestinal et la sécrétion de lait par les cellules épithéliales de la glande mammaire en sont de bons exemples. La polarité épithéliale des cellules qui assurent ces fonctions se traduit par la subdivision de la membrane plasmique en un domaine apical et un domaine basolatéral distribués de part et d’autre de complexes d’adhérence intercellulaires (Figure 1). Le domaine apical est en contact avec le monde extérieur soit directement, soit par l’intermédiaire d’une cavité (lumière) ; le domaine basolatéral est en contact avec les cellules voisines et la matrice extracellulaire. La machinerie protéique qui est à l’origine de l’architecture polarisée des cellules épithéliales est conservée au long de l’évolution, témoignant de son caractère indispensable à la physiologie des métazoaires [
1].
 | Figure 1.
Organisation structurale des cellules épithéliales au sein d’un épithélium simple. A. Représentation schématique d’un épithélium simple montrant que la membrane plasmique des cellules épithéliales est divisée en deux domaines distribués de chaque côté de la zonula adherens, le domaine apical et le domaine basolatéral. Ces derniers diffèrent dans leur composition et leurs fonctions. L’asymétrie ainsi engendrée, nommée polarité épithéliale, est cruciale pour les fonctions des épithéliums simples, par exemple le transport vectoriel. B. Immunofluorescence effectuée sur une coupe d’ectoderme embryonnaire chez la drosophile, un épithélium simple. Une protéine apicale (Crumbs ; rouge) et une protéine latérale (Fasciclin III ; vert) sont révélées pour mettre en évidence leur localisation dans des domaines membranaires distincts. |
|
Établissement de la polarité épithéliale : le rôle de la protéine Crumbs Il est donc essentiel de comprendre les mécanismes moléculaires orchestrant la polarité épithéliale, et assurant l’intégrité des épithéliums, cruciale pour la survie des métazoaires. Un acteur de ces mécanismes est la protéine transmembranaire Crumbs, qui agit en tant que déterminant du domaine apical lors de l’établissement de la polarité apicobasale [
2,
3] (Figure 1B). Au cours des stades précoces de développement chez la drosophile, Crumbs et d’autres protéines apicales établissent des interactions antagonistes avec les protéines du module Lethal giant larvae (Lgl) [
4,
5] qui assurent l’établissement du domaine latéral. Ainsi, la polarisation des cellules épithéliales résulte d’un équilibre dynamique concurrentiel entre des complexes protéiques apicaux et basolatéraux qui procurent une identité distincte et mutuellement exclusive à leurs domaines membranaires respectifs. Toutefois, les mécanismes régissant la polarité évoluent lors de la maturation des tissus épithéliaux. En effet, le rôle des protéines du groupe Lgl devient négligeable pour la polarité épithéliale vers le milieu du développement embryonnaire [5]. Ces observations indiquent que d’autres protéines se chargent de la stabilité du domaine latéral à ces stades de développement que caractérisent une morphogenèse épithéliale et une organogenèse très actives. Parallèlement, notre groupe a aussi montré que l’inactivation du gène encodant Yurt chez la drosophile altère l’intégrité du domaine basolatéral [
6], mais aucune relation fonctionnelle entre yurt et les gènes encodant les protéines du groupe Lgl n’a été détectée. De plus, les modules Lgl et Yurt contribuent à maintenir l’intégrité de la membrane latérale à des étapes différentes du développement. En effet, Yurt n’est pas requise pour l’établissement initial de la polarité épithéliale ou son maintien lors de la gastrulation. Yurt agit plutôt lors de l’organogenèse au moment où les protéines du module Lgl ne sont plus nécessaires à la stabilité du domaine basolatéral. Ceci indique que la protéine Yurt est la meilleure candidate pour remplacer fonctionnellement le module Lgl au cours des stades de développement suivant la gastrulation. |
Interactions protéiques coopératives dans l’établissement et le maintien de la polarité épithéliale Pour mieux définir les mécanismes permettant la conservation de la membrane latérale durant la maturation épithéliale, nous avons récemment procédé à des analyses d’interactions génétiques en inactivant, chez la drosophile, le gène yurt et plusieurs gènes encodant des protéines transmembranaires localisées dans le domaine basolatéral. De cette façon, nous avons établi l’existence d’une interaction génétique entre yurt et Atpα (codant la sous-unité alpha de la Na+, K+-ATPase) ainsi qu’entre yurt et Neurexin-IV [
7]. Nos expériences d’interactions génétiques et la caractérisation phénotypique des double mutants ont permis de mettre en lumière le rôle jusqu’alors insoupçonné de la Na+, K+-ATPase et de la Neurexine-IV dans la polarité épithéliale. Par la suite, l’analyse des interactions génétiques du gène yurt a été étendue à des gènes encodant des protéines adaptatrices associées à la membrane basolatérale, ce qui a permis de démontrer que l’inactivation simultanée des gènes yurt et coracle entraîne une organisation apicale de la membrane plasmique au détriment du domaine basolatéral lors de l’organogenèse [7]. Ce phénotype est significativement aggravé lorsque les deux gènes sont inactivés simultanément plutôt qu’un seul de ces gènes, soit yurt, soit coracle. En fait, l’absence complète de Coracle n’est pas suffisante pour altérer la polarité épithéliale. Ceci indique que Yurt et Coracle agissent de façon redondante dans l’organisation de la structure fonctionnelle des cellules épithéliales. Ainsi, nous avons établi que les protéines Yurt, Coracle, Neurexine-IV et Na+, K+-ATPase forment un groupe coopératif de protéines basolatérales (appelé groupe Coracle/Yurt) qui favorise la stabilité de la membrane latérale. Tout comme dans le cas des mutants yurt nuls, les double mutants yurt/Atpα, yurt/Neurexin-IV et yurt coracle ne montrent aucun défaut de la polarité épithéliale dans les stades précoces du développement. De plus, les protéines apicales et basolatérales de ces drosophiles mutantes sont à nouveau localisées de façon adéquate lors de la différenciation terminale des cellules épithéliales. Ceci indique que le groupe Coracle/Yurt agit dans une fenêtre temporelle limitée de l’embryogenèse pour maintenir la polarité épithéliale. Ces observations confirment le modèle selon lequel des groupes de protéines distincts et indépendants ont pour rôle de maintenir la polarité à divers stades de la morphogenèse et de la différenciation épithéliale. |
Une concurrence nécessaire L’apicalisation des cellules épithéliales observée chez les double mutants yurt/coracle est similaire au phénotype résultant d’une forte surexpression de Crumbs [3, 7]. Ceci permet d’émettre l’hypothèse selon laquelle le phénotype que crée l’absence simultanée de Yurt et Coracle résulte d’une suractivation de Crumbs. En accord avec cette prémisse, des mutations dans les gènes yurt et coracle atténuent de façon importante le phénotype des mutants crumbs chez lesquels on observe une importante perte d’intégrité des épithéliums dérivés de l’ectoderme. Des mutations dans les gènes Atpα et Neurexin-IV produisent le même effet. L’atténuation du phénotype crumbs est encore plus importante dans les triple mutants coracle/yurt/crumbs. De plus, l’apicalisation normalement observée lors de l’absence simultanée de Yurt et Coracle est supprimée lorsque le gène crumbs est inactivé. Ces résultats confirment que Yurt et Coracle ont des fonctions parallèles et établissent que la concurrence entre le groupe Coracle/Yurt et Crumbs permet d’organiser les domaines membranaires des cellules épithéliales [7]. |
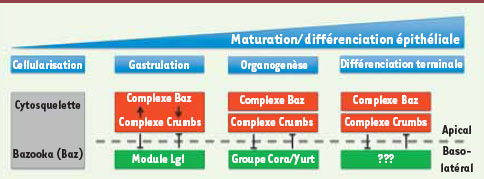
Les données tirées des publications récentes convergent pour établir qu’une dynamique temporelle existe dans les mécanismes qui régissent la polarité épithéliale au cours de la maturation épithéliale chez la drosophile (Figure 2). Ces observations sont importantes puisque la perte de polarité épithéliale chez la drosophile et chez la souris est suffisante pour déclencher la formation de tumeurs [
8,
9]. Il a également été démontré que l’expression de plusieurs protéines qui concourent au maintien du phénotype polarisé des cellules épithéliales est diminuée dans divers types de tumeurs chez l’Homme [
10]. Ces observations ont suscité l’intérêt de nombreux chercheurs qui s’affairent depuis lors à mieux comprendre les mécanismes moléculaires orchestrant la polarité épithéliale.  | Figure 2.
Modèle montrant l’interaction fonctionnelle entre les régulateurs de la polarité épithéliale durant l’embryogenèse chez la drosophile. Au cours de la cellularisation, les premiers signaux de polarisation sont donnés par les jonctions adhérentes, le cytosquelette et la protéine Bazooka. Lors de l’établissement des premiers épithéliums polarisés et de la gastrulation, les complexes apicaux Crumbs et Bazooka établissent des interactions fonctionnelles antagonistes avec les protéines latérales du module Lgl bien qu’elles entretiennent entre elles un certain degré de coopération. Ces interactions permettent la mise en place et la ségrégation du domaine apical et du domaine basolatéral. Par la suite, lors de l’organogenèse, le maintien du domaine basolatéral est assuré par le groupe Coracle/Yurt qui limite l’activité du déterminant apical Crumbs. Lors de la différenciation terminale des cellules épithéliales, la stabilité du domaine basolatéral exige la mise en jeu de protéines encore à découvrir. |
|
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Tepass U, Tanentzapf G, Ward R, Fehon R. Epithelial cell polarity and cell junctions in Drosophila. Annu Rev Genet 2001; 35 : 747–84. 2. Tepass U, Theres C, Knust E. Crumbs encodes an EGF-like protein expressed on apical membranes of Drosophila epithelial cells and required for organization of epithelia. Cell 1990; 61 : 787–99. 3. Wodarz A, Hinz U, Engelbert M, Knust E. Expression of crumbs confers apical character on plasma membrane domains of ectodermal epithelia of Drosophila. Cell 1995; 82 : 67–76. 4. Bilder D, Schober M, Perrimon N. Integrated activity of PDZ protein complexes regulates epithelial polarity. Nat Cell Biol 2003; 5 : 53–8. 5. Tanentzapf G, Tepass U. Interactions between the crumbs, lethal giant larvae and bazooka pathways in epithelial polarization. Nat Cell Biol 2003; 5 : 46–52. 6. Laprise P, Beronja S, Silva-Gagliardi NF, et al. The FERM protein Yurt is a negative regulatory component of the Crumbs complex that controls epithelial polarity and apical membrane size. Dev Cell 2006; 11 : 363–74. 7. Laprise P, Lau KM, Harris KP, et al. Yurt, Coracle, Neurexin IV and the Na(+),K(+)-ATPase form a novel group of epithelial polarity proteins. Nature 2009; 459 : 1141–5. 8. Bilder D. Epithelial polarity and proliferation control: links from the Drosophila neoplastic tumor suppressors. Genes Dev 2004; 18 : 1909–25. 9. Zhan L, Rosenberg A, Bergami KC, et al. Deregulation of scribble promotes mammary tumorigenesis and reveals a role for cell polarity in carcinoma. Cell 2008; 135 : 865–78. 10. Dow LE, Humbert PO. Polarity regulators and the control of epithelial architecture, cell migration, and tumorigenesis. Int Rev Cytol 2007; 262 : 253–302. |