| |
| Med Sci (Paris). 2010 January; 26(1): 15–17. Published online 2010 January 15. doi: 10.1051/medsci/201026115.La ruse du méningocoque Mathieu Coureuil1* and Xavier Nassif1,2 1Université Paris Descartes, faculté de médecine, Inserm U570, Paris, France 2AP-HP, Hôpital Necker-Enfants malades, Paris, F-75015, France MeSH keywords: Jonctions adhérentes, métabolisme, microbiologie, ultrastructure, Adhérence bactérienne, Barrière hémato-encéphalique, Molécules d'adhérence cellulaire, Activation enzymatique, Fimbriae bactériens, physiologie, Interactions hôte-pathogène, Humains, Méningite à méningocoques, épidémiologie |
Parmi les hôtes invisibles du corps humain vivent certains des plus terrifiants pathogènes. S’il faut prendre garde à ses ennemis, il faut aussi se méfier de ses amis. Ainsi, Neisseria meningitidis, une bactérie commensale qui a élu domicile sur la muqueuse nasopharyngée peut s’avérer être un pathogène mortel. N. meningitidis est portée de façon asymptomatique par 3 à 10 % de la population [
1] et se transmet d’une personne à une autre par contact direct ou par voie aérienne (gouttelette). Par un mécanisme encore mal connu cette bactérie peut passer dans la circulation sanguine puis franchir la barrière hématoencéphalique (BHE), proliférer dans le liquide céphalorachidien et causer une méningite cérébrospinale. Sa prévalence est de 1 à 25/100 000 habitants selon les pays. |
Le système immunitaire ne l’avait pas vu venir Par quel moyen le système immunitaire fait-il le tri entre le commensal inoffensif et le pathogène ? Le système immunitaire reconnaît des groupes de signaux et y répond spécifiquement [
2]. Schématiquement, un pathogène va détourner la machinerie cellulaire à son avantage. Il va utiliser des stratégies définies pour infecter la cellule, s’y répliquer puis se propager. Ces stratégies sont détectées par la cellule hôte et aboutissent à un seul signal cellulaire « intégré ». Ce signal est reconnu par le système immunitaire qui apporte alors une réponse spécifique et opportune. Or le méningocoque a développé plusieurs stratégies pour berner le système immunitaire et se faire passer pour un authentique commensal. Ainsi, il peut prospérer au niveau de sa niche écologique. Premier atout, le méningocoque ne pénètre et ne prolifère que peu efficacement à l’intérieur des cellules. Il ne possède pas non plus de système de sécrétion de type III ou IV comme Shigella ou Helicobacter pylori, il n’est donc pas capable d’injecter des protéines à travers la membrane plasmique de l’hôte [
3,
10]. Ainsi N. meningitidis n’active pas les voies de détection intracellulaires. Second atout, N. meningitidis est très bien équipé pour se multiplier dans le milieu extracellulaire. Comme tous les pathogènes dont la multiplication est extracellulaire, il possède des systèmes de captation du fer et peut notamment se procurer le fer séquestré par des protéines de l’hôte comme la lactoferrine [
11]. Sa capsule polysaccharidique et sa protéine de liaison au facteur H lui permettent de se protéger contre l’action bactéricide du complément. D’autre part, la nature du polysaccharide des principaux sérogroupes capsulaires est identique à certains motifs de glycosylation des protéines de l’hôte. Cette bactérie possède aussi un génome extrêmement dynamique qui lui permet de présenter des antigènes très variables. Toutes ces caractéristiques font que N. meningitidis est à la fois peu visible par la réponse innée intracellulaire et peut mettre en échec la réponse immunitaire adaptative spécifique. Si l’on y associe un extraordinaire tropisme pour la BHE, tous les éléments sont réunis pour créer un grave problème de santé publique. |
Le casse du siècle n’était pas prévu Des travaux antérieurs ont montré que l’adhérence des bactéries aux microvaisseaux cérébraux humains est quelque peu fortuite. N. meningitidis n’adhère aux cellules endothéliales que dans des conditions de flux très faible, qui prévalent au niveau des microvaisseaux cérébraux [
4]. Si on y regarde de plus près, ces conditions d’adhérence sont assez proches des conditions que doit rencontrer N. meningitidis au niveau de la muqueuse nasopharyngée. On pourrait même dire que N. meningitidis adhère aux cellules de la BHE par défaut. Cette idée prend tout son sens si l’on se souvient que la méningite cérébrospinale ne participe pas à la dissémination de N. meningitidis mais cause la mort de l’hôte et de la bactérie. Un authentique « cul-de-sac évolutif » ! Mais sans arme de destruction cellulaire massive et avec pour seul atout de savoir passer inaperçu, comment cette bactérie va-t-elle franchir la BHE ? Et pourquoi ne pas se faire passer pour une autre cellule ? |
Comment franchir une barrière sans affecter l’intégrité cellulaire ?
N. meningitidis a trouvé, sûrement par hasard, un moyen d’ouvrir cette barrière si étanche qu’est la BHE. Nous savions déjà qu’elle induit la formation de microvillosités à la surface de la cellule hôte, là où la colonie de bactéries se développe. Ces microvillosités sont enrichies en protéines du cytosquelette ainsi qu’en récepteurs membranaires [
5]. Nous avons observé que ces microvillosités sont aussi enrichies en protéines des jonctions adhérentes et serrées comme la VE (vascular endothelium)-cadhérine, la p120-caténine, ZO (zona occludens)-1 et 2 ou la claudine-5 [
6,
12]. Ces protéines sont essentielles à l’étanchéité de l’endothélium cérébral. Nous avons donc fait l’hypothèse que la délocalisation des protéines de jonction pourrait rendre la BHE plus perméable (Figure 1). En effet, grâce à un modèle in vitro de cellules endothéliales de microvaisseaux cérébraux humain [
7], nous avons observé que N. meningitidis est capable d’ouvrir l’espace intercellulaire dès quatre heures après l’infection. En observant les similitudes entre les microvillosités induites par N. meningitidis et les jonctions cellulaires naissantes nous avons suggéré que N. meningitidis induit la formation de nouvelles jonctions au niveau de son site d’adhésion. En somme, tout se passe comme si la colonie bactérienne se faisait passer pour une autre cellule endothéliale.
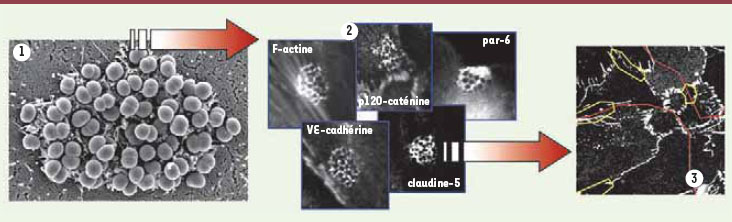
 | Figure 1.
N. meningitidis franchit la BHE en ouvrant les jonctions intercellulaires.
N. meningitidis croît sous la forme d’une colonie à la surface des cellules endothéliales (1).
N. meningitidis recrute sous la colonie des protéines du cytosquelette, des récepteurs membranaires ainsi que le complexe de polarité Par3/Par6/PKCζ et les protéines des jonctions adhérentes et serrées (VE-cadhérine, p120-caténine et claudine-5) (2). La délocalisation des protéines de jonction aboutit à l’appauvrissement des jonctions existantes puis à l’ouverture localisée des jonctions intercellulaires (les espaces intercellulaires sont entourés en jaune, les zones rouges indiquent la présence d’une colonie bactérienne) (3). (1) Photo acquise par microscopie électronique à balayage d’une colonie de N. meningitidis adhérant à une cellule endothéliale (cellules de la veine du cordon ombilical). (2) Immunomarquage observé par microscopie confocale. (3) Immunomarquage basolatéral de la VE-cadhérine dans les cellules hCMEC/D3 infectées pendant quatre heures avec N. meningitidis. |
Mais comment est-ce qu’une bactérie extracellulaire pourrait créer un nouveau domaine jonctionnel ? Nous avons regardé de plus près les bases moléculaires de la formation des jonctions cellulaires, et notamment le complexe de polarité Par3/Par6/PKCζ et la GTPase Cdc42. Cette dernière est connue pour être impliquée dans l’activation de ce complexe [
8], mais elle est aussi activée par N. meningitidis au niveau des microvillosités observées sous la colonie [
9]. Nous avons montré que, en réponse à l’adhérence de la bactérie, les pili de type IV1 sont impliqués dans l’activation de la GTPase Cdc42 et permettent le recrutement du complexe de polarité. Ce dernier événement entraîne la relocalisation des protéines nécessaires à la formation d’une nouvelle jonction, dont les protéines de jonctions adhérentes et serrées (Figure 1). De plus, nous avons montré que l’inhibition d’un des membres de ce complexe inhibe le recrutement des protéines de jonction sous la colonie bactérienne. Alors que ce signal d’activation du complexe de polarité est transitoire en conditions normales, le méningocoque l’active de façon continue. Plus la colonie grossit et plus le recrutement de protéines de jonction devient important, au point de déstabiliser les jonctions existantes. Nous avons même pu observer que la VE-cadhérine est délocalisée des jonctions intercellulaires existantes jusqu’à un site sous la colonie bactérienne. La découverte de ce mécanisme original permet de mieux appréhender les bases moléculaires du franchissement de la BHE. Toutefois, nous ne savons toujours pas par quel mécanisme la GTPase Cdc42 est recrutée et activée sous la colonie. Au-delà de son utilité dans le décryptage du tropisme méningé du méningocoque, comprendre comment ouvrir la BHE de façon ciblée apporterait des informations capitales permettant le ciblage de molécules pharmaceutiques dans certaines maladies neurodégénératives. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Van Deuren M, Brandtzaeg P, van der Meer JW. Update on meningococcal disease with emphasis on pathogenesis and clinical management. Clin Microbiol Rev 2000; 13 : 144–66. 2. Vance RE, Isberg RR, Portnoy DA. Patterns of pathogenesis: discrimination of pathogenic and nonpathogenic microbes by the innate immune system. Cell Host Microbe 2009; 6 : 10–21. 3. Lo H, Tang CM, Exley RM. Mechanisms of avoidance of host immunity by Neisseria meningitidis and its effect on vaccine development. Lancet Infect Dis 2009; 9 : 418–27. 4. Mairey E, Genovesio A, Donnadieu E, et al. Cerebral microcirculation shear stress levels determine Neisseria meningitidis attachment sites along the blood-brain barrier. J Exp Med 2006; 203 : 1939–50. 5. Doulet N, Donnadieu E, Laran-Chich MP, et al. Neisseria meningitidis infection of human endothelial cells interferes with leukocyte transmigration by preventing the formation of endothelial docking structures. J Cell Biol 2006; 173 : 627–37. 6. Coureuil M, Mikaty G, Miller F, et al. Meningococcal Type IV Pili Recruit the Polarity Complex to Cross the Brain Endothelium. Science 2009; 325 : 83–7. 7. Weksler BB, Subileau EA, Perriere N, et al. Blood-brain barrier-specific properties of a human adult brain endothelial cell line. Faseb J 2005; 19 : 1872–4. 8. Joberty G, Petersen C, Gao L, Macara IG. The cell-polarity protein Par6 links Par3 and atypical protein kinase C to Cdc42. Nat Cell Biol 2000; 2 : 531–9. 9. Eugene E, Hoffmann I, Pujol C, et al. Microvilli-like structures are associated with the internalization of virulent capsulated Neisseria meningitidis into vascular endothelial cells. J Cell Sci 2002; 115 : 1231–41. 10. Biais N. Together, pili from Neisseria gonorrhoeae exert strong forces. Med Sci (Paris) 2009; 25 : 437–8. 11. Pierce A, Legrand D, Mazurier J. Lactoferrin: a multifunctional protein. Med Sci (Paris) 2009; 25 : 361–9. 12. Zahraoui A. Tight junctions, a platform regulating cell proliferation and polarity. Med Sci (Paris) 2004; 20 : 580–5. |