Rythmes biologiques
La rétine met les pendules à l’heure
En dehors de son rôle dans la vision, la rétine participe aux rythmes biologiques. Mais dans quel recoin secret cette membrane souple cache-t-elle son horloge ? Éléments de réponse avec Ouria Dkhissi-BenyahyaOuria Dkhissi-Benyahya
Unité 846 Inserm/Inra - Université Claude-Bernard Lyon 1, neurobiologiste à l’Institut Cellules souches et cerveau de Bron.
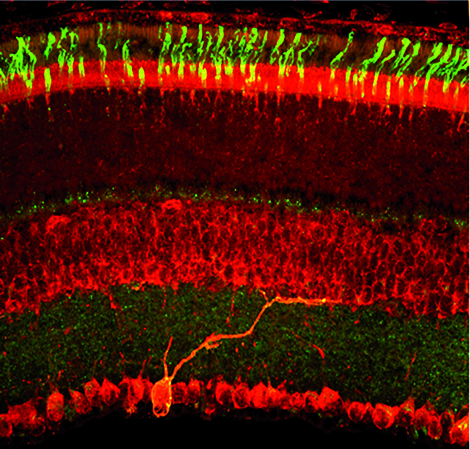
© Ouria Dkhissi-Benyahya/Unité 846 Inserm/Inserm

© infographie Sandrine Marchand
À l’instar de la Suisse et la Savoie qui se disputent leur renommée en horlogerie, le système nerveux central et la rétine partagent une activité commune : être le siège d’une horloge biologique. L’alternance des périodes veille/sommeil sur un cycle proche de 24 heures est l’une des preuves de l’existence de rythmes circadiens régis par l’horloge biologique centrale, localisée dans l’hypothalamus. Les effets du décalage horaire, et surtout leur disparition au bout de quelques jours, prouvent aussi qu’il est possible de remettre à l’heure cette horloge centrale quand elle n’est plus en phase avec l’astre solaire. C’est là qu’interviennent la rétine et son horloge circadienne. Mais où exactement l’abrite-t-elle ? « La rétine est formée de couches superposées, composées de différents types de neurones, souligne Ouria Dkhissi-Benyahya, chercheuse dans l’équipe Neurobiologie des rythmes circadiens et du sommeil.Il est donc difficile de la localiser.
»Pour y parvenir, la neurobiologiste et ses collègues ont soumis des souris à des phases de lumière et d’obscurité de même durée, en alternance, pendant deux semaines, puis les ont maintenues dans le noir. Les scientifiques ont ensuite isolé les régions externes de leur rétine, composées des photorécepteurs impliqués dans la vision, des régions internes, où sont réunies les couches nucléaires internes et celles des cellules ganglionnaires (voir schéma). L’équipe a alors analysé l’expression des gènes, tels queClocketPeriod, impliqués dans le contrôle de l’horloge. « Chez la souris sauvage, tous ces gènes sont exprimés suivant un certain rythme dans les photorécepteurs, mais pas dans la région interne de la rétine », explique Ouria Dkhissi-Benyahya.
La solution de l’énigme va venir des souris dépourvues de mélanopsine - un photopigment - qui faisaient aussi partie de l’expérience. Pourquoi ? Parce que découvert en 1998, il semble être celui par lequel la lumière agit sur les rythmes circadiens. Localisé dans les cellules ganglionnaires, il appartient donc à la région interne de la rétine. « Or, nous avons montré que son absence altère l’expression des gènes d’horloge au niveau des photorécepteurs. On savait déjà que la mélanopsine agissait sur les noyaux suprachiasmatiques, deux petits groupes de neurones de l’hypothalamus, siège de l’horloge centrale, on sait désormais qu’elle est aussi capable de réguler la rétine externe, de façon rétrograde par rapport au sens de circulation de l’information entre neurones. » La suite des expériences a montré que cela passait par la modulation de l’expression du neurotransmetteurNeurotransmetteur
Molécule libérée par un neurone au niveau d’une synapse pour transmettre une information à un autre neurone dopamine.
Molécule libérée par un neurone au niveau d’une synapse pour transmettre une information à un autre neurone dopamine.
Pour Ouria Dkhissi-Benyahya, ces découvertes fondamentales ont également un intérêt en pratique clinique. « Dans les
maladies affectant l’œil, comme
le glaucome ou la rétinopathie diabétiqueRétinopathie diabétique
Atteinte rétinienne survenant lors d’un diabète, on ne se préoccupe généralement que de l’altération de la vision. Or, si les cellules ganglionnaires à mélanopsine sont touchées, les horloges rétinienne et centrale peuvent être affectées et entraîner des troubles du sommeil par exemple. » À l’aide d’un modèle animal de la rétinopathie diabétique, la chercheuse et ses collaborateurs étudient donc l’évolution des cellules ganglionnaires à mélanopsine et l’impact de leur dégénérescence sur les rythmes biologiques. Les travaux sont en cours.
Atteinte rétinienne survenant lors d’un diabète, on ne se préoccupe généralement que de l’altération de la vision. Or, si les cellules ganglionnaires à mélanopsine sont touchées, les horloges rétinienne et centrale peuvent être affectées et entraîner des troubles du sommeil par exemple. » À l’aide d’un modèle animal de la rétinopathie diabétique, la chercheuse et ses collaborateurs étudient donc l’évolution des cellules ganglionnaires à mélanopsine et l’impact de leur dégénérescence sur les rythmes biologiques. Les travaux sont en cours.
Julie Coquart
