| |
| Med Sci (Paris). 2009 August; 25(8-9): 727–732. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9727.Épidémiologie des accidents vasculaires cérébraux Yannick Béjot,1* Emmanuel Touzé,2 Agnès Jacquin,1 Maurice Giroud,1 and Jean-Louis Mas2 1Service de neurologie, CHU de Dijon et Registre dijonnais des AVC, EA 4184, Faculté de médecine, Université de Dijon, Hôpital général, 3, rue du Faubourg Raines, 21000 Dijon, France 2Service de neurologie, CH Sainte-Anne, UMR 894, Université Paris Descartes, Paris, France |
Les AVC sont définis par l’Organisation mondiale de la santé (OMS) comme « le développement rapide de signes cliniques localisés ou globaux de dysfonction cérébrale avec des symptômes durant plus de vingt-quatre heures pouvant entraîner la mort, sans autre cause apparente qu’une origine vasculaire ». Ce terme désigne en fait des affections très hétérogènes : les infarctus cérébraux (IC), représentant 80 à 90 % des AVC, les hémorragies intracérébrales (HIC) dans 10 à 20 % des cas, et les hémorragies méningées qui comptent pour moins de 2 % des AVC et qui ne seront pas abordées dans cet article. Bien que les IC et les HIC partagent certains facteurs de risque, leurs causes sont très différentes (Tableau I).  | Tableau I.
Principales causes des infarctus cérébraux et des hémorragies intracérébrales.
|
|
Incidence en France La mesure de l’incidence annuelle des AVC, définie comme le nombre de nouveaux cas survenant au cours d’une année, est difficile à l’échelon national car elle implique un recueil exhaustif des cas [
1]. En France, le seul registre de population disponible est celui de Dijon (150 000 habitants), qui étudie depuis 1985 l’épidémiologie des AVC. L’incidence sur la période 2000-2006 était de 113/100 000 habitants/an [
2]. Sur l’ensemble du territoire, elle serait d’environ 130 000 nouveaux cas par an, soit environ 360 personnes par jour victimes d’un AVC [
3]. Incidence mondiale À travers le monde, ce sont 16 millions de nouveaux cas qui sont observés chaque année, responsables de 5,7 millions de décès [
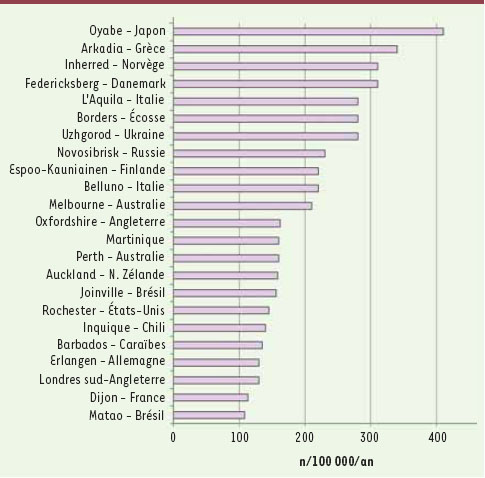
4]. Des disparités d’incidence annuelle des AVC ont été mises en évidence, celle-ci variant de 113 à 410 cas/100 000 personnes/an (Figure 1). Il existe un gradient décroissant nord-sud et est-ouest qui implique probablement à la fois des facteurs génétiques et environnementaux qui sont mal identifiés [ 1]. Des incidences élevées ont également été constatées dans les pays nordiques (Danemark, Norvège). Aucune donnée d’incidence provenant de registres de population n’est disponible pour les pays d’Afrique sub-saharienne. Néanmoins, les études épidémiologiques hospitalières font état d’une incidence globale plus faible que celle qui est observée dans les pays développés, sauf chez les sujets jeunes, et le développement économique de ces régions pourrait conduire à une forte augmentation de cette dernière dans les années à venir [
5].  | Figure 1.
Disparités internationales d’incidence annuelle des AVC. Données recueillies à partir de registres de populations de 1985 à 2006 [ 1]. |
Évolution temporelle récente de l’incidence Seules six études ont analysé l’évolution de l’incidence entre la fin du XX e siècle et le début du XXI e siècle [ 2]. Ainsi, l’incidence est restée stable à Dijon et Lund-Orup (Suède), alors qu’elle a diminué à Oxford (Angleterre), Tartu (Estonie), Auckland et Perth (Australie). Néanmoins, à partir des données de l’OMS disponibles, il a été estimé que le nombre annuel d’AVC incidents dans le monde passera de 16 millions en 2005 à 23 millions à l’horizon de 2030, du fait du vieillissement de la population [ 4]. Enfin, en 2005, le nombre de patients survivantà un AVC était de 62 millions. Il atteindra 77 millions dans 20 ans. |
Taux de récidive Peu d’études de population se sont intéressées aux taux de récidive des AVC. Ceux-ci varient de 6 % à 12 % par an dans notre expérience [ 1]. Concernant les infarctus cérébraux, le risque était différent en fonction du mécanisme considéré. Ainsi, des taux de récidive plus élevés ont été constatés en cas d’infarctus d’origine cardio-embolique comparés aux autres mécanismes d’AVC [
6]. Taux de mortalité La plupart des études ont rapporté les taux de mortalité à un mois après un AVC. Les disparités sont importantes à travers le monde avec des chiffres variant de 10 à 30 % [ 1]. De plus, les taux publiés variaient en fonction du type d’AVC considéré. Dans la grande majorité des études, la mortalité précoce était plus élevée en cas d’hémorragie cérébrale (25 à 50 %) et d’hémorragie méningée (20 à 50 %), par rapport aux infarctus cérébraux (10 à 25 %). Parmi ces derniers, des variations concernant la survie à court et long terme ont été aussi observées selon le mécanisme étiologique. Ainsi, la survie à deux ans était moins bonne en cas d’infarctus d’origine cardio-embolique, contrastant avec une meilleure survie observée en cas d’infarctus lacunaire [ 6]. À 5 ans, le taux de mortalité a été évalué à 55 % environ [ 1]. Alors que la mortalité précoce est généralement directement imputée à l’AVC et est influencée par la prise en charge à la phase aiguë, la mortalité à plus long terme implique certainement d’autres mécanismes dont le risque de pathologie coronarienne qui augmente de façon continue dans les années suivant un AVC [
7]. Sur le plan de l’évolution temporelle, une baisse de 25 % de la mortalité à un mois des AVC a été constatée au cours de ces vingt dernières années à Dijon, témoignant probablement de l’amélioration de la prise en charge en phase aiguë préhospitalière et hospitalière, mais aussi d’un meilleur état de santé global de la population ; ce dernier paramètre explique la probabilité accrue de survie après un AVC et possiblement la sévérité moindre des AVC [
8]. Des résultats similaires ont été observés dans d’autres pays occidentaux [1]. |
Facteurs de risque des AVC Les facteurs de risque des IC diffèrent de ceux des HIC bien que certains d’entre eux soient communs aux deux types d’AVC. Il est classique de séparer les facteurs de risque en facteurs modifiables et non modifiables, même si cette séparation est quelque peu subjective [
9]. Facteurs de risque non modifiables Les facteurs de risque non modifiables sont généralement communs aux IC et HIC. L’âge est le plus puissant : ainsi, après 55 ans, le risque d’AVC double à chaque décennie [
10]. Le sexe masculin n’apparaît pas comme un facteur majeur dans la survenue d’un AVC contrairement à la pathologie coronarienne mais les données sont divergentes. L’incidence des AVC est toutefois plus élevée chez l’homme que chez la femme. Néanmoins, du fait de l’espérance de vie supérieure chez les femmes, le nombre absolu d’AVC est plus important chez les femmes que chez les hommes. Des facteurs ethniques ont également été identifiés. Ainsi, le registre de Manhattan a montré une incidence deux fois plus élevée des IC et des HIC chez les individus d’origine africaine et hispanique que chez les caucasiens [
11]. De plus, l’incidence des HIC est plus élevée au sein des populations asiatiques [1]. Des facteurs socio-économiques et culturels pourraient être à l’origine de différences dans la prévalence des facteurs de risque observées au sein de ces populations, ainsi que des variations génétiques qu’il reste à identifier. Un antécédent familial paternel ou maternel d’AVC multiplie par deux le risque. En dehors des rares maladies monogéniques, il pourrait exister des interactions complexes avec le sexe, non expliquées par une transmission génétique classique. Ainsi, les femmes ayant un IC ou un accident ischémique transitoire (AIT) avaient plus souvent un antécédent maternel que paternel d’AVC, alors que chez les hommes, les antécédents maternels et paternels avaient la même prévalence [
12]. Facteurs de risque modifiables Infarctus cérébraux
-
Hypertension artérielle et facteurs métaboliques
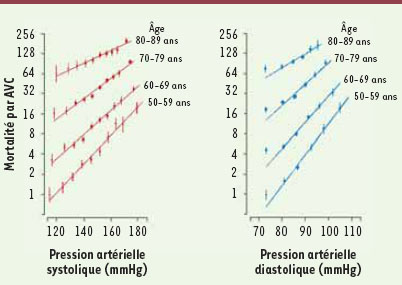
L’hypertension artérielle (HTA) représente le facteur de risque le plus fréquemment retrouvé chez les patients victimes d’un IC. La relation entre pression artérielle et risque d’AVC existe dès les valeurs de pression artérielle de 115/75 mmHg (systolique/diastolique), et elle est loglinéaire. En effet, chaque augmentation de la pression artérielle systolique de 20 mmHg ou de la pression artérielle diastolique de 10 mmHg est associée à un doublement du risque d’AVC, quel que soit l’âge [
13] (Figure 2). Concernant les IC, l’HTA multiplie le risque par quatre, dans les deux sexes et quel que soit l’âge [
14]. La relation forte existant entre l’âge et la fréquence de l’HTA explique en partie l’incidence élevée des IC chez les sujets les plus âgés. Le risque d’IC attribuable à l’HTA apparaît ainsi élevé (voir Encadré).  | Figure 2.
Mortalité (en échelle logarithmique) par AVC dans chaque décennie d’âge en fonction de la pression artérielle systolique ou diastolique (d’après [ 11]). |
Le diabète de type 2 est un facteur de risque bien établi d’IC qui multiplie le risque par un facteur allant de 1,8 à 6 [
15]. Le risque d’IC chez le diabétique est ainsi de 1,5 % par an. Par ailleurs, l’étude ARIC (étude américine, atherosclerosis risk in communities) a montré une relation continue entre le taux d’HBA1c (hémoglobine glyquée) et le risque d’IC, que le sujet soit diabétique ou non [
16]. Plusieurs études épidémiologiques montrent que la prévalence mondiale du diabète augmente. On estime que celle-ci sera de 6,3 % en 2025 contre 5,1 % en 2003, représentant ainsi un véritable défi dans le cadre de la prévention primaire des AVC. Contrairement à ce qui est observé dans la pathologie coronarienne, le rôle du cholestérol en tant que facteur de risque d’IC reste controversé et mal compris, et les données issues des études épidémiologiques divergent. Ainsi, une méta-analyse portant sur 45 études regroupant 450 000 sujets n’a pas fait état d’une relation positive entre cholestérol total et risque d’AVC (IC ou HIC) [
17]. Cependant, une relation faible était présente pour les IC chez les sujets d’âge moyen (40-69 ans). Cette approche présente toutefois plusieurs limites. En effet, ces études ont considéré uniquement les AVC mortels, et il est possible que les IC mortels soient moins fortement associés au cholestérol en raison d’étiologies particulières. De plus, l’hétérogénéité étiologique des IC n’a été prise en compte dans aucune de ces études. Néanmoins, les statines ont démontré leur efficacité dans la prévention du risque vasculaire cérébral. Cette efficacité pourrait être liée à l’effet hypocholestérolémiant mais également aux autres effets biologiques du traitement. Ainsi, quel que soit le niveau initial du LDL cholestérol, une diminution de 1 mmol/L du LDL cholestérol était associée à une réduction relative du risque d’IC de 19 % [
18]. Le HDL cholestérol est une fraction très riche en protéines, en particulier l’ApoA1. Il existe une relation inverse entre taux de HDL cholestérol et risque d’IC qui pourrait être plus forte dans les accidents liés à l’athérosclérose [
19]. Enfin, le rôle des triglycérides comme facteur de risque d’IC est incertain car les résultats des études sont contradictoires. En fait, l’hypertriglycéridémie s’intègre très souvent dans le cadre d’un syndrome métabolique pouvant augmenter le risque d’IC.
-
Le rôle du tabac et de l’alcool
Une méta-analyse de 32 études a montré que les fumeurs avaient un risque d’IC multiplié par deux environ [
20]. Il s’agit aussi d’un facteur de risque bien documenté d’athérosclérose et il existe une relation dose-effet entre consommation de tabac et risque d’IC. Cependant, cette relation n’est probablement pas complètement linéaire et le risque vasculaire augmente très vite pour des petites expositions. Ainsi, le rôle du tabagisme passif a été confirmé avec un risque relatif de 1,8 chez les non-fumeurs ou les anciens fumeurs, hommes ou femmes exposés à un environnement de fumeurs [
21]. Ces observations sont en accord avec des données biologiques qui montrent que de faibles expositions au tabac sont susceptibles d’activer l’agrégation plaquettaire et de provoquer des modifications hémodynamiques aiguës. Ainsi, le tabac augmente le risque d’IC probablement à court terme par des effets prothrombotiques et à plus long terme en favorisant le développement de l’athérosclérose. Enfin, une interaction (ou effet synergique) entre tabac et contraception hormonale a été observée. Dans une étude cas-témoins multicentrique conduite chez des femmes, l’augmentation du risque d’IC associée à la consommation conjointe de tabac et d’une contraception était plus élevée que ce qu’on aurait attendu par une simple multiplication des odds ratios [
22]. Une méta-analyse de 35 études observationnelles a montré qu’une consommation régulière d’alcool supérieure à 60 g par jour est associée a un risque accru d’IC [
23]. Néanmoins, comme dans la maladie coronaire, une consommation régulière modérée d’alcool (12-24 g/J) est associée à une diminution du risque d’IC. La relation entre alcool et IC semble indépendante du type d’alcool, même si l’effet protecteur d’une consommation modérée semble moindre avec la bière. Cette relation a une certaine plausibilité biologique car l’alcool à petites doses diminue l’agrégation plaquettaire, augmente le taux de HDL cholestérol, et diminue le taux de fibrinogène plasmatique.
-
Contraception et traitement hormonal substitutif
Le rôle des hormones féminines dans la survenue de la pathologie cérébrovasculaire a été également étudié. Ainsi, la contraception orale est associée à un risque accru d’IC avec un risque relatif compris entre 2 et 4 [
24]. L’association existe quel que soit le type de pilule et son dosage en œstrogènes, même si elle est plus faible avec les pilules microdosées (< 50 µg d’œstrogènes). Cependant, compte tenu de la faible incidence de la maladie dans la tranche d’âge des femmes qui utilisent les contraceptifs oraux, le risque attribuable aux contraceptifs et l’excès de risque absolu sont très faibles. Les grands essais randomisés récents ont montré que le traitement hormonal substitutif (THS) de la ménopause, œstroprogestatif ou par œstrogènes seuls, augmentait de 29 % le risque d’IC [
25]. Le THS serait aussi plus fortement associé aux accidents sévères. Ces résultats incitent à ne pas prescrire de THS et à l’arrêter chez les femmes à haut risque vasculaire. D’autres facteurs de risque d’IC ont été identifiés (Tableau II). Parmi ceux-ci, l’arythmie cardiaque par fibrillation auriculaire (ACFA) occupe une place particulière. Bien qu’étant un facteur causal, elle figure au sein des facteurs de risque dans la plupart des études épidémiologiques. Ce trouble du rythme cardiaque est très fréquent dans la population adulte générale, sa prévalence y ayant été évaluée à environ 1 % et augmentant avec l’âge [
26]. Ainsi, le risque d’infarctus cérébral attribuable à une fibrillation auriculaire augmente lui aussi significativement avec l’âge, passant de 1,5 % chez les sujets âgés de 50 à 59 ans à 23,5 % dans la tranche d’âge 80-89 ans [
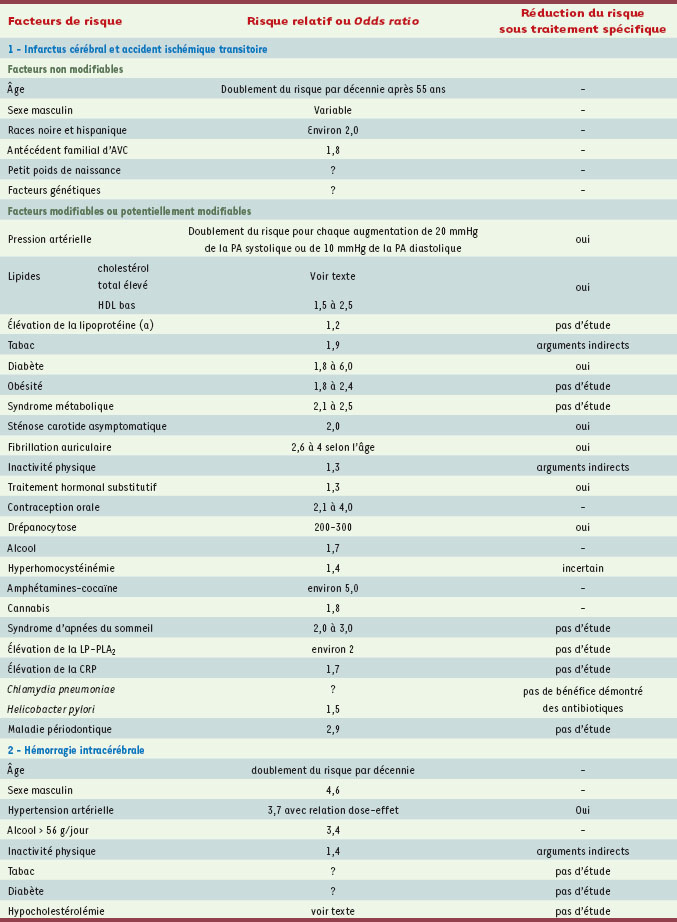
27]. Ce risque est augmenté en cas d’hypertension artérielle, d’antécédent d’AVC ou d’AIT, de diabète, de dilatation de l’oreillette gauche, de calcifications mitrales, d’insuffisance ventriculaire gauche et d’images évocatrices (contrastes spontanés) à l’échographie transœsophagienne1.  | Tableau II.
Principaux facteurs de risque des infarctus cérébraux et hémorragies intracérébrales (d’après [ 7]). |
Hémorragies intracérébrales L’HTA est le facteur de risque majeur des HIC dont elle multiplie le risque par 10 [ 14]. La prévalence de ce facteur de risque chez les sujets ayant présenté une HIC est estimée entre 60 et 80 % [
28]. Contrairement à ce qui est observé dans les IC, l’alcool augmente le risque d’HIC même pour des consommations faibles, avec une relation dose-effet. Une consommation régulière supérieure à 60 g par jour est associée à un doublement du risque d’HIC [23]. Certaines études ont suggéré une relation inverse entre le niveau de LDL-cholestérol ou de triglycérides et le risque de survenue d’HIC [
29]. Enfin, le rôle d’autres facteurs de risque dans la survenue d’HIC est encore en débat (Tableau II). |
L’épidémiologie des AVC a permis l’identification des facteurs de risque de la maladie et une meilleure codification des interventions thérapeutiques tant en prévention primaire que secondaire. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Béjot Y, Touzé E, Osseby GV, Giroud M. Épidémiologie descriptive. In : Bousser MG, Mas JL, eds. Accidents vasculaires cérébraux. Paris : Doin, 2009. 2. Béjot Y, Osseby GV, Aboa-Éboulé C, et al. Dijon’s vanishing lead with regard to low incidence of stroke. Eur J Neurol 2009; 16 : 324–9. 3. Leys D, Béjot Y, Debette S, Giroud M. Burden of stroke in France. Int J Stroke 2008; 3 : 117–9. 4. Strong K, Mathers C, Bonita R. Preventing stroke: saving lives around the world. Lancet Neurol 2007; 6 : 182–7. 5. Connor MD, Walker R, Modi G, Warlow CP. Burden of stroke in black populations in sub-Saharan Africa. Lancet Neurol 2007; 6 : 269–78. 6. Kolominsky-Rabas PL, Weber M, Gefeller O, et al. Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence and long-term survival in ischemic stroke subtypes, a population-based study. Stroke 2001; 32 : 2735–40. 7. Touzé E, Varenne O, Chatellier G, et al. Risk of myocardial infarction and vascular death after transient ischemic attack and ischemic stroke: a systematic review and meta-analysis. Stroke 2005; 36 : 2748–55. 8. Béjot Y, Rouaud O, Durier J, et al. Decrease in the stroke case fatality rates in a French population-based twenty-year study. A comparison between men and women. Cerebrovasc Dis 2007; 24 : 439–44. 9. Touzé E, Béjot Y. Épidémiologie analytique. In : Bousser MG, Mas JL, eds. Accidents vasculaires cérébraux. Paris : Doin, 2009. 10. Rothwell PM, Coull AJ, Silver LE, et al. Population-based study of event-rate, incidence, case fatality, and mortality for all acute vascular events in all arterial territories (Oxford vascular study). Lancet 2005; 366 : 1773–83. 11. White H, Boden-Albala B, Wang C, et al. Ischemic stroke subtype incidence among whites, blacks, and Hispanics: the Northern Manhattan Study. Circulation 2005; 111 : 1327–31. 12. Touzé E, Rothwell PM. Heritability of ischaemic stroke in women compared with men: a genetic epidemiological study. Lancet Neurol 2007; 6 : 125–33. 13. Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002; 360 : 1903–13. 14. Sacco RL, Wolf PA, Gorelick PB. Risk factors and their management for stroke prevention: outlook for 1999 and beyond. Neurology 1999; 53 : S15–24. 15. Stegmayr B, Asplund K. Diabetes as a risk factor for stroke. Diabetologia 1995; 38 : 1061–8. 16. Selvin E, Coresh J, Shahar E, et al. Glycaemia (haemoglobin A1c) and incident ischaemic stroke: the atherosclerosis risk in communities (ARIC) study. Lancet Neurol 2005; 4 : 821–6. 17. Prospective studies collaboration. Cholesterol, diastolic blood pressure, and stroke: 13,000 strokes in 450,000 people in 45 prospective cohorts. Lancet 1995; 346 : 1647–53. 18. Baigent C, Keech A, Kearney PM, et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet 2005; 366 : 1267–78. 19. Sanossian N, Saver JL, Navab M, Ovbiagele B. High-density lipoprotein cholesterol: an emerging target for stroke treatment. Stroke 2007;38 : 1104–9. 20. Shinton R, Beevers G. Meta-analysis of relation between cigarette smoking and stroke. Br Med J 1989; 298 : 789–94. 21. Bonita R, Duncan J, Truelsen T, et al. Passive smoking as well as active smoking increases the risk of acute stroke. Tob Control 1999; 8 : 156–60. 22. WHO Collaborative Study. Ischaemic stroke and combined oral contraceptives: results of an international, multicentre, case-control study. WHO collaborative study of cardiovascular disease and steroid hormone contraception. Lancet 1996; 348 : 498–505. 23. Reynolds K, Lewis B, Nolen JD, et al. Alcohol consumption and risk of stroke:a meta-analysis. JAMA 2003; 289 : 579–88. 24. Chan WS, Ray J, Wai EK, et al. Risk of stroke in women exposed to low-dose oral contraceptives: a critical evaluation of the evidence. Arch Intern Med 2004; 164 : 741–7. 25. Bath PM, Gray LJ. Association between hormone replacement therapy and subsequent stroke: a meta-analysis. Br Med J 2005; 330 : 342. 26. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the anticoagulation and risk factors in atrial fibrillation (ATRIA) study. JAMA 2001; 285 : 2370–5. 27. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study. Stroke 1991; 22 : 983–8. 28. Rothwell PM, Coull AJ, Giles MF, et al. Change in stroke incidence, mortality, case-fatality, severity, and risk factors in Oxfordshire, UK from 1981 to 2004. Lancet 2004; 363 : 1925–33. 29. Sturgeon JD, Folsom AR, Longstreth WT Jr, et al. Risk factors for intracerebral hemorrhage in a pooled prospective study. Stroke 2007; 38 : 2718–25. |