| |
| Med Sci (Paris). 2009 August; 25(8-9): 663–665. Published online 2009 August 15. doi: 10.1051/medsci/2009258-9663.Découverte d’une nouvelle classe d’antituberculeux : les benzothiazinones (BTZ) Brigitte Saint-Joanis* and Roland Brosch* Institut Pasteur, Pathogénomique mycobactérienne intégrée, 25, rue du Docteur Roux, 75015 Paris, France MeSH keywords: Antituberculeux, Benzothiazoles, Éthambutol, Humains, Incidence, Mycobacterium tuberculosis, Tuberculose |
Un besoin urgent de nouveaux antituberculeux La tuberculose est une maladie infectieuse ayant frappé l’homme depuis des temps très reculés, depuis la Haute Antiquité, voire depuis la Préhistoire [
1]. De nos jours, environ un tiers de la population mondiale serait infecté par Mycobacterium tuberculosis, l’agent de la tuberculose humaine. Seulement 5 à 10 % des personnes infectées développent la maladie au cours de leur vie, mais en l’absence de traitement 50 % des cas demeurent mortels [
2,
4]. Alors qu’on espérait éradiquer la tuberculose grâce à une vaccination massive par le bacille de Calmette et Guérin (BCG) et à l’utilisation d’antituberculeux développés dans les années 1940-1960, la tuberculose reste un problème majeur de santé publique à l’échelle mondiale. Une recrudescence est observée depuis la fin du xxe siècle, ce qui suscite un nouvel intérêt pour la tuberculose et les mycobactéries pathogènes. Au début de ce nouveau millénaire, la situation est très préoccupante : on recense 6 à 8 millions de nouveaux cas par an dans le monde qui sont responsables de 1,7 millions de décès ; l’incidence est particulièrement élevée en Asie et en Afrique (Figure 1) et l’on estime que la tuberculose fera encore 30 millions de victimes au cours de la prochaine décennie [
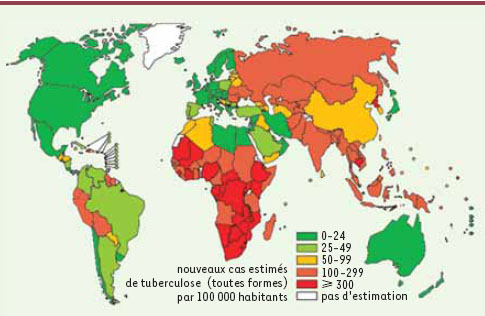
3]. Le développement accru de la tuberculose est lié à la pauvreté, à la synergie avec la pandémie du Sida, à l’émergence de souches multirésistantes mais aussi à l’aspect contraignant et parfois à l’inefficacité du traitement actuel ne comprenant qu’une faible diversité d’antibiotiques spécifiques.  | Figure 1.
Estimation des cas de tuberculose recensés par l’Organisation mondiale de la santé (OMS) en 2007.
|
Malgré l’urgence qu’il y a à vaincre ce fléau, les efforts pour trouver de nouveaux antituberculeux ont été relativement modestes depuis les années 1980 [4] (→). (→) voir l’article de J.E. Hugonnet, page 661 de ce numéro
Les fluoroquinolones [
5] ont été introduites récemment dans la batterie d’antituberculeux de seconde intention (les médicaments les plus efficaces comme l’isoniazide et la rifampicine sont utilisés en première intention). Très peu de molécules actives contre M. tuberculosis ont été décrites depuis l’an 2000 ; citons les nitroimidazopyranes (PA-824) [
6], les SQ109 [
7], ou les diarylquinolines [
8]. Par conséquent, la découverte d’une nouvelle classe d’antituberculeux, les benzothiazinones (BTZ), par le consortium européen NM4TB (New medicines for tuberculosis) coordonné par le professeur Stewart Cole (directeur du Global Health Institute à l’EPFL, École polytechnique fédérale de Lausanne) constitue une avancée remarquable aux perspectives prometteuses pour lutter contre la tuberculose et notamment contre les bacilles tuberculeux multirésistants MDR (multidrug-resistant), voire ultrarésistants XDR (extensively drug-resistant) résistant aux agents de première intention, aux aminosides injectables et aux quinolones. Les résultats concernant les benzothiazinones ont été obtenus dans le cadre d’une collaboration internationale impliquant un chimiste russe, le docteur Vadim Makarov, des microbiologistes italiens, slovaques, allemands, français, britanniques, danois, indiens et ont fait l’objet d’une publication récente dans Science [
9]. |
Les benzothiazinones (BTZ), extrêmement actives sur les mycobactéries Une série de composés hétérocycles contenant du soufre a été synthétisée et leur activité antibactérienne et antifongique a été testée. Parmi ces composés, les nitro-benzothiazinones (rôle déterminant du groupement nitro) se sont avérées être extrêmement actives in vitro (200 à 1 000 fois plus que l’isoniazide) contre M. tuberculosis et, de plus, spécifiques des mycobactéries. Un de ces composés, BTZ043 a été sélectionné pour sa grande efficacité, son absence de toxicité et de pouvoir mutagène. BTZ043 est aussi remarquablement actif sur tous les isolats cliniques testés dont des souches multirésistantes et ultrarésistantes. La grande efficacité de BTZ043 a été également démontrée dans le modèle intracellulaire : la concentration minimale inhibitrice (CMI) de BTZ043 sur des macrophages infectés par M. tuberculosis est 100 fois plus faible que celle de l’isoniazide. Enfin il exerce le même pouvoir bactéricide que l’isoniazide ou la rifampicine qui protègent les souris contre des infections aiguës ou chroniques par M. tuberculosis. |
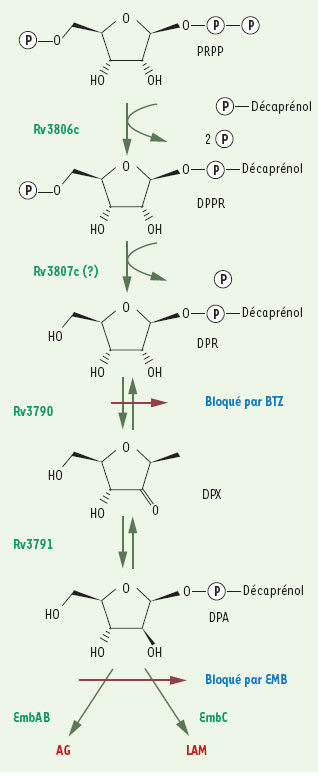
Identification de la cible et mécanisme d’action Des études génétiques et biochimiques ont permis d’identifier la cible de BTZ043 : c’est une enzyme impliquée dans la synthèse de l’arabinane, composant de la paroi mycobactérienne. L’inhibition de cette enzyme qui catalyse l’épimérisation du décaprénylphosphoryl ribose (DPR) en décaprénylphosphoryl arabinose (DPA) (Figure 2) entraîne la lyse et la mort cellulaires. En effet, le DPA est un précurseur clé requis pour la synthèse du lipoarabinomannane (LAM) et de l’arabinogalactane (AG), composants majeurs de la paroi des mycobactéries. BTZ043 bloque donc une étape du métabolisme actif et il est par conséquent moins efficace sur des bactéries dont le métabolisme est inerte. L’analyse comparative du transcriptome de M. tuberculosis après traitement par BTZ043 révèle une signature transcriptionnelle caractéristique d’inhibiteurs de la paroi cellulaire, comme l’isoniazide et l’éthionamide et aussi l’éthambutol (EMB) dont la signature est la plus similaire à celle de la benzothiazinone. Cette similitude s’explique par le fait que les cibles respectives de BTZ et EMB appartiennent à la même voie métabolique de synthèse du LAM et de l’AG (Figure 2), l’EMB intervenant en aval de BTZ.  | Figure 2.
Sites d’action des benzothiazinones (BTZ) et de l’éthambutol (EMB). AG : arabinogalactane ; LAM : lipoarabinogalactane (d’après [ 9]). |
|
Intérêt des benzothiazinones et perspectives thérapeutiques La cible des benzothiazinones est un composant de la machinerie de construction de la paroi cellulaire des mycobactéries, ce qui est également le cas d’autres antituberculeux comme l’isoniazide et l’éthambutol. Toutefois, la découverte de cette nouvelle cible est capitale : elle définit une voie de recherche d’inhibiteurs non explorée jusqu’alors. Comme nous l’évoquions ci-dessus, BTZ et EMB ont une action inhibitrice sur la même voie métabolique de synthèse de maillons essentiels de la paroi mycobactérienne (lipoarabinomannane et arabinogalactane). Cependant, BTZ est 1 000 fois plus actif que l’EMB contre M. tuberculosis et l’éthambutol, quoique utilisé comme médicament de première intention, présente l’inconvénient d’induire des effets secondaires (troubles visuels). Les benzothiazinones représentent des médicaments candidats anti-tuberculeux sérieux. Ces nouvelles molécules pourraient être introduites dans un avenir proche dans la batterie d’antituberculeux actuellement recommandée pour lutter à la fois contre des tuberculoses à bacilles sensibles, MDR ou XDR afin d’écourter le traitement. Ce serait un pas décisif sachant que l’émergence de bacilles multirésistants est due à la longueur et aux contraintes mal respectées du traitement. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Merci à Vadim Makarov et Stewart Cole pour leur soutien. Le travail décrit dans cet article a été subventionné par le programme FP6 de la Commission Européenne, numéro de contrat (LHSP-CT-2005-018923).
|
1. Donoghue HD, Spigelman M, Greenblatt CL, et al. Tuberculosis: from prehistory to Robert Koch, as revealed by ancient DNA. Lancet Infect Dis 2004;4 : 584–92. 2. Kaufmann SH. How can immunology contribute to the control of tuberculosis ? Nat Rev Immunol 2001;1 : 20–30. 3. Dye C. Global epidemiology of tuberculosis. Lancet 2006; 367 : 938–40. 4. Hugonnet JE. Une thérapie prometteuse contre les souches ultrarésistantes de M. tuberculosis. Med Sci (Paris) 2009; 25 : 661–3. 5. Rodriguez JC, Ruiz M, Climent A, Royo G. In vitro activity of four fluoroquinolones against Mycobacterium tuberculosis. Int J Antimicrob Agents 2001; 17 : 229–31. 6. Stover CK, Warrener P, VanDevanter DR, et al. A small-molecule nitroimidazopyran drug candidate for the treatment of tuberculosis. Nature 2000; 405 : 962–6. 7. Protopopova M, Hanrahan C, Nikonenko B, et al. Identification of a new antitubercular drug candidate, SQ109, from a combinatorial library of 1,2-ethylenediamines. J Antimicrob Chemother 2005; 56 : 968–74. 8. Andries K, Verhasselt P, Guillemont J, et al. A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis. Science 2005; 307 : 223–7. 9. Makarov V, Manina G, Mikusova K, et al. Benzothiazinones kill Mycobacterium tuberculosis by blocking arabinan synthesis. Science 2009; 324 : 801–4. |