| |
| Med Sci (Paris). 2009 May; 25(5): 513–518. Published online 2009 May 15. doi: 10.1051/medsci/2009255513.Analyse échocardio-graphique du ventricule droit Abdallah Fayssoil,1* Soumeth Abasse,2 and Olivier Nardi3 1Service de cardiologie, CHU de Bicêtre, AP-HP, 78, rue du Général Leclerc, 94275 Le Kremlin-Bicêtre, France 2Service de pédiatrie, CHU de Reims, Reims, France 3Service de reeducation cardiovasculaire, CHU Raymond Poincaré, AP-HP, Garches, France |
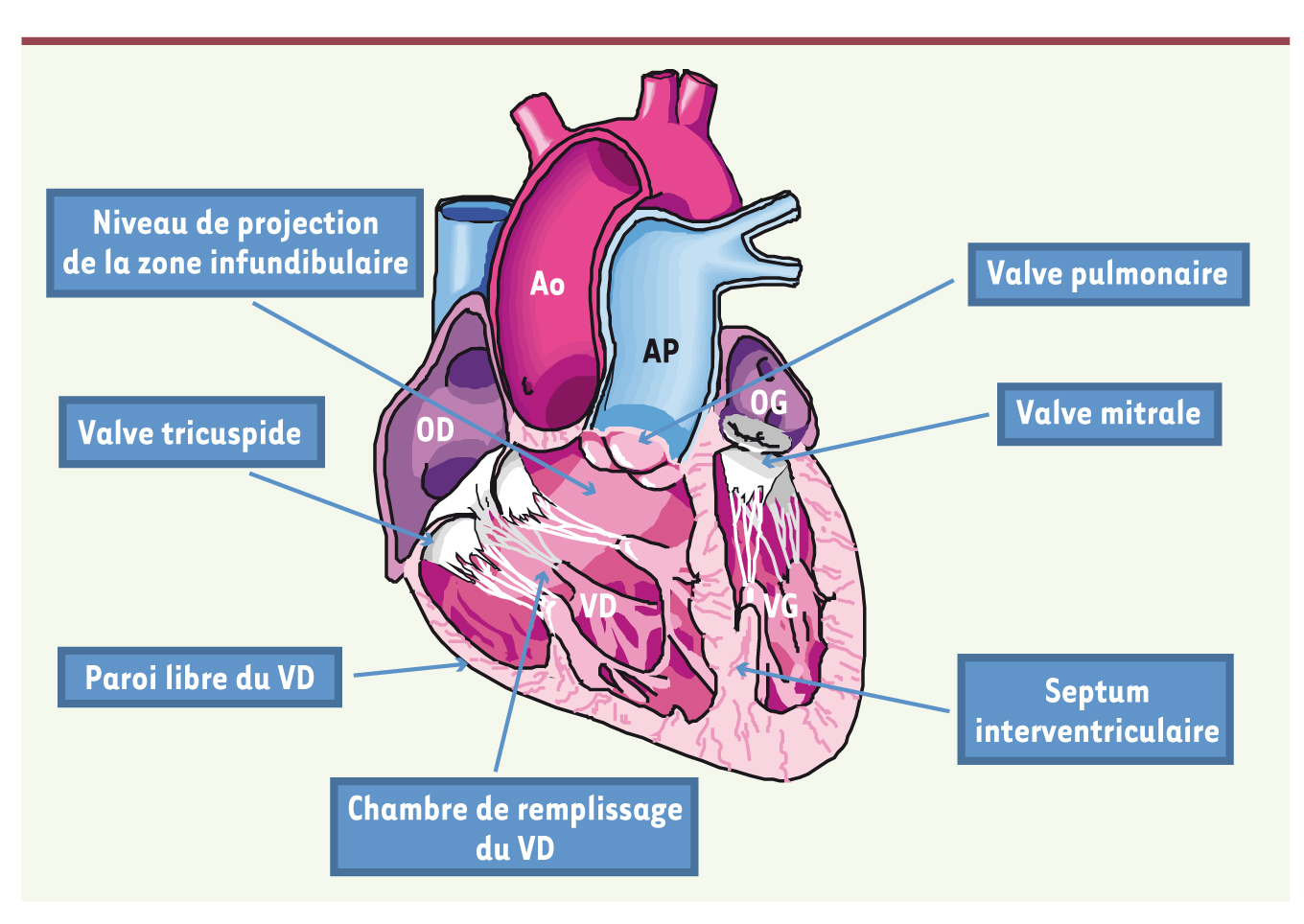
Pendant de nombreuses années, l’analyse du VD a souvent été négligée dans l’évaluation échocardiographique des patients. Pourtant, le VD joue un rôle important en physiologie et en physiopathologie cardio-pulmonaires. Le pronostic des patients est affecté en cas d’atteinte de la fonction du VD dans l’infarctus du myocarde (IDM), les cardiopathies congénitales, l’hypertension artérielle pulmonaire (HTAP) et chez les patients atteints d’insuffisance cardiaque aiguë ou chronique. Plusieurs techniques permettent d’analyser le VD. L’approche peut être non invasive et/ou invasive. L’approche invasive est ancienne et garde sa place surtout dans l’évaluation précise des patients atteints d’HTAP et dans le cadre d’un bilan pré-transplantation cardiaque (mesure des résistances vasculaires pulmonaires). L’approche non invasive comprend l’échocardiographie-doppler, l’évaluation isotopique et l’imagerie par résonance magnétique cardiaque. L’approche échocardiographique a longtemps été limitée à cause de la géométrie complexe du VD. En effet, le VD présente une géométrie particulière (Figure 1) ; il est composé de 2 entités : un corps qui représente la chambre de remplissage et une zone infundibulaire qui représente la chambre d’éjection. Il en résulte une impossibilité quant à l’utilisation de modèles géométriques pour analyser le VD, contrairement au VG. De plus, la géométrie du VD change en fonction des conditions de charges imposées, en l’occurrence dans les pathologies pulmonaires chroniques, les valvulopathies significatives et les cardiopathies congénitales. Avec l’arrivée des nouvelles technologies en imagerie cardiaque (doppler tissulaire myocardique = DTI, strain et 2D speckle tracking), on assiste à un regain d’intérêt pour l’approche échocardiographique.  | Figure 1.
Rappel de l’anatomie des cavités cardiaques.
Ao : aorte ; AP : artère pulmonaire ; OD : oreillette droite ; OG : oreillette gauche ; VD : ventricule droit ; VG : ventricule gauche. |
|
Analyse morphologique du ventricule droit Le VD est une cavité compliante et s’adapte donc aux conditions de charge. Il tolère mieux une surcharge de volume qu’une surcharge de pression. Ainsi, l’élévation des pressions pulmonaires peut altérer la fonction ventriculaire droite. Le VD s’adapte progressivement à l’élévation de la post-charge par une hypertrophie, un aplatissement du septum interventriculaire (SIV). Mais progressivement, la surcharge de pression finit par entraîner une altération de la fonction systolique du VD et sa dilatation, une dilatation de l’anneau tricuspide et donc une aggravation d’une insuffisance tricuspidienne (IT) préexistante, entraînant à son tour une altération de la fonction diastolique. Il est donc important de suivre les patients atteints d’une pathologie respiratoire chronique, d’une valvulopathie significative ou d’insuffisance cardiaque afin de dépister une atteinte du VD pouvant entraîner une sanction thérapeutique. L’échocardiographie demeure alors intéressante et importante. À partir des coupes en apical 4 cavités et en parasternal (voir glossaire), il est possible de décrire la morphologie du VD, sa cinétique segmentaire et l’épaisseur de sa paroi libre, d’analyser l’aspect du SIV, de mesurer le diamètre de l’anneau tricuspide. En effet, par exemple, chez les patients ayant une insuffisance mitrale importante, la réparation de la valve mitrale peut être associée à une plastie tricuspidienne en cas de dilatation importante de l’anneau tricuspide. De même, en cas d’embolie pulmonaire, l’échocardiographie permet de rechercher les signes d’un cœur pulmonaire aigu et des signes de gravité. Par ailleurs, l’analyse morphologique du VD sera complétée par une analyse fonctionnelle évaluant la fonction systolique du VD, une mesure des pressions pulmonaires, la recherche d’une IT et enfin l’analyse de la veine cave inférieure (VCI). |
Analyse classique de la fonction systolique du ventricule droit Pendant longtemps, cette analyse reposait sur le calcul de la fraction de raccourcissement de surface (FRS) et une estimation semiquantitative de la fraction d’éjection du ventricule droit (FEVD). La FRS est obtenue en mesurant la surface télésystolique et la surface télédiastolique du VD en 4 cavités, grâce à la formule suivante : [(surface télédiastolique-surface télésystolique)/ surface télédiastolique] × 100. La FEVD est calculée à partir des données systolique et diastolique du VD en planimétrie. La FEVD se situe habituellement entre 40 % et 76 % [
1,
2]. Il existe une bonne corrélation entre la FEVD obtenue en échocardiographie et la FEVD obtenue par mesure isotopique (r = 0,8) [
3]. Néanmoins, la FEVD n’est pas un bon reflet de la contractilité du VD. En effet, elle est dépendante des conditions de charge. De plus, il est souvent difficile de reconnaître les contours endocardiques du VD à cause des trabéculations. Le calcul de la FEVD est aussi limité en cas de mauvaise visualisation de la paroi libre du VD. Dans cette optique, l’imagerie par résonance magnétique (IRM) cardiaque aide à mieux estimer cette FEVD, grâce à une meilleure délimitation des contours endocardiques. |
Il est important de calculer le débit cardiaque à droite surtout chez les patients atteints de cardiopathies congénitales, en l’occurrence dans les shunt gauche-droit. Le débit du VD est calculé en multipliant le volume d’éjection systolique (VES) par la fréquence cardiaque (FC). Le VES est calculé à partir de la surface de l’anneau pulmonaire (πD²/4) multipliée par l’ITV (intégrale temps vitesse du flux pulmonaire en doppler pulsé à l’anneau pulmonaire) sous-pulmonaire, D étant le diamètre de l’anneau pulmonaire. La mesure du débit est limitée par la mesure du diamètre de l’anneau. |
Analyse de la fonction systolique du VD à l’aide du TAPSE Le TAPSE (tricuspid annular plane systolic excursion) est l’excursion systolique du plan de l’anneau tricuspide mesuré en temps-mouvement (TM). Ce déplacement de la valve tricuspide vers l’apex du VD pendant la systole est un bon reflet de la fonction systolique du VD. Une excellente corrélation (r = 0,92) entre le TAPSE et la FE isotopique du VD a été trouvée par S. Kaul et al. [3] dans une série de 30 patients. Un TAPSE < 12 mm correspond à une dysfonction systolique du VD. En revanche, une excursion systolique de plus de 15 mm est le plus souvent associée à une FEVD normale. Le TAPSE a aussi une valeur pronostique, notamment chez les patients en insuffisance cardiaque et chez les patients suivis pour HTAP. Dans une série analysée par S. Ghio [
4] de 140 patients en insuffisance cardiaque avec une FE du VG < 35 %, un TAPSE < 14 mm était un élément de mauvais pronostic. De même, dans un travail qui incluait 63 patients souffrant d’HTAP, P.R. Forfia et al. [
5] ont analysé les données obtenues en cathétérisme et en échocardiographie-Doppler. Un TAPSE < 18 mm était associé à une dysfonction systolique du VD. Chez les patients ayant une HTAP, la survie à 1 an et à 2 ans était respectivement de 94 % et de 88 % si le TAPSE excédait 18 mm mais de 60 % et 50 % s’il était inférieur à 18 mm. |
Doppler tissulaire myocardique (DTI) Le DTI est utilisé depuis longtemps pour l’analyse de la fonction ventriculaire gauche. L’approche DTI permet l’analyse des vitesses de déplacement des parois au niveau d’un point spatial précis choisi. Pour cela, il est important d’avoir un alignement correct entre le tir Doppler et la paroi myocardique analysée. En effet, concernant l’analyse du VD, le tir Doppler doit être parallèle à la paroi libre du VD afin d’éviter une fausse estimation des vélocités myocardiques. Il est aussi important d’ajuster les filtres et de diminuer les gains Doppler avant le recueil du signal. Le TDI peut être utilisé en mode spectral pulsé permettant de recueillir les vélocités en systole et en diastole ou en mode couleur. Pour l’exploration de la fonction du VD, le DTI est appliqué à la paroi latérale de l’anneau tricuspide et permet d’obtenir le pic systolique (S) à l’anneau tricuspide et les pics diastoliques (Ea, Aa) (Figure 2).  | Figure 2.
Doppler tissulaire myocardique à l’anneau tricuspide pour l’analyse du VD.
À partir d’une coupe apicale 4 cavités, l’échantillon doppler est positionné au niveau de la paroi latérale de l’anneau tricuspide et l’analyse DTI permet d’obtenir les vélocités de la paroi en (onde S) et en diastole (onde Ea et Aa). 1 = onde S systolique. 2 = onde Ea diastolique. + = onde Aa diastolique. |
Chez les sujets sains, le pic de l’onde S à l’anneau tricuspide est en général plus important comparativement au pic de l’onde S recueilli à l’anneau mitral (15,2 ± 1,9 cm/seconde contre 11,1 ± 2,9 cm/sec) [
6]. Le DTI aide à trouver une dysfonction systolique du VD dans la pathologie coronarienne aiguë chez les patients atteints d’insuffisance cardiaque aiguë ou chronique et chez les patients atteints de pathologie pulmonaire chronique ou souffrant d’HTAP. Ainsi, en cas d’IDM inférieur, le DTI permet de rechercher une atteinte du VD qu’il est important de reconnaître car elle sera prise en compte dans la prise en charge du patient, étant donné le pronostic péjoratif qui lui est associé. Un pic de l’onde S à l’anneau tricuspide (paroi latérale) < 10,6 cm/s permet le diagnostic d’atteinte du VD (sensibilité 100 %, spécificité 92 %) chez les patients ayant une atteinte électrique myocardique, d’après M. Yilmaz [
7]. Dans un travail réalisé par J. Meluzin et al. [
8], une onde S systolique à l’anneau tricuspide (Sa VD) < 11,5 cm/s reflétait une FE isotopique du VD < 45 % (sensibilité de 90 %, spécificité de 85 %). Il existait une bonne corrélation entre le SaVD et la FEVD obtenue par méthode isotopique (r = 0,65 ; p < 0,001) [8]. Chez les patients en insuffisance cardiaque, une diminution du pic de l’onde Sa VD est corrélée à une atteinte sévère du VD [8]. Par ailleurs, ces mêmes auteurs observent qu’une diminution du pic de l’onde Sa VD (<10,8cm/seconde) est un élément de mauvais pronostic chez les patients en insuffisance cardiaque [
9]. Chez les patients atteints d’HTAP, le DTI apporte des informations sur une éventuelle atteinte du VD. Il apporte une aide diagnostique pour le suivi et l’analyse de la réponse thérapeutique des patients atteints de pathologie systémique (sclérodermie par exemple). P. Lindqvist et al. [
10] ont observé un allongement du temps de relaxation isovolumique chez les patients atteints de sclérodermie comparativement à un groupe contrôle. |
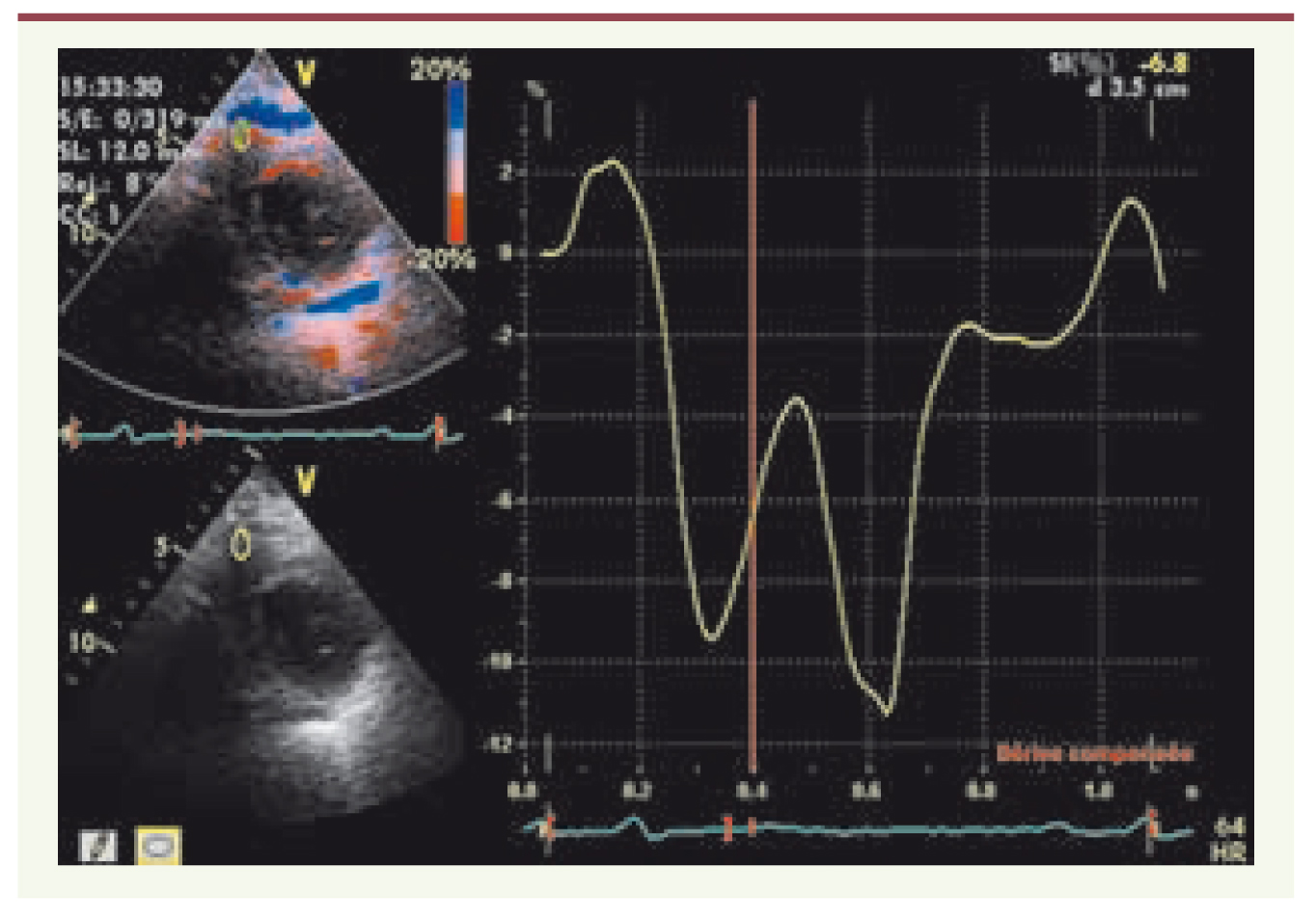
Strain et Strain rate dans l’analyse de la fonction ventriculaire droite Une des limites de l’analyse des vélocités myocardiques à un point donné du myocarde en DTI résulte du fait que le DTI ne permet pas de différencier les mouvements passifs des mouvements actifs de la région myocardique sélectionnée, ce qui peut être à l’origine d’une erreur d’analyse d’un segment non fonctionnel. Le strain, technologie dérivée des applications du DTI, permet de pallier ce défaut en permettant une analyse de la déformation segmentaire (Figure 3). 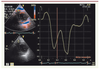 | Figure 3.
Analyse du ventricule droit en strain à partir d’une coupe parasternale petit axe.
L’échantillon doppler est positionné au niveau de la paroi libre du VD. |
Le strain permet de quantifier la déformation relative d’un segment lors de l’application d’une force. Ainsi, si un segment de longueur L0 présente une longueur L1 en réponse à l’application d’une force, le strain est donné par la valeur du rapport L1-L0/L0. Exprimé en pourcentage, le strain est négatif en cas de raccourcissement et positif en cas d’étirement du segment. Il permet d’analyser la fonction systolique myocardique régionale. Le strain rate dérive du strain et mesure la vitesse de déformation myocardique. Il s’exprime en 1/s. Dans le VD, en analyse longitudinale, il existe un gradient physiologique des vélocités entre la base et l’apex, les vélocités étant plus importantes à la base. Les vélocités du VD sont par ailleurs plus élevées que les vélocités myocardiques du VG [
11]. Cette différence s’explique par les conditions de charge qui sont plus élevées pour le VG comparativement au VD. De plus, les fibres longitudinales et obliques sont nombreuses au niveau de la paroi libre du VD [
12]. En échocardiographie Doppler, les valeurs obtenues en strain et strain rate au niveau du VD sont très hétérogènes avec des valeurs très élevées au niveau du segment apical [
13]. Le strain normal est de 19 ± 6 % en basal, de 27 ± 6 % en médian et de 32 ± 6 % en apical [11]. Chez les patients suivis pour HTAP [
14], ou pour BPCO (bronchopneumopathie chronique obstructive) avec HTAP (>35mmHg) [
15], les valeurs de strain sont diminuées comparativement à un groupe contrôle. Cela étant, l’analyse du VD par strain et strain rate présente des limites. En effet, comme dans l’analyse par DTI, il faut un alignement parfait avec la paroi libre du VD en coupe apicale pour éviter des résultats erronés. Par ailleurs, il est difficile d’analyser les données en parasternal petit axe (fonction radiale) ; la paroi libre du VD est fine et les données de la littérature insuffisantes. Un défaut de visibilité de la paroi du VD peut aussi être à l’origine de valeurs erronées. De même, les conditions de charge influencent les résultats [
16]. |
Contrairement au DTI et au strain, le 2D speckle tracking permet de se passer du problème d’angle. En revanche, pour l’obtention des mesures, il est important d’avoir une meilleure délimitation des contours de l’endocarde [
17]. Le 2D speckle tracking repose sur l’analyse de pixels (speckle). Au niveau de chaque zone sélectionnée, le logiciel repère un groupe de pixels (speckle) qu’il recherche dans l’image suivante au sein d’une zone élargie. On peut ainsi analyser le déplacement d’une zone dans les 2D voire 3 dimensions de l’espace. Cependant, cette technologie présente une résolution temporelle faible. Appliqué au VG, le 2D speckle tracking permet donc une analyse séparée des fonctions longitudinale, radiale et de la torsion du VG. Les données sont encore insuffisantes dans la littérature pour la fonction ventriculaire droite. Le 2D speckle tracking peut aider au diagnostic de certaines dysplasies comme la dysplasie arythmogène du VD [17]. |
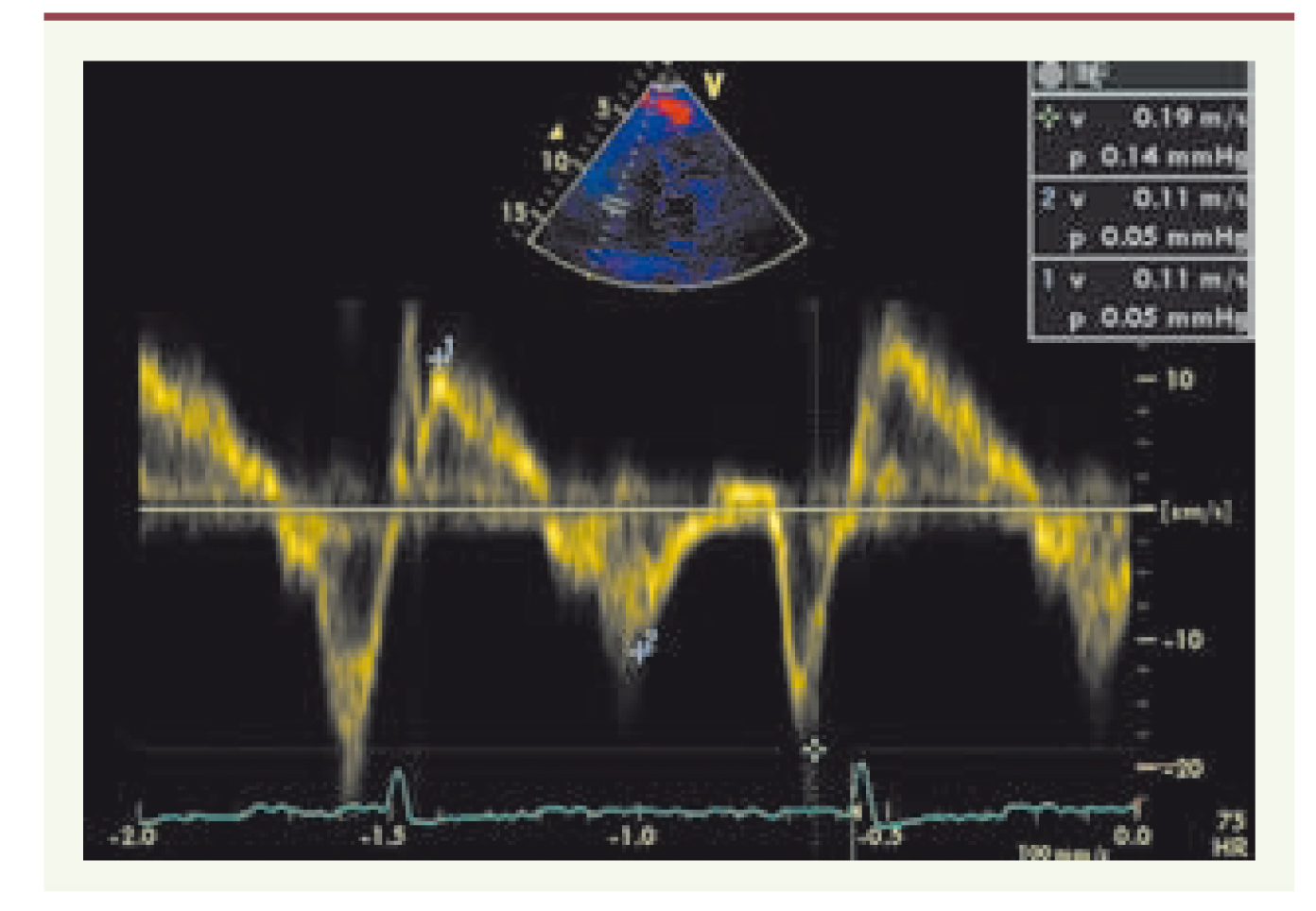
Fonction diastolique du VD La fonction diastolique du VD est influencée par plusieurs paramètres : la compliance et la relaxation du VD, la fréquence cardiaque et l’état du péricarde. L’analyse de la fonction diastolique du VD repose sur l’analyse du flux de remplissage tricuspide, du flux de l’insuffisance pulmonaire (IP), des pics diastoliques au doppler tissulaire myocardique (anneau tricuspide) et de la veine cave inférieure (VCI). Le flux tricuspide est composé d’une onde protodiastolique Et (relaxation du VD) et d’une onde télédiastolique At (systole auriculaire). Cependant, ce flux est rythmé par la respiration. Un rapport Et/At > 2 avec un temps de décélération court < 150 ms est en faveur d’une cardiopathie restrictive [
18]. Par ailleurs, la morphologie du flux de l’IP permet d’évaluer la pression diastolique du VD. Un aspect de l’IP en forme de dip plateau est évocateur d’adiastolie. L’adiastolie s’explique par une augmentation rapide de la pression du VD, à l’origine d’une diminution rapide du gradient entre l’artère pulmonaire et le VD pendant la diastole. L’adiastolie est souvent présente dans les pathologies cardiaques constrictive ou restrictive. La pression dans l’oreillette droite (OD) est évaluée de manière semi-quantitative à partir de l’analyse de la compliance de la VCI. |
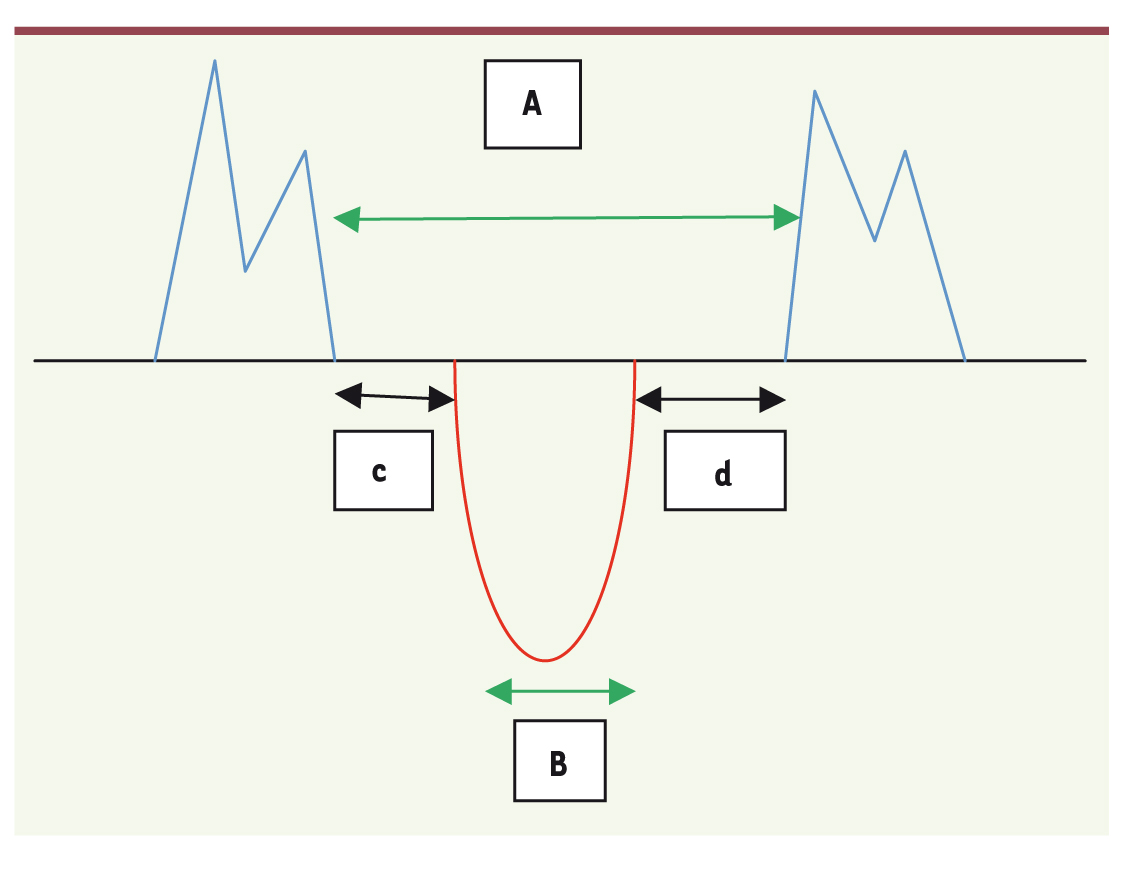
Index de performance myocardique (index de Tei) L’index de performance myocardique (IPM) permet d’évaluer la fonction systolique et la fonction diastolique ventriculaires. Il est calculé à partir des temps de contraction et de relaxation isovolumiques ventriculaires (Figure 4) [
19]. La valeur seuil de l’IPM est de 0,83. L’IPM est intéressant dans la mesure où ce paramètre s’affranchit des modèles géométriques. Cet index peut être calculé pour l’analyse du VG ou du VD. 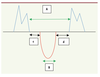 | Figure 4.
Représentation schématique du doppler pulsé tricuspidien et du doppler pulsé sous-pulmonaire pour le calcul l’index de performance myocardique (IPM).
B = temps d’éjection. A-B = c + d = TCIV + TRIV. IPM = (A-B)/B = TCIV + TRIV/temps d’éjection. c = TCIV = temps de contraction isovolumique. d = TRIV = temps de relaxation isovolumique. |
IPM = index de Tei = temps de contraction isovolumique + temps de relaxation isovolumique/temps d’éjection. Le rythme cardiaque du patient doit être régulier pour pouvoir calculer l’IPM. La mesure n’est donc pas valable en cas de fibrillation auriculaire. L’IPM s’allonge en cas d’atteinte des performances du VD. Ce paramètre présente par ailleurs un intérêt pronostique chez les patients ayant une HTAP idiopathique [
20]. |
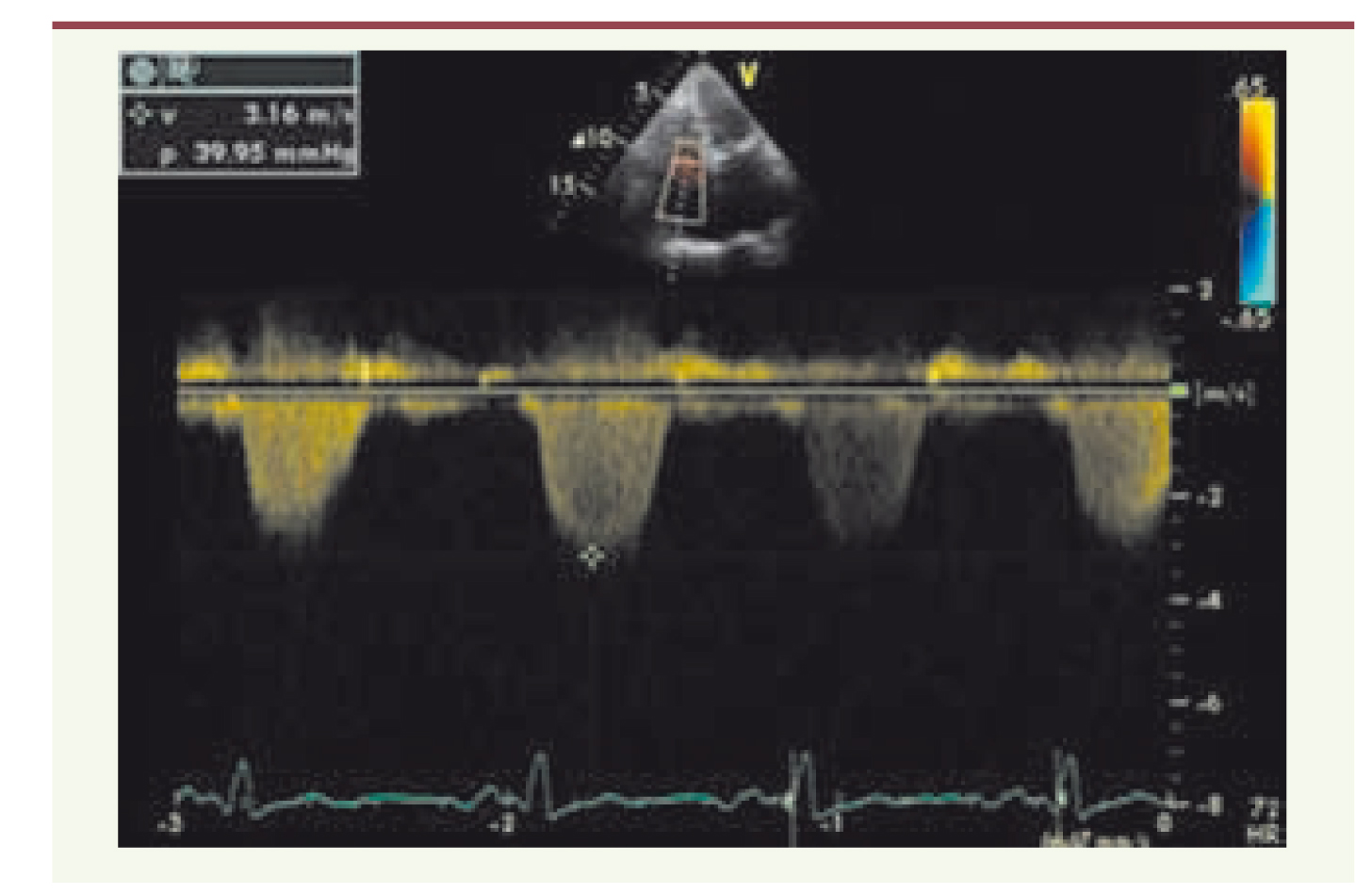
Calcul des pressions pulmonaires Les pressions pulmonaires reflètent la post-charge du VD, et il est important de les connaître dans l’évaluation de la fonction du cœur droit. Elles peuvent être évaluées à partir de la mesure, soit du flux d’insuffisance tricuspidienne (IT) (Figure 5), soit du flux d’insuffisance pulmonaire (IP).  | Figure 5.
Recueil du flux d’insuffisance tricuspidienne (IT) en Doppler continu. La pression artérielle pulmonaire systolique (PAPS) est calculée à partir de la vitesse maximale (V max) du flux de l’IT grâce à l’équation de Bernouilli : gradient de pression entre le ventricule droit et l’oreillette droite = 4 (Vmax)². Ici Vmax = 3,16 m/s donc le gradient de pression = 39,9 mmHg. La pression systolique du ventricule droit étant égale à la PAPS (en l’absence de sténose pulmonaire), on déduit ici la PAPS = 39,9 mm Hg + pression de l’oreillette droite. |
|
Aspect du flux d’éjection pulmonaire L’analyse de l’aspect du flux d’éjection pulmonaire peut aider au diagnostic d’HTAP. En cas d’HTAP chronique, le flux présente un aspect triangulaire avec un pic protosystolique et une encoche sur la phase de décélération [
23]. Par ailleurs, la mesure du temps d’accélération pulmonaire permet aussi une estimation indirecte des pressions pulmonaires. En effet, il existe une corrélation négative entre la PAP moyenne et le temps d’accélération pulmonaire. Ainsi, un temps d’accélération pulmonaire < 100 ms est évocateur d’une PAP moyenne > 20 mmHg (sensibilité de 95 %, spécificité de 97 %) [
24]. |
Apport de l’échocardiographie 3D L’échocardiographie 2D présente des limites dans la mesure où il est essentiel de se baser sur des modèles géométriques pour évaluer les volumes ventriculaires. L’analyse échocardiographique en 3D est intéressante car elle permet de surseoir à ces modèles géométriques utilisés en échocardiographie 2D. Dans ces conditions, l’évaluation des volumes ventriculaires et de la masse ventriculaire est plus performante qu’en échocardiographie 2D. L’examen peut être couplé à l’injection d’agents de contraste en vue d’une meilleure délimitation de l’endocarde du VD pour l’analyse des données. |
L’analyse de la fonction ventriculaire droite est importante et doit être systématique chez les patients atteints d’infarctus du myocarde, de valvulopathies, d’insuffisance cardiaque aiguë ou chronique, d’HTAP et chez les patients suivis pour une pathologie pulmonaire chronique. L’échocardiographie 2D (± 3D) couplée au doppler tissulaire myocardique fournit les paramètres essentiels dans cette optique et apporte une aide pour la décision thérapeutique et le suivi des patients.

|
1. Triulzi M, Gillam L, Gentile F, Weyman A. Normal adult cross sectional echocardiography values: linear dimensions and chamber areas. Echocardiography 1984; 1 : 403- 26. 2. Lorenz CH, Walker ES, Morgan VL, Klein SS, Graham TP Jr. Normal human right and left ventricular mass, systolic function, and gender differences by cine magnetic resonance imaging. J Cardiovascular Magn Reson 1999; 1 :7–21 3. Kaul S, Tei C, Hopkins JM, Shah PM. Assessment of right ventricular function using two-dimensional echocardiography. Am Heart J 1984; 107 : 526–31. 4. Ghio S, Recusani F, Klersy C, et al. Prognostic usefulness of the tricuspid annular plane systolic excursion in patients with congestive heart failure secondary to idiopathic or ischemic dilated cardiomyopathy. Am J Cardiol 2000; 85 : 837–42. 5. Forfia PR, Fisher MR, Mathai SC, et al. Tricuspid annular displacement predicts survival in pulmonary hypertension. Am J Respir Crit Care Med 2006; 174 : 1034–41. 6. Alam M, Wardell J, Andersson E, Samad BA, Nordlander R. Characteristics of mitral and tricuspid annular velocities determined by pulsed wave Doppler tissue imaging in healthy subjects. J Am Soc Echocardiogr 1999; 12 : 618–28. 7. Yilmaz M, Erol MK, Acikel M, Sevimli S, Alp N. Pulsed Doppler tissue imaging can help to identify patients with right ventricular infarction. Heart Vessels 2003; 18 : 112–6. 8. Meluzín J, Spinarová L, Bakala J, et al. Pulsed Doppler tissue imaging of the velocity of tricuspid annular systolic motion ; a new, rapid, and non-invasive method of evaluating right ventricular systolic function. Eur Heart J 2001; 22 : 340–8. 9. Meluzin J, Spinarová L, Hude P, et al. Prognostic importance of various echocardiographic right ventricular functional parameters in patients with symptomatic heart failure. J Am Soc Echocardiogr 2005; 18 : 435–44. 10. Lindqvist P, Caidahl K, Neuman-Andersen G, et al. Disturbed right ventricular diastolic function in patients with systemic sclerosis : a Doppler tissue imaging study. Chest 2005; 128 : 755–63. 11. Kowalski M, Kukulski T, Jamal F, et al. Can natural strain and strain rate quantify regional myocardial deformation ? A study in healthy subjects. Ultrasound Med Biol 2001; 27 : 1087–97. 12. Torrent-Guasp F, Ballester M, Buckberg GD, et al. Spatial orientation of the ventricular muscle band : physiologic contribution and surgical implications. J Thorac Cardiovasc Surg 2001; 122 : 389–92. 13. Jamal F, Bergerot C, Argaud L, Loufouat J, Ovize M. Longitudinal strain quantitates regional right ventricular contractile function. Am J Physiol Heart Circ Physiol 2003; 285 : H2842–7. 14. López-Candales A, Dohi K, Bazaz R, Edelman K. Relation of right ventricular free wall mechanical delay to right ventricular dysfunction as determined by tissue Doppler imaging. Am J Cardiol 2005; 96 : 602–6. 15. Vitarelli A, Conde Y, Cimino E, et al. Assessment of right ventricular function by strain rate imaging in chronic obstructive pulmonary disease. Eur Respir J 2006; 27 : 268–75. 16. Marwick TH. Measurement of strain and strain rate by echocardiography : ready for prime time ? J Am Coll Cardiol 2006; 47 : 1313–27. 17. Teske AJ, De Boeck BW, Olimulder M, et al. Echocardiographic assessment of regional right ventricular function : a head-to-head comparison between 2-dimensional and tissue Doppler-derived strain analysis. J Am Soc Echocardiogr 2008; 21 : 275–83. 18. Appleton CP, Hatle LK, Popp RL. Demonstration of restrictive ventricular physiology by Doppler echocardiography. J Am Coll Cardiol 1988; 11 : 757–68. 19. Tei C, Dujardin KS, Hodge DO, et al. Doppler echocardiographic index for assessment of global right ventricular function. J Am Soc Echocardiogr 1996; 9 : 838–47. 20. Yeo TC, Dujardin KS, Tei C, et al. Value of a Doppler-derived index combining systolic and diastolic time intervals in predicting outcome in primary pulmonary hypertension. Am J Cardiol 1998; 81 : 1157–61. 21. Mc Quillan BM, Picard MH, Leavitt M, Weyman AE. Clinical correlates and reference intervals for pulmonary artery systolic pressure among echocardiographically normal subjects. Circulation 2001; 104 : 2797–802. 22. Pepi M, Tamborini G, Galli C, et al. A new formula for echo-Doppler estimation of right ventricular systolic pressure. J Am Soc Echocardiogr 1994; 7 : 20–6. 23. Marchandise B, De Bruyne B, Delaunois L, Kremer R. Noninvasive prediction of pulmonary hypertension in chronic obstructive pulmonary disease by Doppler echocardiography. Chest 1987; 91 : 361–5. 24. Miguéres M, Escamilla R, Coca F, Didier A, Krempf M. Pulsed Doppler echocardiography in the diagnosis of pulmonary hypertension in COPD. Chest 1990; 98 : 280–5. |